Core e Valence Electrons
Como continuamos através da tabela periódica desta forma, escrevendo as configurações electrónicas de átomos cada vez maiores, torna-se enfadonho continuar a copiar as configurações das subcasas interiores preenchidas. Na prática, os químicos simplificam a notação, usando um símbolo de gás nobre entre parênteses para representar a configuração do gás nobre da linha anterior, pois todos os orbitais de um gás nobre são preenchidos. Por exemplo, representa a configuração eletrônica 1s2 2s2 2p6 de néon (Z = 10), portanto a configuração eletrônica de sódio, com Z = 11, que é 1s2 2s2 2p6 3s1, é escrito como 3s1
| Configuração Electrónica Completa | Nobel Gas Shorthand | ||
| Neon | Z = 10 | Ne: 1s2 2s2 2p6 | Ne: 2s2 2p6 |
| Sódio | Z = 11 |
Na: 1s2 2s2 2p6 3s1 |
Na: 3s1 |
Electrões em orbitais interiores cheios estão mais próximos do núcleo e mais firmemente ligados a ele, e por isso raramente estão envolvidos em reacções químicas. Vamos chamar esses núcleos de elétrons. Para os elementos representativos (colunas 1, 2, e 13-18 da Tabela Periódica), os elétrons do núcleo são todos elétrons com um valor n inferior ao valor n máximo na configuração eletrônica. Por exemplo, no átomo de sódio o maior valor de n é 3. Assim, os elétrons do núcleo são aqueles dos orbitais atômicos com n < 3, ou seja, aqueles dos orbitais 1s, 2s e 2p. Assim, o sódio tem 10 elétrons do núcleo. Mais tarde revisaremos esta definição de elétrons do núcleo para metais de transição.
Isto significa que a química de um átomo depende principalmente dos elétrons em sua casca mais externa, aqueles com o maior valor de n, que são chamados de elétrons de valência. A notação simplificada permite-nos ver mais facilmente a configuração valência-electrão. Usando esta notação para comparar as configurações de elétrons de sódio e lítio, nós temos:
| Sódio | 1s2 2s2 2p6 3s1 | 3s1 |
| Lithium | 1s2 2s1 | 2s1 |
É facilmente visível que tanto o sódio como o lítio têm um electrão na sua casca de valência. Portanto, poderíamos prever que o sódio e o lítio têm uma química muito semelhante, o que é de fato o caso.
Como continuamos a construir os oito elementos do período 3, os orbitais 3s e 3p são preenchidos, um elétron de cada vez. Esta linha conclui com o argônio de gás nobre, que tem a configuração eletrônica 3s2 3p6, correspondente a uma concha de valência preenchida.
Exemplo 2.2.2
Traçar um diagrama orbital e utilizá-lo para derivar a configuração eletrônica do fósforo, Z = 15. Qual é a sua configuração eletrônica de valência?
Dado: número atômico
Passado para: diagrama orbital e configuração eletrônica de valência do fósforo
Estratégia:
- >
- Localize na tabela periódica o gás nobre mais próximo antes do fósforo. Então subtraia seu número de elétrons daqueles no fósforo para obter o número de elétrons de valência no fósforo.
- Referindo à Figura 2.1.1, desenhe um diagrama orbital para representar aqueles orbitais de valência. Seguindo a regra de Hund, coloque os elétrons de valência nos orbitais disponíveis, começando com o orbital que está mais baixo em energia. Escreva a configuração eletrônica a partir do seu diagrama orbital.
- Ignore as orbitais internas (aquelas que correspondem à configuração eletrônica do gás nobre mais próximo) e escreva a configuração eletrônica de valência do fósforo.
Solução:
A Como o fósforo está na terceira linha da tabela periódica, sabemos que tem uma casca fechada com 10 elétrons. Nós começamos subtraindo 10 elétrons dos 15 em fósforo.
B Os cinco elétrons adicionais são colocados nos próximos orbitais disponíveis, que Figura 2.1.1 nos diz que são os orbitais 3s e 3p:
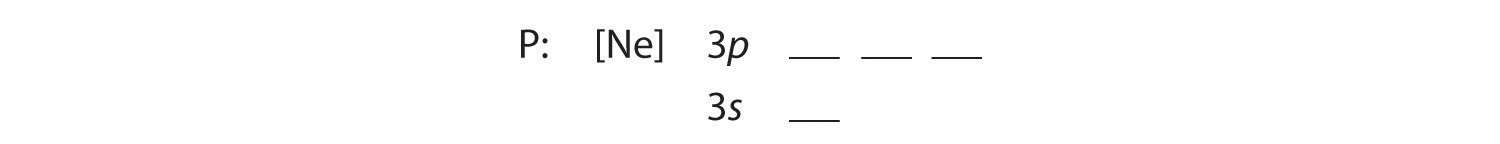
Porque o orbital 3s é menor em energia do que os orbitais 3p, nós o enchemos primeiro:
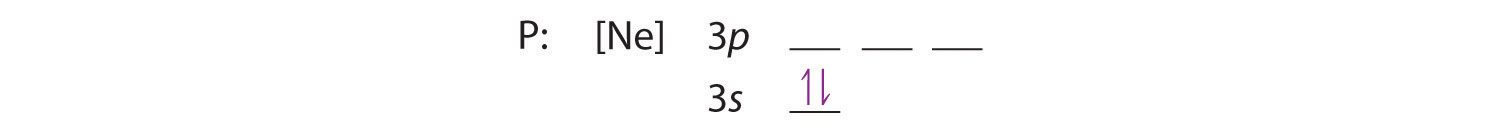
A regra dos Cem diz-nos que os restantes três electrões ocuparão os orbitais 3p degenerados separadamente mas com as suas rotações alinhadas:
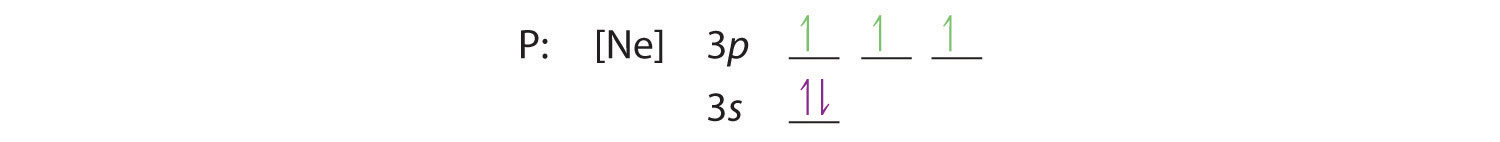
A configuração dos electrões é 3s2 3p3.
C Obtemos a configuração de electrões de valência ignorando as orbitais internas, o que para o fósforo significa que ignoramos a casca fechada. Isto dá uma configuração valência-electrão de 3s2 3p3.
Exercício 2.2.2
Traçar um diagrama orbital e utilizá-lo para derivar a configuração electrónica do cloro, Z = 17. Qual é a sua configuração eletrônica de valência?
Resposta: 3s2 3p5
Configuração electrónica de valência: 3s23p5
A ordem geral em que os orbitais são preenchidos é mostrada na Figura 2.2.1. As subcasas correspondentes a cada valor de n são escritas da esquerda para a direita em linhas horizontais sucessivas, onde cada linha representa uma linha na tabela periódica. A ordem na qual as orbitais são preenchidas é indicada pelas linhas diagonais que vão da parte superior direita para a parte inferior esquerda. Assim, o orbital 4s é preenchido antes do orbital 3d, devido aos efeitos de blindagem e penetração. Consequentemente, a configuração eletrônica do potássio, que inicia o quarto período, é 4s1, e a configuração do cálcio é 4s2. Cinco orbitais 3d são preenchidos pelos 10 elementos seguintes, os metais de transição, seguidos por três orbitais 4p. Note que o último membro desta linha é o krypton de gás nobre (Z = 36), Kr: 4s2 3d10 4p6, que preencheu as orbitais 4s, 3d, e 4p. A quinta linha da tabela periódica é essencialmente a mesma que a quarta, exceto que os orbitais 5s, 4d e 5p são preenchidos sequencialmente.
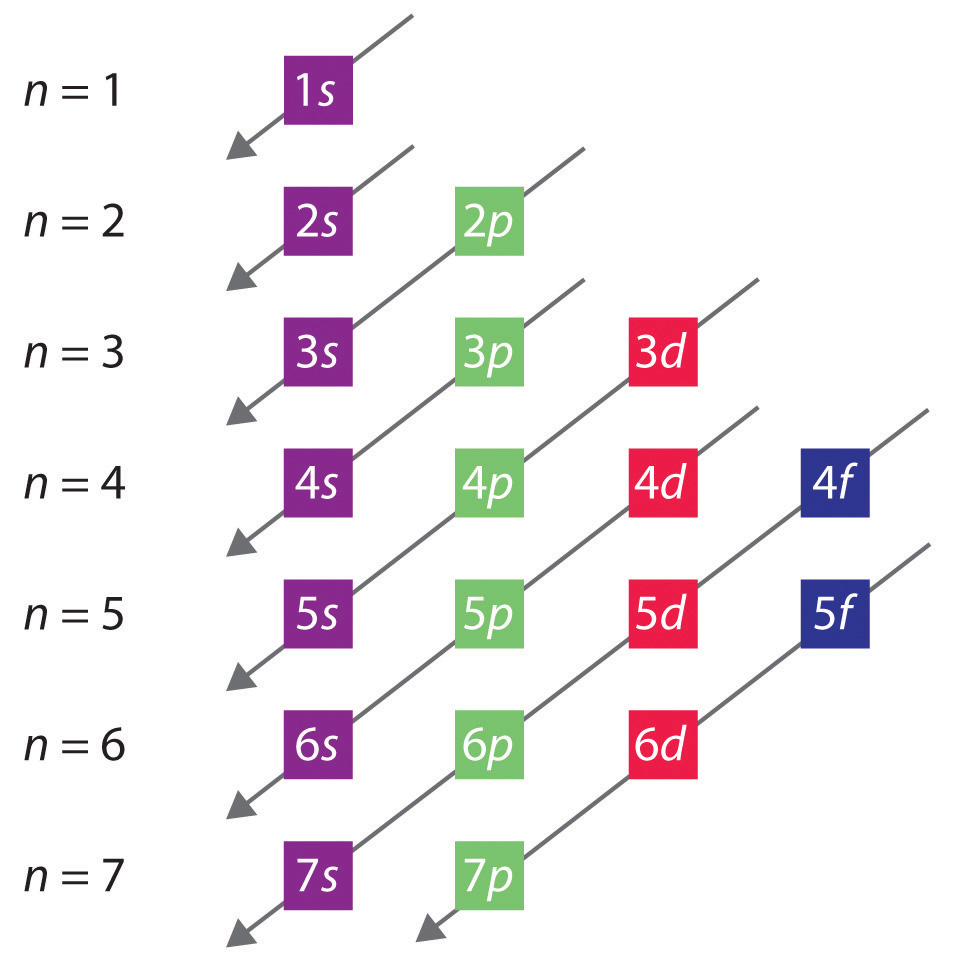
Figure 2.2.1 Prevendo a Ordem em que os orbitais são preenchidos em átomos multieletrônicos. Se você escrever as subcasas para cada valor do número quântico principal em linhas sucessivas, a ordem observada em que elas são preenchidas é indicada por uma série de linhas diagonais correndo da parte superior direita para a parte inferior esquerda.
A sexta linha da tabela periódica será diferente das duas anteriores porque os 4f orbitais, que podem conter 14 elétrons, são preenchidos entre os 6s e os 5d orbitais. Os elementos que contêm 4f orbitais em sua casca de valência são os lanthanides. Quando as orbitais 6p estão finalmente preenchidas, chegamos ao próximo (e último conhecido) gás nobre, rádon (Z = 86), Rn: 6s2 4f14 5d10 6p6. Na última linha, os 5f orbitais são preenchidos entre os 7s e os 6d orbitais, o que dá os 14 elementos actinídeos. Como o grande número de prótons torna seus núcleos instáveis, todos os actinídeos são radioativos.
Exemplo 2.2.3
Escrever a configuração eletrônica do mercúrio (Z = 80), mostrando todos os orbitais internos.
>
Dado: número atómico
Passado para: configuração electrónica completa
Estratégia:
Utilizando o diagrama orbital da Figura 2.2.1 e a tabela periódica como guia, preencha os orbitais até que todos os 80 electrões tenham sido colocados.
Solução:
>
Pondo os electrões em orbitais seguindo a ordem mostrada na Figura 2.2.1 e usando a tabela periódica como um guia, obtemos
| 1s2 | seta 1 | 2 elétrons |
| 2s22p6 | seta 2 | 8 elétrons |
| 3s23p6> | linha 3 | 8 elétrons |
| 4s23d104p6 | linha 4 | 18 elétrons |
| 5s24d105p6 | linha 5 | 18 elétrons |
| seta 1-5 | 54 elétrons |
Após o preenchimento das primeiras cinco filas, ainda temos 80 – 54 = 26 elétrons a mais para acomodar. De acordo com a Figura 2.2.2, precisamos preencher os orbitais 6s (2 elétrons), 4f (14 elétrons), e 5d (10 elétrons). O resultado é a configuração eletrônica do mercúrio:
Hg: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10
Hg: 6s2 4f14 5d10
com uma sub-camada 5d cheia, uma configuração de casca de valência 6s2 4f14 5d10, e um total de 80 electrões. (Você deve sempre verificar se o número total de elétrons é igual ao número atômico.)
Exercício 2.2.3
Embora o elemento 114 não seja estável o suficiente para ocorrer na natureza, dois isótopos do elemento 114 foram criados pela primeira vez em um reator nuclear em 1999 por uma equipe de cientistas russos e americanos. Escreva a configuração eletrônica completa para o elemento 114.
Resposta: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p2
As configurações eletrônicas dos elementos são apresentadas na Figura 2.2.3, que lista os orbitais na ordem em que são preenchidos. Em vários casos, as configurações dos elétrons de estado de terra são diferentes das previstas na Figura 2.2.1. Algumas destas anomalias ocorrem quando as orbitais 3d são preenchidas. Por exemplo, a configuração dos elétrons de cromo observada é 4s1 3d5 e não a prevista 4s2 3d4. Da mesma forma, a configuração eletrônica de cobre observada é 4s1 3d10 em vez de s2 3d9. A configuração electrónica real pode ser racionalizada em termos de uma estabilidade adicional associada a uma subesfera meio preenchida (ns1, np3, nd5, nf7) ou cheia (ns2, np6, nd10, nf14). Dadas as pequenas diferenças entre níveis de energia mais elevados, esta estabilidade acrescentada é suficiente para deslocar um electrão de um orbital para outro. Em elementos mais pesados, outros efeitos mais complexos também podem ser importantes, levando a algumas das anomalias adicionais indicadas na Figura 2.2.3. Por exemplo, o cério tem uma configuração eletrônica de 6s2 4f1 5d1, que é impossível de racionalizar em termos simples. Na maioria dos casos, porém, estas anomalias aparentes não têm consequências químicas importantes.
Nota
Estabilidade adicional está associada a sub-camadas meio cheias ou cheias.