Atomen kunnen elektronen winnen of verliezen om ionen te vormen in een proces dat ionisatie wordt genoemd (verbindingen die op deze manier worden gevormd worden ionische verbindingen genoemd). Wanneer ionische verbindingen oplossen in water, scheiden hun ionen zich van elkaar in een proces dat dissociatie wordt genoemd. Een interessante eigenschap van water en veel andere covalente verbindingen is dat ook zij kunnen dissociëren in ionen. In tegenstelling tot ionische verbindingen, zoals natriumchloride, worden ze niet geïoniseerd voordat ze dissociëren; ze bereiken ionisatie en dissociatie op hetzelfde moment.
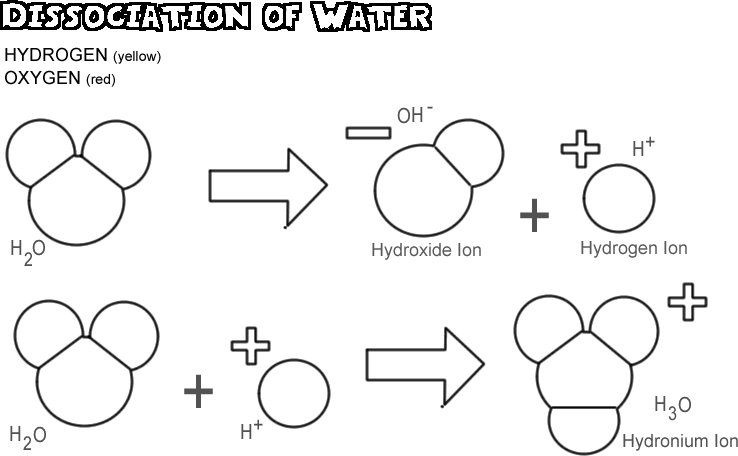
Dissociatie van water
Wanneer water dissocieert, laat een van de waterstofkernen zijn elektron achter bij het zuurstofatoom om een waterstofion te worden, terwijl de zuurstof- en andere waterstofatomen een hydroxide-ion worden. Aangezien het waterstofion geen elektron heeft om de positieve lading van zijn proton te neutraliseren, heeft het een volledige eenheid van positieve lading en wordt het gesymboliseerd als H+. Het hydroxide-ion behoudt het achtergebleven elektron en heeft dus een volledige eenheid van negatieve lading, gesymboliseerd door OH-. Het waterstofion (proton) dwaalt niet lang alleen rond voordat het zich hecht aan het zuurstofatoom van een tweede niet-geïoniseerd watermolecuul om een hydroniumion te vormen (H3O +)
In een willekeurig monster water worden slechts zeer weinig moleculen op een bepaald moment uit elkaar gehaald: in feite slechts ongeveer één op 550 miljoen. Er is echter een voortdurende verandering; als een waterstofion zich opnieuw aan een hydroxide-ion bindt om een watermolecuul te vormen, dissocieert een ander watermolecuul om het waterstofion en het hydroxide-ion in oplossing te vervangen.
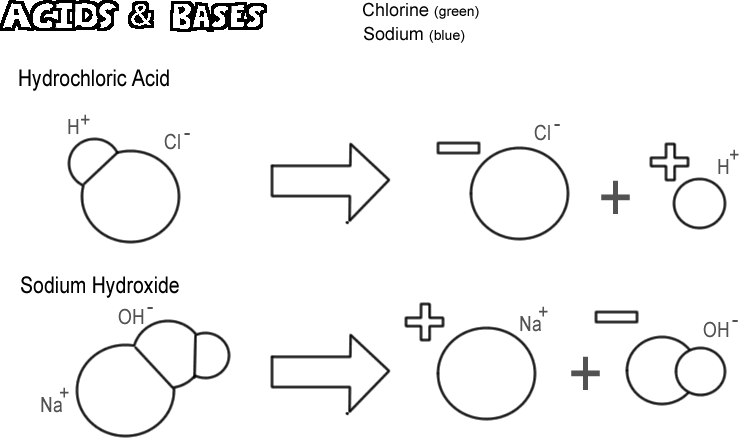
Hydrochlorisch zuur
Zekere moleculen, ionisch en covalent, dissociëren op zodanige wijze dat zij een waterstofion vrijmaken zonder een hydroxide-ion vrij te maken. Deze stoffen worden zuren genoemd. Aangezien een waterstofion in de meeste gevallen slechts één enkel proton is, is de scheikundige definitie van een zuur een “proton-donor”. Als zeer vele protonen (waterstofionen) worden “geschonken” kan het effect zeer diepgaand zijn, zoals het branden van uw huid of het oplossen van metaal. Het afgebeelde zuur is zoutzuur. Zuiver zoutzuur is een gas, maar het lost gemakkelijk in water op om een oplossing van waterstofion en chloride-ion te produceren. Aangezien het bijna volledig in water wordt opgelost, wordt het een sterk zuur genoemd. Zuren die niet volledig oplossen worden zwakke zuren genoemd.
Natriumhydroxide
Het tegenovergestelde van een zuur is een base, ook wel alkali genoemd. Een typische sterke base is natriumhydroxide, het hoofdbestanddeel van loog. Natriumhydroxide valt uiteen in een natriumion en een hydroxide-ion. Een base wordt gedefinieerd als een “proton-acceptor”. De meest voorkomende basen produceren een hydroxide-ion wanneer ze dissociëren, en het is het hydroxide-ion dat het proton accepteert. Een sterke base kan je huid veel erger verbranden dan een zuur.
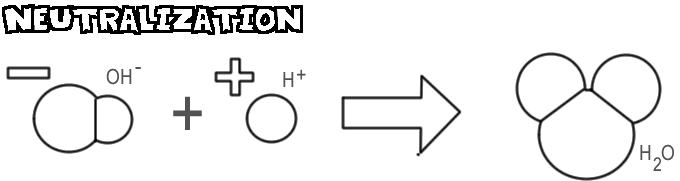
Neutralisatie
Wanneer een base en een zuur worden gemengd, combineert het hydroxide-ion van de base met het waterstofion van het zuur om water te vormen. Dit proces wordt neutralisatie genoemd.
Vragen:
1. Wat gebeurt er als een atoom een elektron krijgt of verliest?