J Cancer 2020; 11(6):1341-1350. doi:10.7150/jca.40817
Onderzoekspaper
Amy C. Moreno1, Yan Heather Lin2, Isabelle Bedrosian3, Yu Shen2, Gildy V. Babiera3, Simona F. Shaitelman1 ![]()
1. Department of Radiation Oncology, The University of Texas MD Anderson Cancer Center, Houston, TX.
2. Department of Biostatistics, The University of Texas MD Anderson Cancer Center, Houston, TX.
3. Department of Surgical Oncology, The University of Texas MD Anderson Cancer Center, Houston, TX.
Moreno AC, Lin YH, Bedrosian I, Shen Y, Babiera GV, Shaitelman SF. Uitkomsten na behandeling van metaplastische versus andere subtypen van borstkanker. J Cancer 2020; 11(6):1341-1350. doi:10.7150/jca.40817. Beschikbaar via https://www.jcancer.org/v11p1341.htm
Doel: Metaplastische borstkanker (BC) is een ongebruikelijk maar agressief histologisch subtype van BC. Wij hebben getracht factoren te identificeren die verband houden met de diagnose en het beheer en de resultaten van metaplastisch BC te vergelijken met die van andere BC en triple-negatief invasief ductaal carcinoom in het bijzonder, gezien het feit dat het vaak een triple-negatief fenotype heeft.
Patiënten en Methoden: We identificeerden vrouwen gediagnosticeerd met invasief BC in 2010-2014 in de National Cancer Data Base, en gebruikten univariate analyse om baseline patiënt- en tumorkarakteristieken te vergelijken per BC-subtype. Algehele overleving (OS) werd geschat met de Kaplan-Meier methode, en multivariate Cox proportional hazards modellen werden gebruikt om onafhankelijke voorspellers van OS te identificeren.
Resultaten: Van 247.355 gevallen waren 2.084 (0,8%) metaplastische BC, 55.998 (23%) triple negatieve BC, en 77% andere BC. Vergeleken met niet-metaplastische BC, hadden vrouwen met metaplastische BC meer kans om ouder te zijn bij diagnose (mediane leeftijd, 62 vs. 59 jaar), ≥1 comorbide aandoening te hebben (22% vs. 18%), en bij Medicare te zijn (41% vs. 33%; P<0.001). Metaplastische BCs hadden de neiging basaal-achtig te zijn (77%), en in vergelijking met triple-negatieve of andere BC, was metaplastische BC geassocieerd met hogere klinische T-status (cT3-4, 18% vs. 11%, 8%), geen klinische nodale betrokkenheid (cN0, 86%, 77%, 80%), geen lymfovasculaire invasie (72%, 65%, 62%), en tumoren van hoge graad (71%, 77%, 35%) (P<0,001). De meeste metaplastische BCs werden behandeld met mastectomie (58%), sentinel lymfeklier dissectie (65%), bestraling van borstwand of borst (74%), en chemotherapie (75%) als adjuvante therapie (60%). Bij een mediane follow-up tijd van 44,5 maanden waren de OS-percentages lager voor metaplastische BC dan voor triple-negatieve of andere BC in alle klinische stadia op 5 jaar (stadium I, 85%, 87%, 91%; II, 73%, 77%, 87%; III, 43%, 53%, 75%) en op 3 jaar (stadium IV, 15%, 22%, 64%; P<0,001). Bij multivariate analyse waren toenemende leeftijd, gevorderd klinisch stadium, lymfovasculaire invasie, axillaire (vs. sentinel) node dissectie, en geen bestraling of chemotherapie geassocieerd met slechtere uitkomsten in metaplastisch BC. De mate van chirurgie beïnvloedde de overleving voor triple-negatieve en andere BC maar niet voor metaplastische BC.
Conclusie: De uitkomsten voor metaplastisch BC blijven slechter dan die voor andere BC-subtypen, ondanks moderne behandelingen. Het optimaliseren van systemische therapie opties, wat een significante voorspeller van overleving was, zou een prioriteit moeten zijn bij het managen van metaplastisch BC.
Keywords: metaplastische borstkanker, triple negatieve borstkanker, borstkanker uitkomsten, bestralingstherapie, chemotherapie.
Inleiding
Hoewel borstkanker de meest voorkomende kankerdiagnose is bij vrouwen, met meer dan 268.000 gedocumenteerde gevallen per jaar, maakt metaplastische borstkanker (BC) minder dan 1%-2% uit van alle borstkankergevallen. Klinisch manifesteert metaplastisch BC zich als een snel groeiende borstmassa met complexe echogeniciteit (d.w.z. vaste en cysteuze componenten) op ultrasonografie en een massa met hoge dichtheid op mammografie. Histologisch gezien bestaat metaplastisch BC uit een heterogene populatie van tumoren die kunnen worden geclassificeerd door de aanwezigheid van niet-glandulaire of mesenchymale celtypes of door verdere categorisatie in subtypes afhankelijk van de aanwezigheid van verschillende kenmerken zoals osteoclastische reuscellen of spindelcellen.
Bij presentatie is het percentage klinische lymfeklierbetrokkenheid bij metaplastisch BC typisch laag. Metaplastisch BC wordt echter vaker gediagnosticeerd in gevorderde klinische stadia als gevolg van grotere primaire tumoren in vergelijking met andere BCs en wordt geassocieerd met hogere percentages chemoresistentie, metastasering op afstand en slechtere overall survival (OS). Metaplastisch BC heeft een bijzonder hoge prevalentie van triple-negatieve receptor status of de afwezigheid van oestrogeenreceptor, progesteronreceptor, en humane epidermale groeifactor receptor 2 (HER2) amplificatie. Zonder targetbare eiwitten blijft metaplastisch BC moeilijk te behandelen. Prospectieve gegevens zijn beperkt voor het kiezen van de beste behandeling voor metaplastisch BC gezien de zeldzaamheid van de diagnose. In plaats daarvan is een groot deel van de huidige standaard van zorg voor metaplastisch BC geëxtrapoleerd uit bevindingen van kleine series van enkele instellingen of case reports. Daarom hebben wij gebruik gemaakt van de National Cancer Data Base (NCDB), waarin ongeveer 70% van alle gediagnosticeerde kankergevallen in de Verenigde Staten zijn opgenomen, om de kenmerken, het management en de resultaten op basis van behandeling en tumorkenmerken van patiënten met metaplastisch BC te evalueren in vergelijking met die met triple-negatief BC en alle andere BC subtypes. We gebruikten ook multivariate analyse om onafhankelijke voorspellers van overleving te identificeren voor vrouwen met metaplastisch BC.
Data Source and Cohort Selection
Een gezamenlijk project dat in 1989 werd opgericht door de Commission on Cancer van het American College of Surgeons en de American Cancer Society, heeft de NCDB oncologische gegevens verzameld van ongeveer 1.500 geaccrediteerde faciliteiten in de Verenigde Staten, met een totaal van meer dan 34 miljoen records. De beschikbare patiëntinformatie is geanonimiseerd en daarom vrijgesteld van het toezicht op de bescherming van mensen door de institutionele beoordelingsraad.
De selectiecriteria die voor deze studie zijn gebruikt, worden geschetst in figuur 1. Vrouwen van 18 jaar en ouder bij wie invasieve borstkanker werd gediagnosticeerd van 2010 tot en met 2014 werden geïncludeerd. Patiënten met onbekende hormoon (oestrogeen en progesteron) receptor (HR) status werden uitgesloten. Bijkomende redenen voor uitsluiting waren ontbrekende informatie over chirurgie, chemotherapie, of klinische stadiëring volgens de American Joint Committee On Cancer (AJCC) 6e of 7e editie. De patiënten werden vervolgens gestratificeerd in drie groepen: 1-metaplastisch BC (met de histologiecodes 8575 of 8573), 2- triple-negatief BC (TNBC, dat alleen niet-metaplastische histologieën omvat), en 3-alle andere resterende typen BC. De term “niet-metaplastische BC” werd gebruikt om te verwijzen naar triple-negatieve BC en andere BC samen.
CONSORT-diagram. BC, borstkanker.
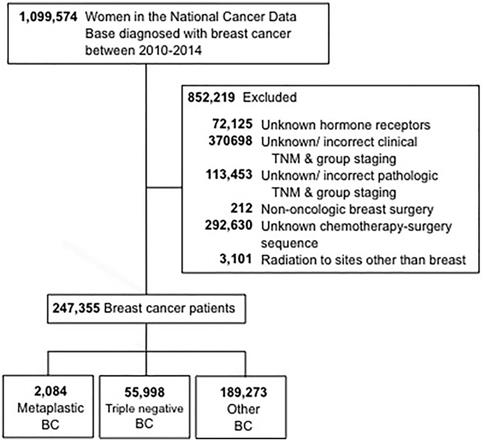 (Klik op de afbeelding om te vergroten.)
(Klik op de afbeelding om te vergroten.)
Variabelen
Informatie verkregen en geanalyseerd uit de NCDB omvatte de leeftijd van de patiënt bij diagnose, jaar van diagnose, ras, Charlson/Deyo comorbiditeitsindex, ziektekostenverzekeringsstatus, mediaan gezinsinkomen, en type behandelende instelling (gedichotomiseerd in academisch/onderzoeks versus niet-academisch). Klinisch-pathologische kenmerken omvatten AJCC klinische T en N (nodale) aanwijzing, algemene AJCC klinische stadiumgroep, HR status, HER2 receptor status, tumorgraad, en lymfovasculaire invasie (LVSI). Moleculaire subtypes werden gedefinieerd als HR(+)/HER2(-), HER2(+), triple-negatief (oestrogeen receptor(-), progesteron receptor (-), HER2(-)), of onbekend. Patiënten met metaplastisch BC met triple-negatieve receptor status werden aangeduid als tn-metaplastisch BC om hen te onderscheiden van niet-metaplastisch TNBC. De primaire behandeling omvatte chirurgie (borstsparend, mastectomie of geen borstsparend), bestralingstherapie met of zonder regionale nodale bestraling, chemotherapie (neoadjuvant, adjuvant of geen) en hormoontherapie. Chirurgische behandeling van de axilla werd gedefinieerd als ofwel een axillaire knoopdissectie (ALND), waarbij 10 lymfeklieren of meer werden verwijderd, of een sentinel lymfeklierdissectie (SLND), wanneer <10 lymfeklieren werden verwijderd.
Statistische analyse
Univariate analyse werd gebruikt om mogelijke associaties tussen demografische, tumor en klinische kenmerken en een diagnose van metaplastisch BC te evalueren, met behulp van chi-kwadraat toetsen voor categorische variabelen en t-test/analyse van variantie of hun tegenhangers van de niet-parametrische benaderingen (Wilcoxon rank-sum of Kruskal-Wallis) voor continue variabelen. OS werd gedefinieerd als vanaf het tijdstip van diagnose tot het tijdstip van overlijden. De OS-tijd voor de overlevende patiënten werd rechts gecensureerd op het tijdstip van het laatste contact. De verdeling van de OS werd geschat met de Kaplan-Meier methode. De log-rank test werd gebruikt om het verschil in overleving tussen groepen te testen. Regressieanalyses van overlevingsgegevens op basis van het Cox proportionele hazards model werden uitgevoerd op de OS. Een multivariaat Cox-proportioneel hazards-model werd verkregen door eerst een initiële reeks kandidaat-voorspellende variabelen met een P-waarde < 0,05 in de univariate analyse op te nemen. Vervolgens werd stapsgewijze achterwaartse eliminatie gebruikt, met 0,05 voor het significantieniveau van de Wald chi-kwadraat voor een effect om in het model te blijven.
De overlevingsanalyses werden uitgevoerd binnen elk van de kankertypes afzonderlijk.
Faciliteitslocatie en -type werden niet opgenomen in het metaplastische BC modelselectieproces omdat geen van beide factoren statistisch significant was voor deze groep in de univariate setting en gegevens niet volledig beschikbaar waren voor patiënten jonger dan 40 jaar. Om te onderzoeken of details van systemische therapie en bestraling van invloed waren op de resultaten van patiënten met metaplastisch BC, hebben wij subset-analyses uitgevoerd op dit cohort om de mogelijke invloed van de opeenvolging van chemotherapie en de mate van bestraling op de OS te evalueren. Alle tests waren tweestaartig, en statistische significantie werd gedefinieerd als een P-waarde <0,05. SAS versie 9.4 (SAS Institute, Cary, NC) en S-Plus versie 8.2 (TIBCO Software Inc, Palo Alto, CA) werden gebruikt om de berekeningen voor alle analyses uit te voeren.
Cohort- en tumorkenmerken
We identificeerden 247.355 vrouwen met een diagnose invasieve borstkanker in 2010-2014, van wie 0,8% (n=2.084) metaplastische BC had, 23% (n=55.998) TNBC, en 77% (n=189.273) andere BC had. De sociodemografische, klinische en pathologische tumorkarakteristieken van de patiënten en de behandelingskarakteristieken per type BC zijn weergegeven in Tabel 1. De mediane leeftijd was 63 jaar (range 22-90) voor vrouwen met metaplastisch BC en 59 jaar (range 18-90) jaar voor zowel TNBC als ander BC. Vrouwen met metaplastisch BC hadden vaker een comorbiditeitsscore van ≥1 (22% vs. 18% TNBC vs. 16% ander BC) en waren verzekerd bij de overheid (50% vs. 42% TNBC vs. 41% ander BC) (alle P<0,001). De diagnose metaplastisch BC of TNBC werd vaker geassocieerd met zwart ras dan met ander BC (18% vs. 21% vs. 11%, P<0,001).
Significante verschillen in klinisch ziektestadium en tumorkenmerken werden gezien per kankertype. Metaplastisch BC werd vaak gediagnosticeerd in verder gevorderde stadia, met slechts 31% van de patiënten met metaplastisch BC met klinisch stadium I ziekte versus 46% van TNBC en 54% van andere BC (P<0,001). Dit patroon leek te correleren met hogere percentages van grotere tumoren in de metaplastische BC groep (cT3-4, 18% vs. 11% vs. 8%, respectievelijk), maar de aanwezigheid van klinische nodale betrokkenheid was het laagst voor metaplastisch BC (cN1-3, 14% vs. 23% vs. 20%, respectievelijk) (alle P<0.001). In tegenstelling tot de klinische nodale status, was het percentage pathologische nodale betrokkenheid iets lager voor metaplastisch BC en TNBC, maar verdubbeld voor ander BC (pN1-3, 18% vs. 26% vs. 40%, respectievelijk, P<0,001). Met betrekking tot de receptor status, had 77% van de metaplastische BC groep tn-metaplastisch BC, wat 3,4 keer hoger is dan de niet-metaplastische BC groep (23%), waarvan HR(+)/HER2(-) het meest voorkomende moleculaire subtype was met 59% (P<0,001). Bovendien was slechts 5% van de metaplastische BC HER2(+) vergeleken met 16% van de niet-metaplastische BC. Zowel metaplastisch BC als TNBC hadden bijna tweemaal het aandeel graad 3 tumoren in vergelijking met andere BC (71%, 77%, en 35%, respectievelijk, P<0,001), en metaplastisch BC had lagere percentages LVSI in vergelijking met TNBC en andere BC (13%, 20%, en 24%, respectievelijk, P<0,001).
Patiënt- en behandelingskenmerken.
| Karakteristieken | Metaplastisch BC, No. (%) | Triple-Negatief BC, No. (%) | Ander BC, No. (%) | P Waarde | |
|---|---|---|---|---|---|
| Mediane leeftijd, jaren (spreiding) | 62 (22-90) | 59 (18-90) | <0.001 | ||
| Race | |||||
| Wit | 1623 (77.9) | 41791 (74.6) | 158406 (83.7) | <0.001 | |
| Zwart | 368 (17.7) | 11771 (21) | 20722 (10.9) | ||
| Ander | 80 (3.8) | 2041 (3.6) | 8507 (4.5) | ||
| Onbekend | 13 (0.6) | 395 (0.7) | 1638 (0.6) | 1638 (0.6) | |
| .9) | |||||
| Comorbiditeitsscore | |||||
| 0 | 1635 (78.5) | 45882 (81.9) | 158177 (83.6) | <0.001 | |
| 1 | 349 (16.7) | 8107 (14.5) | 25524 (13.5) | ||
| >=2 | 100 (4.8) | 2009 (3.6) | 5572 (2.9) | ||
| Mediaan inkomen | |||||
| <$30.000 | 251 (12) | 7110 (12.7) | 19154 (10.) | <0.001 | |
| $30,000-$34,999 | 332 (15.9) | 9081 (16.2) | 28472 (15) | ||
| $35,000-$45,999 | 580 (27.8) | 15084 (26.9) | 48845 (25.8) | ||
| $46,000+ | 858 (41.2) | 23050 (41.2) | 86637 (45.8) | ||
| Onbekend | 63 (3) | 1673 (3) | 6165 (3.3) | ||
| Medische verzekering | |||||
| Particulier | 975 (46.8) | 30263 (54) | 105839 (55.9) | <0.001 | |
| Medicaid | 154 (7.4) | 4716 (8.4) | 13267 (7) | ||
| Medicare | 862 (41.4) | 18355 (32.8) | 61535 (32.5) | ||
| Andere | 19 (0.9) | 665 (1.2) | 2212 (1.2) | ||
| Onverzekerd | 43 (2.1) | 1422 (2.5) | 4163 (2.2) | ||
| Onbekend | 31 (1..5) | 577 (1) | 2257 (1.2) | ||
| County type | |||||
| Metropolitan | 1720 (82.5) | 46252 (82.6) | 157058 (83) | 0.152 | |
| Stedelijk | 271 (13) | 7456 (13.3) | 24367 (12.9) | ||
| Platteland | 43 (2.1) | 951 (1.7) | 3219 (1.7) | ||
| Onbekend | 50 (2.4) | 1339 (2.4) | 4629 (2.4) | ||
| Faciliteitstype | |||||
| Academisch | 668 (32.1) | 16117 (28.8) | 52120 (27.5) | <0.001 | |
| Niet-academisch | 1318 (63.2) | 35472 (63.3) | 126101 (66.6) | ||
| Onbekend | 98 (4.7) | 4409 (7.9) | 11052 (5.8) | ||
| Faciliteitslocatie | |||||
| Midwest | 614 (29.5) | 14132 (25.2) | 46644 (24.6) | <0.001 | |
| Noordoost | 410 (19,7) | 10411 (18,6) | 37787 (20) | ||
| Zuid | 716 (34,4) | 20595 (36.8) | 66519 (35.1) | ||
| West | 246 (11.8) | 6451 (11.5) | 27271 (14.4) | ||
| Onbekend | 98 (4.7) | 4409 (7.9) | 11052 (5.8) | ||
| Clinisch ziektestadium | |||||
| I | 639 (30.7) | 25843 (46.1) | 102257 (54) | <0.001 | |
| II | 1215 (58.3) | 23912 (42.7) | 70846 (37.4) | ||
| III | 201 (9.6) | 5579 (10) | 14283 (7.5) | ||
| IV | 29 (1.4) | 664 (1.2) | 1887 (1) | ||
| Klinische T-status | |||||
| cT0 | 5 (0.2) | 131 (0.2) | 341 (0.2) | <0.001 | |
| cT1 | 674 (32.3) | 28452 (50.8) | 113113 (59.8) | ||
| cT2 | 1026 (49.2) | 21530 (38.4) | 61145 (32.3) | ||
| cT3 | 252 (12.1) | 3702 (6.6) | 10061 (5.3) | ||
| cT4 | 127 (6.1) | 2183 (3.9) | 4613 (2.4) | ||
| Clinical N status | |||||
| cN0 | 1787 (85.7) | 43357 (77.4) | 150890 (79.7) | <0.001 | |
| cN1 | 224 (10.7) | 9659 (17.2) | 30427 (16.1) | > | |
| cN2 | 51 (2.4) | 1804 (3.2) | 5414 (2.9) | ||
| cN3 | 22 (1.1) | 1178 (2.1) | 2542 (1..3) | ||
| Pathologisch stadium | |||||
| 0 | 45 (2.2) | 4314 (7.7) | 5361 (2.8) | <0.001 | |
| 1 | 582 (27.9) | 24787 (44.3) | 81680 (43.2) | ||
| 2 | 1223 (58.7) | 20790 (37.1) | 72445 (38.3) | ||
| 3 | 210 (10.1) | 5675( 10.1) | 28323 (15) | ||
| 4 | 24 (1.2) | 432 (0.8) | 1464 (0.8) | ||
| Pathologische T-status | |||||
| pTis | 7 (0.3) | 432 (0.8) | 1862 (1) | <0.001 | |
| pT0 | 42 (2) | 4250 (7.6) | 3972 (2.1) | ||
| pT1 | 634 (30.4) | 29055 (51.9) | 106130 (56.1) | ||
| pT2 | 1017 (48.8) | 18530 (33.1) | 63484 (33.5) | ||
| pT3 | 290 (13.9) | 2540 (4.5) | 10588 (5.6) | ||
| pT4 | 93 (4.5) | 1097 (2) | 2892 (1.5) | ||
| pTX | 1 (0) | 94 (0.2) | 345 (0.2) | ||
| Pathologische N-status | |||||
| pN0 | 1705 (81.9) | 41587 (74.3) | 113787 (60.2) | <0.001 | |
| pN1 | 284 (13.6) | 9725 (17.4) | 51483 (27.2) | ||
| pN2 | 66 (3.2) | 3031 (5.4) | 16111 (8.5) | ||
| pN3 | 27 (1.3) | 1607 (2.9) | 7685 (4.1) | ||
| Receptorgroepering | |||||
| HR(+)/HER2(-) | 334 (16) | 0 (0) | 143687 (75.9) | <0.001 | |
| Drievoudig negatief | 1604 (77) | 55998 (100) | 0 (0) | ||
| HER2(+) | 97 (4..7) | 0 (0) | 38726 (20.5) | ||
| Onbekend | 49 (2.4) | 0 (0) | 6860 (3.6) | ||
| Tumor graad | |||||
| 1 | 41 (2) | 988 (1.8) | 32015 (16.9) | <0.001 | |
| 2 | 237 (11.4) | 9050 (16.2) | 80590 (42.6) | ||
| 3 | 1485 (71.3) | 42930 (76.7) | 65482 (34.6) | ||
| 4 | 37 (1.8) | 286 (0.5) | 438 (0.2) | ||
| Onbekend | 284 (13.6) | 3030 (5.4) | 11186 (5.9) | ||
| LVSI | |||||
| Niet aanwezig | 1505 (72.2) | 36400 (65) | 118082 (62.4) | <0.001 | |
| Aanwezig | 263 (12.6) | 11091 (19.8) | 45681 (24.1) | ||
| Onbekend | 316 (15.2) | 8507 (15.1) | 25510 (13.4) | ||
| Type operatie | |||||
| BCS | 876 (42) | 29142 (52) | 92022 (48.6) | <0.001 | |
| Mastectomie | 1200 (57,6) | 26561 (47,4) | 95910 (50.7) | ||
| Geen operatie | 8 (0.4) | 295 (0.5) | 1341 (0.7) | ||
| Axillaire chirurgie | |||||
| Geen operatie | 47 (2.3) | 1034 (1.8) | 4433 (2.3) | <.001 | |
| SLND | 1353 (64.9) | 34880 (62.3) | 109718 (58) | ||
| ALND | 666 (32) | 19229 (34.3) | 73181 (38.7) | ||
| Onbekend | 18 (0.9) | 855 (1.5) | 1941 (1) | ||
| Stralingstherapie | |||||
| Ja | 1087 (52.2) | 33938 (60.6) | 109268 (57.7) | <.001 | |
| Nee | 989 (47.5) | 21860 (39) | 79375 (41.9) | ||
| Onbekend | 8 (0.4) | 200 (0.4) | 630 (0.3) | ||
| Radiation targets | |||||
| Alleen borst/CW | 803 (73.9) | 24704 (72.8) | 72410 (66.3) | <0.001 | |
| Borst/CW + Regionale knopen | 284 (26,1) | 9234 (27,2) | 36858 (33.7) | ||
| Chemotherapie | |||||
| Ja | 1571 (75.4) | 44321 (79.1) | 133965 (70.8) | <0.001 | |
| Nee | 499 (23.9) | 11195 (20) | 53062 (28) | ||
| Onbekend | |||||
| 14 (0.7) | 482 (0.9) | 2246 (1.2) | |||
| Chemotherapy-to-surgery sequence | |||||
| Adjuvant | 1241 (59,5) | 31519 (56.3) | 116645 (61.6) | <0.001 | |
| Neoadjuvant | 324 (15.5) | 12581 (22,5) | 16717 (8,8) | ||
| Geen | 519 (24.9) | 11898 (21.2) | 55911 (29.5) | ||
| Hormoontherapie | |||||
| Ja | 220 (10.6) | 1178 (2.1) | 103906 (54.9) | <0.001 | |
| Nee | 1798 (86.3) | 53274 (95.1) | 76820 (40.6) | ||
| Onbekend | 66 (3.2) | 1546 (2.8) | 8547 (4.5) | ||
| Jaar van diagnose | |||||
| 2010 | 309 (14.8) | 9605 (17.2) | 36712 (19.4) | <0.001 | |
| 2011 | 393 (18.9) | 11163 (19.9) | 38815 (20.5) | ||
| 2012 | 458 (22) | 11205 (20) | 39364 (20.8) | ||
| 2013 | 463 (22.2) | 11992 (21.4) | 37764 (20) | ||
| 2014 | 461 (22.1) | 12033 (21.5) | 36618 (19,3) |
Afkortingen: BC, borstkanker; ALND, axillaire lymfeklierdissectie; BCS, borstsparende chirurgie; CW, borstwand; HER2, humane epidermale groeifactorreceptor; HR, hormoonreceptor; LVSI, lymfovasculaire invasie; SLND, sentinel lymfeklierdissectie.
Behandeling per type borstkanker
De meeste patiënten (99%) ondergingen oncologische borstchirurgie, inclusief chirurgische evaluatie van de axilla (97%). Mastectomie werd vaker toegepast in de metaplastische BC groep (58% vs. 47% TNBC vs. 51% andere BC, P<0,001), evenals SLND (65% vs. 62% TNBC vs. 58% andere BC; P<0,001). Regionale nodale bestraling werd vaker gebruikt als onderdeel van de behandeling voor ander BC dan voor metaplastisch BC en TNBC (respectievelijk 26%, 27% en 34%; P<0,001).
Met betrekking tot systemische therapie werd neoadjuvante chemotherapie bijna twee keer zo vaak gebruikt voor metaplastisch BC en TNBC dan voor ander BC (16%, 23%, 9%; P<0,001), en ongeveer een kwart van alle vrouwen kreeg geen chemotherapie. Hormoontherapie werd het minst vaak gebruikt voor TNBC (2%), maar maakte deel uit van het behandelparadigma voor 11% van de metaplastische BC en 55% van de andere BC-gevallen.
Survival Analysis
De mediane follow-up tijd was 44,5 maanden. Patiënten met metaplastisch BC hadden een significant slechtere ongecorrigeerde OS, ongeacht het klinische stadium (Fig. 2). De 5-jaars OS schattingen voor de metaplastische BC, TNBC, en andere BC patiënten met stadium I ziekte waren 85%, 87% en 91%; die voor stadium II waren 73%, 77%, en 87%; en die voor stadium III waren 43%, 53%, en 75% (P<0,001). De 3-jaars OS-percentages voor patiënten met uitgezaaide ziekte waren 2-4 keer hoger voor de TNBC- en andere BC-groepen met 30% en 64% vergeleken met 15% voor metaplastische BC (P<0,001). De overleving per moleculair subtype werd ook geanalyseerd (Fig. 3). Onder patiënten met metaplastisch BC waren geen verschillen in OS zichtbaar per moleculair subtype (HR(+)/HER2(-), HER2(+), of tn-metaplastisch BC) (P=0,778). In tegenstelling hiermee was voor niet-metaplastisch BC het triple-negatieve subtype geassocieerd met slechtere OS dan de HER+ en HR(+)/HER2(-) subtypes (P<0,001). Ras leek ook niet geassocieerd te zijn met overleving onder patiënten metaplastisch BC (5-jaars OS-percentages 73% voor blank vs. 74% voor zwart, P=0,876), terwijl ras geassocieerd was met OS in zowel de TNBC (P<0,001) als andere BC-groepen (P<0,001; Fig. 4).
Overlevingscurven van borstkankertypes per klinisch stadium, waarbij metaplastische, triple-negatieve en andere borstkankers zijn onderzocht. Afkortingen: MBC, metaplastische borstkanker.
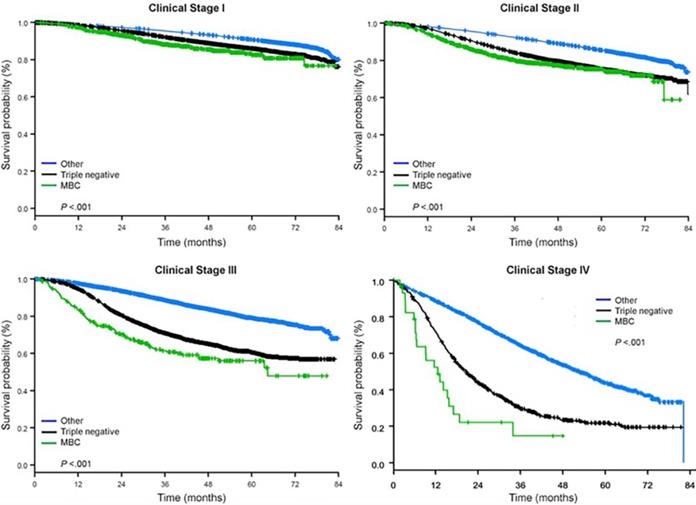 (Klik op de afbeelding om te vergroten.)
(Klik op de afbeelding om te vergroten.)
Overlevingscurven voor patiënten met metaplastische en niet-metaplastische borstkanker, gestratificeerd naar receptorstatus. Afkortingen: HER2, menselijke epidermale groeifactorreceptor 2; HR, hormoonreceptor; MBC, metaplastische borstkanker.
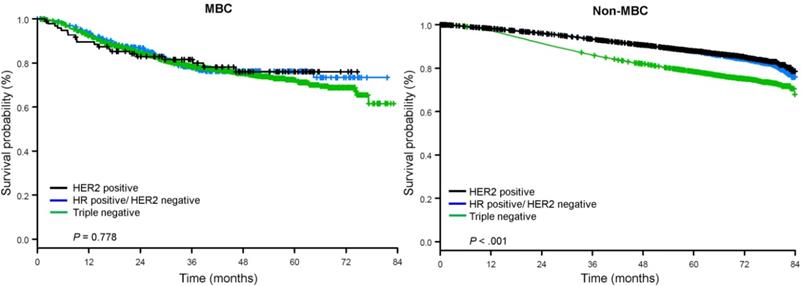 (Klik op de afbeelding om te vergroten.)
(Klik op de afbeelding om te vergroten.)
Overlevingscurven voor patiënten met metaplastische, triple-negatieve en andere borstkanker, gestratificeerd naar ras. Afkortingen: BC, borstkanker.
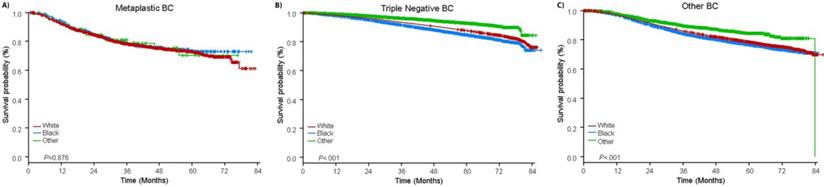 (Klik op de afbeelding om te vergroten.)
(Klik op de afbeelding om te vergroten.)
Multivariabele analyse van factoren die verband houden met de totale overleving voor patiënten met metaplastische BC.
| Factoren die geassocieerd zijn met de algehele overleving bij metaplastisch BC | |||
|---|---|---|---|
| Variabele (referentie) | Hazard Ratio (95% betrouwbaarheidsinterval) | P Value | |
| Leeftijd | Per jaar toename | 1.024 (1.015-1.033) | <0.0001 |
| Lymfovasculaire Invasie (Geen) | Aanwezig | 1.307 (1.017-1.679) | 0.0364 |
| Clinical N Status (cN0) | cN+ | 1.758 (1.328-2.326) | <0.0001 |
| Clinical T Status (cT1) | cT0 | 2.226 (0.301-16.447) | <0.0001 |
| cT2 | 1.454 (1.102-1.918) | ||
| cT3 | 3.029 (2.183-4.204) | ||
| cT4 | 3.029 (2.183-4.204) | cT4 | 3.145 (2.124-4.65).145 (2.124-4.657) |
| Clinical M Status (cM0) | cM1 | 3.330 (2.020-5.488) | |
| Clinical M Status (cM0) | 3.330 (2.020-5.488).020-5.488) | <0.0001 | |
| Axillaire Chirurgie (SLND) | ALND | 1.333 (1.065-1.670) | 0.0247 |
| Geen Chirurgie | 1.538 (0.884-2.675) | ||
| Radiation (No) | Yes | 0.709 (0.572-0.878) | 0.0016 |
| Chemotherapie (Nee) | Ja | 0.579 (0.446-0.752) | <0.0001 |
Afkortingen: ALND, Axillaire lymfeklierdissectie; BC, borstkanker; SLND, sentinel lymfeklierdissectie.
Op multivariate analyse correleerden toenemende leeftijd, hogere klinische T-classificatie, de aanwezigheid van klinische nodale ziekte of LVSI, en behandeling met ALND alle met slechtere uitkomsten voor patiënten metaplastische BC, TNBC, en andere BC (Supplementaire Tabel 1). De toevoeging van chemotherapie en bestralingstherapie verbeterden onafhankelijk van elkaar de OS, ongeacht het type borstkanker. Andere patiënt- en tumorkenmerken die geassocieerd waren met overleving bij TNBC en andere BC, waaronder ras, comorbiditeiten en tumorgraad, waren bij multivariate analyse niet geassocieerd met overlevingsuitkomsten voor metaplastisch BC.
Gezien de relatief slechte uitkomsten bij patiënten met metaplastisch BC, werden subgroepanalyses uitgevoerd op de metaplastische BC-groep om te beoordelen of bepaalde behandelingsmodaliteiten geassocieerd waren met betere uitkomsten. Na correctie voor nodale status (cN0 vs. N+), werd behandeling met agressievere axillaire chirurgie (ALND vs. SLND geassocieerd met slechtere resultaten, een fenomeen dat ook werd waargenomen bij TNBC en andere BC (Tabel 2). Onder degenen die bestralingstherapie kregen, had behandeling met regionale nodale bestraling vs. bestraling van alleen de borst- of borstwand geen significante invloed op de resultaten bij patiënten met metaplastische BC (P=0,077 en 0,200 voor klinische N0 en N+, respectievelijk). Ontvangst van neoadjuvante chemotherapie was geassocieerd met slechtere uitkomsten dan adjuvante chemotherapie onder patiënten met klinisch node-negatieve metaplastische BC (HR 1,9, 95% CI 1,3-2,6, P<0.001), maar niet voor die met klinisch node-positief metaplastisch BC (P=0,43).
Discussie
Metaplastische borstkanker is een zeldzame maar bijzonder agressieve vorm van borstkanker, vooral in vergelijking met andere subtypes van borsttumoren. Deze ziekte-entiteit is relatief ondervertegenwoordigd in de literatuur. Een uitgebreide zoekactie door Rayson et al. van publicaties van 1966 tot 1997 leverde een totaal van slechts 27 gevallen op. Grote nationale databanken zoals de NCDB zijn voordelig voor het bestuderen van zeldzame vormen van kanker zoals metaplastische BC. Echter, de incidentie van metaplastisch BC diagnose in de Verenigde Staten volgens deze databases is nog steeds laag met minder dan 500 gevallen per jaar. In onze studie vonden we dat metaplastisch BC het vaakst werd gediagnosticeerd als een grote tumor met ongunstige risicokenmerken zoals slecht gedifferentieerde tumorgraad en triple-negatieve receptor status. Patiënten met metaplastisch BC hadden een significant slechtere overleving, ongeacht het stadium bij presentatie, vergeleken met triple-negatieve en andere BC. Ontvangst van chemotherapie en bestraling waren onafhankelijke voorspellers van een betere OS, maar de opeenvolging van chemotherapie leek de resultaten te beïnvloeden, vooral voor patiënten met metaplastisch BC zonder klinische nodale betrokkenheid, waarbij erkend moet worden dat sommige van deze patiënten pathologisch nodale betrokkenheid hadden. Onze bevindingen kunnen echter een weerspiegeling zijn van potentiële heterogeniteit in de onderliggende biologische mechanismen die de respons op behandelingen in deze specifieke groep BC-patiënten aansturen en wijzen op de noodzaak van betere risicostratificatie en systemische therapieopties om de uitkomsten te verbeteren.
Hoewel de meeste metaplastische BCs een triple-negatief fenotype hebben, lijkt het gedrag van metaplastische BC uniek te zijn in vergelijking met andere TNBCs. TNBC heeft de neiging een slechtere prognose te hebben dan andere typen BC, en het idee dat metaplastisch BC agressiever is dan TNBC is bevestigd door meerdere kleinere, retrospectieve onderzoeken. Dergelijke studies hebben soortgelijke diagnosepatronen in gevorderde stadia aangetoond voor metaplastisch BC versus TNBC, als gevolg van hogere percentages van cT3-4 ziekte in plaats van nodale betrokkenheid, en in een onderzoek van één enkele instelling van 46 gevallen van metaplastisch BC hadden patiënten met metaplastisch BC een significant hoger risico van lokale ziekteherhaling (30% vs. 15%; P=0,004). Deze kenmerken correleerden uiteindelijk met inferieure 5-jaars ziektevrije overleving (30% vs. 90%; P<0,001) en OS (65% vs. 87%; P=0,002) voor patiënten met metaplastisch BC in vergelijking met TNBC. Een Surveillance Epidemiology and End Results studie van 1112 patiënten met metaplastisch BC toonde ook slechtere kankerspecifieke overlevingspercentages na 3 jaar voor metaplastisch BC dan voor TNBC (78% vs. 84%). Bij onderzoek van tn-metaplastisch BC vonden Li et al. slechtere ziektevrije overleving (HR 1,48, 95% CI 1,19-1,84, P<0,01) en OS (HR 1,42 ; P<,01) voor tn-metaplastisch BC vergeleken met TNBC. Onze studie, die een van de grootste groepen patiënten met metaplastisch BC tot op heden omvatte (n=2.084), versterkt deze bevindingen en benadrukt dat receptorstatus geen onafhankelijke voorspeller is van overleving voor metaplastisch BC (P=0.778) zoals het is voor niet-metaplastisch BC.
Een kritische therapeutische component geassocieerd met verbeterde uitkomsten voor alle metaplastische BC-patiënten in onze studie was het gebruik van chemotherapie (HR 0,58, 95% CI 0,45-0,75, P<0,001). Voor zover wij weten is dit het eerste verslag over uitkomsten bij metaplastisch BC op basis van de volgorde van chemotherapie. Opvallend is dat in onze subanalyse werd gevonden dat in het bijzonder voor patiënten met cN0 metaplastisch BC, neoadjuvante chemotherapie geassocieerd was met slechtere OS vergeleken met adjuvante chemotherapie (HR 1,88, 95% CI 1,34-2,64, P<0,001), terwijl sequentiebepaling van chemotherapie geen effect had op klinisch node-positief metaplastisch BC. Een mogelijke verklaring hiervoor kan zijn dat onze patiënten met metaplastisch BC een hogere klinische T-status hadden, die in andere rapporten in verband is gebracht met lagere percentages pathologische complete respons en vervolgens slechtere overlevingsresultaten. Bovendien kunnen klinische stageringsmethoden (d.w.z. alleen lichamelijk onderzoek, integratie van ultrasonografie) heterogeniteit introduceren in een klinische N0 populatie door het missen van werkelijke nodale ziektelast, wat op zichzelf geassocieerd kan worden met slechtere resultaten. In het algemeen is gemeld dat metaplastisch BC slechts voor 18% reageert op neoadjuvante chemotherapie, wat veel lager is dan de bekende responspercentages voor TNBC op chemotherapieregimes op basis van anthracycline en taxaan.
Gebaseerd op de slechtere overleving en de relatief snelle ontwikkeling van uitzaaiingen in de verte in vergelijking met andere subtypes van borstkanker, zoals vastgesteld in onze studie en in andere rapporten, is de behoefte aan betere systemische behandelingsopties duidelijk voor metaplastisch BC. Transcriptionele profilering heeft aangetoond dat dit kankersubtype een tumorigene signatuur vertoont met stamcelachtige kenmerken, frequente afwijkingen in de PI3K/AKT/mTOR pathway, en overexpressie van vasculaire endotheliale groeifactor (VEGF). Deze kenmerken zijn vergelijkbaar met die welke in mesenchymale TNBC’s worden aangetroffen. Er worden veelbelovende pogingen ondernomen om alternatieve systemische therapieregimes voor deze patiënten te identificeren, waaronder een recente fase I-studie die verbeterde objectieve responspercentages liet zien op liposomaal doxorubicine, bevacizumab (monoklonaal antilichaam tegen VEGF-A), en everolimus (mTOR-remmer) bij patiënten met metaplastische TNBC met een afwijking van het PI3K-pad.
Met betrekking tot lokale behandelingen werd mastectomie in onze studie vaker gebruikt voor metaplastische TNBC, maar dit werd niet geassocieerd met een betere overleving in vergelijking met borstsparende chirurgie. Er werd ook geen overlevingsvoordeel gevonden bij behandeling met ALND tegenover SLND. Bestralingstherapie daarentegen was een significante voorspeller van overleving, waarbij metaplastische BC patiënten behandeld met adjuvante bestralingstherapie 30% minder kans hadden om te overlijden dan degenen die geen bestraling kregen. Relevante beperkingen in onze bestralingstherapie-analyse zijn onder andere onbekende details met betrekking tot de planning van de behandeling, de geselecteerde modaliteit, kwaliteitsborging, en of technieken zoals diepe inspirerende breath-hold werden gebruikt. Hoewel lokaal-regionaal recidief niet kan worden onderzocht in de NCDB, toonde een institutionele serie van 113 patiënten met metaplastisch BC (waarvan 54% bestraling kreeg) aan dat bestraling de enige factor was die correleerde met verminderd locoregionaal recidief (relatief risico zonder bestraling 3.1; 95% CI 1,13-9,88, P=0,027).
Onze resultaten moeten met voorzichtigheid worden geïnterpreteerd, gezien de grote beperkingen van het niet weten welke chemotherapieregimes werden gebruikt, de duur van de behandelingen, of de respons op neoadjuvante chemotherapie, aangezien die informatie niet beschikbaar is in de NCDB. Wij erkennen ook de beperkingen van de clincopathologische risicofactoren die in de NCDB zijn opgenomen, zonder dewelke het misschien niet haalbaar is om de klinische verschillen volledig te karakteriseren die de oorzaak zijn van sommige van de uitkomstverschillen die wij hebben gevonden, zoals de slechtere overlevingsresultaten met ALND zelfs wanneer men controleert voor lymfeklierstatus. Hoewel onze steekproef van metaplastische BC patiënten klein was in vergelijking met niet-metaplastische BC studies, is het paradoxaal genoeg ook de grootste bestaande studie tot op heden die deze vraag onderzoekt gezien de beperkte aantallen van patiënten met metaplastisch BC die in institutionele reeksen gerapporteerd worden. Aanvullend onderzoek is nodig om de biologische predilectie voor metastatische verspreiding in metaplastisch BC te begrijpen en onze bevindingen te valideren in afzonderlijke datasets van metaplastische BC patiënten.
Onze huidige standaard van zorg is duidelijk niet adequaat voor deze unieke kankerpopulatie, en het verkrijgen van gerandomiseerde gegevens over metaplastisch BC in de toekomst zal samenwerkingsinspanningen vereisen vanwege de kleine aantallen patiënten. De NCDB biedt een opmerkelijke sterkte, namelijk de mogelijkheid om behandelingspatronen en resultaten geassocieerd met een zeldzame diagnose te bestuderen. Met 2.084 personen met metaplastisch BC in dit cohort, is dit een van de grootste metaplastische BC onderzoeken gerapporteerd in de moderne tijd. De overleving van deze patiënten is slecht in vergelijking met die van andere types BC, en hoewel dit feit waarschijnlijk een agressieve therapie noodzakelijk maakt, suggereert onze studie dat een meer uitgebreide lokale-regionale behandeling (b.v. ALND of bestraling van regionale knopen) zorgvuldig moet worden overwogen op een geval per geval basis. Over het geheel genomen is het gebruik van systemische therapie van cruciaal belang voor het beheer van metaplastisch BC, ongeacht de nodale belasting, en de ontwikkeling van effectieve doelgerichte therapieën op basis van analyse van tumorgenomische profilering is veelbelovend voor de toekomst.
Aanvullend materiaal
![]()
Aanvullende tabel.
Aankenningen
Speciale dank aan Christine Wogan voor redactionele hulp.
Funding
Gedeeltelijk ondersteund door Cancer Center Support (Biostatistics Core) Grant CA016672 van het National Cancer Institute, National Institutes of Health, aan The University of Texas MD Anderson Cancer Center.
Competing Interests
De auteurs hebben verklaard dat er geen concurrerende belangen bestaan.
1. Siegel RL, Miller KD, Jemal A. Cancer statistics, 2018. CA Cancer J Clin. 2018;68(1):7-30
2. Yerushalmi R, Hayes MM, Gelmon KA. Borstcarcinoom-zeldzame typen: review of the literature. Ann Oncol. 2009;20(11):1763-1770
3. Günhan-Bilgen I, Memiş A, Ustün EE, Zekioglu O, Ozdemir N. Metaplastisch carcinoom van de borst: klinische, mammografische, en sonografische bevindingen met histopathologische correlatie. AJR Am J Roentgenol. 2002;178(6):1421-1425
4. Jung S-Y, Kim HY, Nam B-H. et al. Slechtere prognose van metaplastische borstkankerpatiënten dan andere patiënten met triple-negatieve borstkanker. Breast Cancer Res Treat. 2010;120(3):627-637
5. Wargotz ES, Norris HJ. Metaplastische carcinomen van de borst: V. Metaplastisch carcinoom met osteoclastische reuscellen. Hum Pathol. 1990;21(11):1142-1150
6. Wargotz ES, Norris HJ. Metaplastische carcinomen van de borst. I. Matrix-producerend carcinoom. Hum Pathol. 1989;20(7):628-635
7. Wargotz ES, Deos PH, Norris HJ. Metaplastische carcinomen van de borst. II. Spindelcelcarcinoom. Hum Pathol. 1989;20(8):732-740
8. Lee H, Jung S-Y, Ro JY. et al. Metaplastische borstkanker: klinisch-pathologische kenmerken en de prognose. J Clin Pathol. 2012;65(5):441-446
9. He X, Ji J, Dong R. et al. Prognosis in different subtypes of metaplastic breast cancer: a population-based analysis. Breast Cancer Res Treat. Oktober. 2018
10. Nationale Kanker Database.
11. Chagpar AB, Scoggins CR, Martin RCG. et al. Factors Determining Adequacy of Axillary Node Dissection in Breast Cancer Patients. Breast J. 2007;13(3):233-237
12. Bembenek A, Schlag PM. Lymfeklierdissectie bij borstkanker. Langenbeck’s Arch Surg. 2000;385(4):236-245
13. Woolson RF. Statistical Methods for the Analysis of Biomedical Data. New York, USA: John Wiley & Sons. 1987
14. Kaplan EL, Meier P. Nonparametric Estimation from Incomplete Observations NONPARAMETRIC ESTIMATION FROM INCOMPLETE OBSERVATIONS*. Bron: J Am Stat Assoc. 1958;53(282):457-481
15. Mantel N. Evaluation of survival data and two new rank order statistics arising in its consideration. Cancer Chemother Rep. 1966;50(3):163-170
16. D.R. C. Regressiemodellen en levenstabellen. Cox Life Tables. 1972;2:187-220
17. Rayson D, Adjei AA, Suman VJ, Wold LE, Ingle JN. Metaplastische borstkanker: prognose en respons op systemische therapie. Ann Oncol Off J Eur Soc Med Oncol. 1999;10(4):413-419
18. Bilimoria KY, Stewart AK, Winchester DP, Ko CY. The National Cancer Data Base: a powerful initiative to improve cancer care in the United States. Ann Surg Oncol. 2008;15(3):683-690
19. Ong CT, Campbell BM, Thomas SM. et al. Metaplastic Breast Cancer Treatment and Outcomes in 2500 Patients: A Retrospective Analysis of a National Oncology Database. Ann Surg Oncol. 2018;25(8):2249-2260
20. Dietze EC, Sistrunk C, Miranda-Carboni G, O’Regan R, Seewaldt VL. Triple-negatieve borstkanker bij Afro-Amerikaanse vrouwen: ongelijkheden versus biologie. Nat Rev Cancer. 2015;15(4):248-254
21. Rakha EA, El-Sayed ME, Green AR, Lee AHS, Robertson JF, Ellis IO. Prognostische markers in triple-negatieve borstkanker. Cancer. 2007;109(1):25-32
22. ROJAS K, STUCKEY A. Breast Cancer Epidemiology and Risk Factors. Clin Obstet Gynecol. 2016;59(4):651-672
23. Liao H-Y, Zhang W-W, Sun J-Y, Li F-Y, He Z-Y, Wu S-G. The Clinicopathological Features and Survival Outcomes of Different Histological Subtypes in Triple-negative Breast Cancer. J Cancer. 2018;9(2):296-303
24. El Zein D, Hughes M, Kumar S. et al. Metaplastisch Carcinoom van de Borst Is Agressiever Dan Triple-negatieve Borstkanker: A Study From a Single Institution and Review of Literature. Klinische Borstkanker. 2017;17(5):382-391
25. Liedtke C, Mazouni C, Hess KR. et al. Response to neoadjuvant therapy and long-term survival in patients with triple-negative breast cancer. J Clin Oncol. 2008;26(8):1275-1281
26. Cortazar P, Zhang L, Untch M. et al. Pathological complete response and long-term clinical benefit in breast cancer: the CTNeoBC pooled analysis. Lancet. 2014;384(9938):164-172
27. Fisher B, Brown A, Mamounas E. et al. Effect van preoperatieve chemotherapie op lokaal-regionale ziekte bij vrouwen met operabele borstkanker: bevindingen van National Surgical Adjuvant Breast and Bowel Project B-18. J Clin Oncol. 1997;15(7):2483-2493
28. Chen IC, Lin CH, Huang CS. et al. Gebrek aan werkzaamheid aan systemische chemotherapie voor de behandeling van metaplastisch carcinoom van de borst in het moderne tijdperk. Breast Cancer Res Treat. 2011;130(1):345-351
29. Hennessy BT, Gonzalez-Angulo A-M, Stemke-Hale K. et al. Characterization of a naturally occurring breast cancer subset enriched in epithelial-to-mesenchymal transition and stem cell characteristics. Cancer Res. 2009;69(10):4116-4124
30. Prat A, Parker JS, Karginova O. et al. Phenotypic and molecular characterization of the claudin-low intrinsic subtype of breast cancer. Breast Cancer Res. 2010;12(5):R68
31. Yu K-D, Zhu R, Zhan M. et al. Identification of prognosis-relevant subgroups in patients with chemoresistant triple-negative breast cancer. Clin Cancer Res. 2013;19(10):2723-2733
32. Basho RK, Yam C, Gilcrease M. et al. Comparative Effectiveness of an mTOR-Based Systemic Therapy Regimen in Advanced, Metaplastic and Nonmetaplastic Triple-Negative Breast Cancer. Oncologist. 2018;23(11):1300-1309
33. Basho RK, Gilcrease M, Murthy RK. et al. Targeting the PI3K/AKT/mTOR Pathway for the Treatment of Mesenchymal Triple-Negative Breast Cancer. JAMA Oncol. 2017;3(4):509
34. Bergom C, Currey A, Desai N, Tai A, Strauss JB. Deep Inspiration Breath Hold: Techniques and Advantages for Cardiac Sparing During Breast Cancer Irradiation. Front Oncol. 2018;8:87
35. Latty D, Stuart KE, Wang W, Ahern V. Review of deep inspiration breath-hold techniques for the treatment of breast cancer. J Med Radiat Sci. 2015;62(1):74-81
36. Leyrer CM, Berriochoa CA, Agrawal S. et al. Voorspellende factoren op uitkomsten bij metaplastische borstkanker. Breast Cancer Res Treat. 2017;165(3):499-504
37. Takala S, Heikkilä P, Nevanlinna H, Blomqvist C, Mattson J. Metaplastisch carcinoom van de borst: Prognose en respons op systemische behandeling bij metastatische ziekte. Breast J. 2019;25(3):418-424
38. Harper NW, Hodges KB, Stewart RL. et al. Adjuvant Treatment of Triple-Negative Metaplastic Breast Cancer With Weekly Paclitaxel and Platinum Chemotherapy: Retrospectieve casusbespreking van één instelling. Clin Breast Cancer. May. 2019