We zijn allemaal mutanten. Elk kenmerk dat onze soort kenmerkt, is het resultaat van een genetische mutatie ergens in de evolutiegeschiedenis. En hetzelfde geldt voor elk ander organisme op de planeet. Toch denken we vaak dat mutaties slecht zijn en leiden tot invaliditeit of ziekte. Dus hoe vaak zijn deze veranderingen in het DNA schadelijk en hoeveel van hen zijn potentieel nuttig? Een nieuwe studie suggereert dat dodelijke mutaties veel minder vaak voorkomen dan we ooit dachten, althans bij bacteriën.
De meeste DNA-mutaties worden veroorzaakt door fouten die gebeuren wanneer een cel een kopie maakt van al zijn genetische informatie, zodat het zich kan delen in twee nieuwe cellen. Bacteriën zoals E. coli moeten ongeveer vijf miljoen letters van de DNA-code kopiëren. Bij mensen zijn dat ongeveer 3,2 miljard DNA-letters in eicellen en sperma, en het dubbele aantal in andere lichaamscellen.
Ondanks geavanceerde systemen om kopieerfouten op te sporen en te herstellen wanneer ze zich voordoen, glippen er af en toe toch een paar door de mazen van het net. De meeste resulteren in wat men noemt “puntmutaties”, omdat het slechts om één verandering van DNA-letters gaat. Maar zelfs deze kunnen soms tot grote veranderingen leiden, waardoor genen en de eiwitten die zij produceren, veranderen. Dit kan op zijn beurt invloed hebben op de manier waarop het lichaam groeit of werkt.
Mutaties kunnen de evolutie aanjagen, als ze een individu een voordeel geven, wat betekent dat hij meer kans heeft te overleven om kinderen te krijgen en het gemuteerde gen door te geven. De kans dat willekeurige mutaties in miljoenen of miljarden letters van de code voordelig zijn, lijkt misschien klein. Maar het leven op aarde bestaat al vier miljard jaar, dus evolutionaire tijdschalen zijn enorm.
Mutaties kunnen echter ook ernstige gezondheidsproblemen veroorzaken, waarvan sommige ook kunnen worden overgeërfd. Onderzoekers in Frankrijk probeerden onlangs uit te vinden hoe vaak mutaties daadwerkelijk schadelijk zijn, met E. coli-bacteriën als model. Lydia Roberts en haar collega’s gebruikten een ingenieuze techniek die hen in staat stelde DNA-veranderingen te visualiseren die plaatsvonden terwijl de bacteriën zich daadwerkelijk aan het delen waren.
De gebruikelijke manier om het mutatiepercentage in bacteriën te schatten, bestaat erin ze te laten groeien op agarplaten, plastic schaaltjes die een voedingsrijke gelei voor microben bevatten. Maar het probleem met deze aanpak is dat bacteriën die een dodelijke mutatie oplopen, uiteraard sterven, zodat informatie over deze genetische veranderingen permanent verloren gaat.
Om dit te omzeilen, gebruikten de Franse onderzoekers een piepkleine chip met 1.000 microscopisch kleine kanaaltjes, waarin vloeibare voedingsbouillon wordt gebracht. Nieuwe cellen die na elke celdeling worden geproduceerd, blijven in de kanaaltjes, ongeacht eventuele schadelijke mutaties die hun overleving zouden kunnen beïnvloeden.
Het team maakte vervolgens gebruik van time-lapse beeldvorming, gecombineerd met een fluorescerende marker die knipperde telkens wanneer een mutatie optrad. Dit leverde indrukwekkende video’s op van de zich vermenigvuldigende, muterende bacteriën die deden denken aan de coderegels in de sciencefictionfilm The Matrix.
De resultaten, gepubliceerd in Science, suggereren dat puntmutaties in bacteriën ontstaan met een constant tempo van ongeveer één per 600 uur. Tot verrassing van de onderzoekers ontdekten zij ook dat slechts ongeveer 1% van deze DNA-veranderingen dodelijk waren voor de bacteriën – veel minder dan eerder werd gedacht.
Het lijkt erop dat, althans bij bacteriën, de meeste mutaties misschien helemaal geen effect hebben op het overleven. Ze zijn niet “slecht” of “goed”, maar gewoon evolutionaire toeschouwers. Onderzoekers die proberen te begrijpen hoe genetische mutaties ziekten bij de mens veroorzaken, stellen zich soortgelijke vragen. De resultaten van grote projecten zoals het 100.000 genoom-project in het VK moeten helpen onthullen welke mutaties ziekte veroorzaken en welke niet.
Over goed en slecht heen
Maar we weten ook dat het categoriseren van mutaties als goed of slecht soms erg moeilijk kan zijn. Vaak hangt het van de context af, bijvoorbeeld of de mutatie het organisme helpt een bepaalde voedselbron te gebruiken of een ziekte te bestrijden die tijdens zijn leven aanwezig is. En sommige mutaties kunnen gunstig zijn als slechts één exemplaar wordt geërfd, maar schadelijk als twee exemplaren worden geërfd. Een voorbeeld van een genmutatie die onderhevig is aan dit soort “balancerende selectie” is sikkelcelziekte.
Mensen met sikkelcelziekte hebben een genmutatie die een veranderde vorm van hemoglobine produceert, het eiwit in rode bloedcellen dat zuurstof rond het lichaam transporteert. De veranderde hemoglobine produceert lange sikkelvormige bloedcellen die vast kunnen komen te zitten in kleine bloedvaten. Dit veroorzaakt pijn in de borst en gewrichten, evenals bloedarmoede, een verhoogd risico op infecties en andere problemen.
Ondanks deze potentieel verwoestende gevolgen voor de gezondheid, komt de ziekte in bepaalde landen relatief vaak voor. Naar schatting 300.000 baby’s die twee exemplaren van de sikkelcelgenmutatie erven (één van elke ouder) worden elk jaar met de ziekte geboren, voornamelijk in Nigeria, de Democratische Republiek Congo en India.
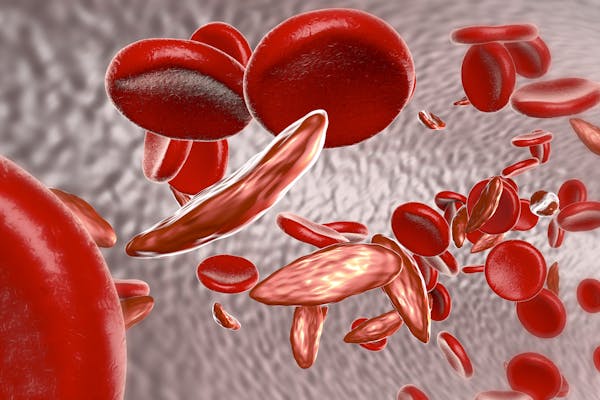
Dit komt omdat mensen met één kopie van de mutatie resistent zijn tegen malaria, en dus meer kans hebben om de volwassenheid te overleven en het gemuteerde gen door te geven aan hun kinderen. Dus hoewel het hebben van sikkelziekte een evolutionair nadeel is, hebben niet-betrokken dragers van de genmutatie een overlevingsvoordeel in landen waar malaria wijdverbreid was (of nog steeds is).
Een recent Amerikaans onderzoek suggereert dat alle mensen die vandaag de dag met de aandoening leven, afstammen van één enkele voorouder die ongeveer 7.300 jaar geleden leefde in de Sahara of in West- Centraal Afrika. Dit toont aan hoe een enkele mutatie zich kan verspreiden onder vele, vele individuen in een populatie als zij een aanzienlijk voordeel oplevert, zelfs als zij ook het potentieel heeft om schade aan te richten. Zo zijn er ook aanwijzingen dat een enkele kopie van de cystische fibrose-genmutatie onze voorouders resistentie tegen cholera kan hebben gegeven, en dat dragers van de Tay-Sachs ziekte resistentie tegen tuberculose hebben.
Een beter begrip van de effecten van mutaties zou een grote rol kunnen spelen bij de behandeling van ziekten. Bestudering van de mutatiesnelheid in verschillende celtypen zou bijvoorbeeld licht kunnen werpen op het ontstaan van kanker in verschillende lichaamsweefsels. En inzicht in de mutatiesnelheid van bacteriën kan wetenschappers helpen bij de bestrijding van microben die resistentie tegen antibiotica hebben ontwikkeld. Uiteindelijk zal dit helpen een nieuw tijdperk van geneeskunde in te luiden, waarin vele ziekten zullen worden gediagnosticeerd en behandeld met behulp van genetische informatie. En dat moet goed zijn.