Een Microbiële Biorealm-pagina over het geslacht Rhodospirillum rubrum
Classificatie
Hogere orde taxa
Kingdom: Bacteriën
Phylum: Proteobacteriën
Klasse: Alphaproteobacteria
Orde: Rhodospirillales
Familie: Rhodospirillaceae
Genus: Rhodospirillum
Soorten
Rhodospirillum rubrum
Beschrijving en betekenis
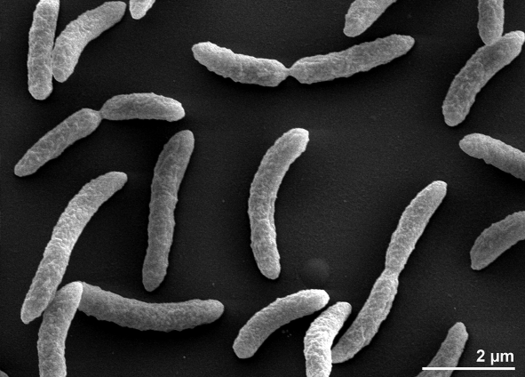
Rhodospirillum rubrum is een Gram-negatieve, mesofiele proteobacterie. Zijn optimale groeitemperatuur is 25-30 graden Celsius. Hij heeft meerlagige buitenste omhulsels, die voornamelijk onverzadigde, maar enkele verzadigde vetten in zijn celwand bevatten. R. rubrum is een spirilla, wat betekent dat hij spiraalvormig is. Hij is polair geflagelleerd, en dus beweeglijk. De lengte is 3-10 um, met een breedte van 0,8-1,0 um.
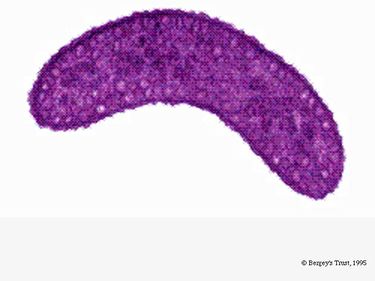
R. rubrum is een facultatieve anaerobe. Afhankelijk van de aanwezigheid van zuurstof kan hij alcoholische gisting of aërobe ademhaling ondergaan. Hij is ook in staat tot fotosynthese en bevat carotenoïde en bateriochlorofyl in zijn chromatofore deeltjes. Deze moleculen helpen bij de absorptie van licht en de omzetting ervan in energie, en geven de plant onder anaërobe omstandigheden zijn uitgesproken paarsrode kleur. R. rubrum is kleurloos onder aërobe omstandigheden.
Hoewel fotosynthese actief is onder aërobe omstandigheden, wordt deze over het algemeen onderdrukt in de aanwezigheid van O2. Zwavel is een belangrijk bijproduct van fotosynthese, niet O2. R. rubrum kan heterotroof of autotroof groeien wanneer hij fotosynthetisch is. In tegenstelling tot veel planten bevat R. rubrum geen chlorofyl a (absorptiespectrum 430-662 nm). Hij bevat echter wel chlorofyl b (absorptiespectra 660-680 nm) en bacteriochlorofyllen (800-925 nm). Daardoor kan hij meer energie uit de elektromagnetische spectra benutten. R. rubrum oxideert ook koolmonoxide (CO) met waterstofgas als eindproduct, en kan bij lage concentraties sulfide gebruiken als elektronendonor bij de reductie van kooldioxide. Bovendien is het een stikstoffixerende bacterie; hij gebruikt nitrogenase om atmosferisch stikstofgas om te zetten in ammoniak (Munk et al, 2011).
Er zijn verschillende toepassingen van R. rubrum op het gebied van biotechnologie. Het is een modelsysteem voor de omzetting van licht in chemische energie en voor zijn stikstoffixatiewegen. Er worden ook studies naar stralingsbestendigheid aan gewijd. Hij kan ook op verschillende manieren voor consumptie worden gebruikt. De proteobacteriën kunnen een bron zijn van diervoeding en meststoffen voor de landbouw. Een andere belangrijke rol in het onderzoek is de productie van vitaminen. Ook wordt onderzoek gedaan naar de productie van biologisch plastic uit precursoren van poly-hydroxy-butyroenzuur. R. rubrum kan ook een bijdrage leveren aan biologische waterstofbrandstoffen, vooral door de evolutie van het enzym nitrogenase.
Genoomstructuur
De sequencing van het genoom is voltooid. Het bestaat uit een cirkelvormig chromosoom met 4.352.825 basenparen, waarvan 65% bestaat uit guanine-cystosineparen. Er is ook een plasmide met 53.732 basenparen met 60% guanine-cytosine. In totaal zijn er 3.850 eiwitcoderende genen en 83 RNA-genen. Van deze genen is 6,9% transcriptie-gerelateerd; 4,6% translatie, ribosoomstructuur en biosynthese; 4,0% replicatie, recombinatie en reparatie; 7,9% signaaltransductiemechanismen; 5,9% celwand- en membraanbiogenese; 6,6% energieproductie en -omzetting; 5,0% koolhydraattransport en -metabolisme; 9,0% aminozuurtransport en -metabolisme; 9,0% celwand- en membraanbiogenese.9% aminozuurtransport en -metabolisme; 4,7% co-enzymtransport en -metabolisme; 3,7% lipidentransport en -metabolisme; en 6,5% anorganisch ionentransport en -metabolisme(Munk et al, 2011).
Ecologie
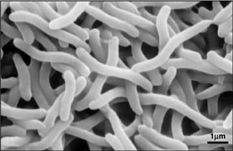
Dankzij het feit dat Rhodospirillum rubrum zowel aëroob als anaëroob kan groeien, is het in staat om in een grote verscheidenheid van omstandigheden te leven. R. rubrum wordt aangetroffen in vele natuurlijke aquatische milieus zoals vijvers, meren, beken en stilstaand water (Reslewic et. al, 2005). R. rubrum wordt ook vaak aangetroffen in modder en rioolwater (Brock et al, 2000). Studies hebben aangetoond dat R. rubrum grote veranderingen in zijn chemische samenstelling kan aanbrengen om zich aan verschillende milieus aan te passen (Cohen-Bazire en Kunisawa, 1963). R. rubrum groeit bij voorkeur in habitats met een pH van 6,8-7,2 (Bergey en Holt, 1994). Studies hebben ook aangetoond dat R. rubrum een optimale groeitemperatuur heeft van 22-35 graden Celcius (Weaver, 1971).
Celstructuur en metabolisme
R. rubrum is een veelzijdig organisme dat energie kan verkrijgen via een verscheidenheid aan mechanismen. Respiratie- en fotosynthesemechanismen bestaan samen en hun activiteit is afhankelijk van de aanwezigheid van licht en energie. R. rubrum kan groeien in een donkere chemo-tropische omgeving met de aanwezigheid van zuurstof of kan groeien in een fototropische omgeving zonder zuurstof.
Fotosynthese in R. rubrum begint met de donatie van een waterstof van een organisch substraat aan een oxiderend substraat. Bacteriochlorofyl en cartenoïden, de fotoreactieve pigmenten in het celmembraan, zijn gebonden aan chromatoforen (Schachman, Pardee en Stanier, 1952). Chromatoforen zijn afgeplatte schijven die choline fosfolipiden, cardio-lipine en galactosyl diglyceriden bevatten (Benson, Wintermans, en Wiser, 1959; Benson 1961). Bovendien bevatten chromatoforen een volledige elektronentransportketen die verschillende cytochromen, flavin en pyridinenucleotiden omvat (Newton en Newton, 1957; Hulcher en Conti, 1960; Kamen, 1961). Het celmembraan bevat ook machinerie voor ATP-synthese, waaronder een ATP-synthetase.
In aanwezigheid van zuurstof is R. rubrum in staat tot aërobe ademhaling met behulp van een traditionele elektronentransportketen met NAD+/NADH als de primaire elektronendrager (Keister en Minton, 1969). Een van de elektronentransporteiwitten is cytochroom C428 (Chance en Smith, 1955). Aërobe ademhaling wordt echter geremd door fotosynthese (Oelze en Weaver, 1971).
R. rubrum is ook in staat tot anaërobe ademhaling. Zijn niet-zuurstofhoudende eindelektronenacceptoren kunnen dimethylsulfoxide en trimethylamineoxide omvatten. De aanwezigheid van deze elektronenacceptoren maakt het mogelijk dat substraten als succinaat, malaat en acetaat de groei van R. rubrum ondersteunen. Deze acceptoren zijn echter slechts ongeveer 33-41% zo efficiënt als zuurstof in termen van energiebehoud (Schultz en Weaver, 1982).
Daarnaast heeft R. rubrum het unieke vermogen om koolmonoxide te oxideren met behulp van koolmonoxide dehydrogenase. Deze oxidatieroute eindigt met de reductie en waterstof en de productie van waterstofgas.
Zonder een eindelektronenacceptor voltooit R. rubrum de gemengde zuurfermentatie. De belangrijkste producten van pyruvaatfermentatie zijn acetaat, formiaat, kooldioxide en waterstof. In aanwezigheid van bicarbonaationen kan fructose worden gefermenteerd. De eindproducten van deze route zijn dezelfde als die voor pyruvaat, maar met toevoeging van succinaat en propionaat (Schultz en Weaver 1982).
Naast het vermogen om kooldioxide vast te leggen (Schon en Biedermann, 1972), is een kenmerkende anabole eigenschap van R. rubrum zijn vermogen om stikstof vast te leggen. Onder donkere omstandigheden, met de aanwezigheid van fructose, gebruikt R. rubrum nitrogenase om stikstofgas te binden tot ammonium. Hij bevat zowel Fe-Mo als Fe-only nitrogenases.
Pathologie
R. rubrum is niet gevonden om mensen of dieren te infecteren.
Huidig onderzoek
Radiation resistance
Rhodospirillum rubrum heeft onlangs inzicht verschaft in stralingsresistentie. Felice Mastroleo et al, in Insight into the radiotolerance of the life support bacterium Rhodospirillum rubrum S1H by means of phenotypic and transcriptomic methods (2010), hebben de stralingstolerantie van R. rubrum gekarakteriseerd.
Door de bacterie bloot te stellen aan subletale doses Cobalt-60 gammastralen, een type ioniserende straling, werden R. rubrum markergenen die specifiek zijn voor ioniserende straling gekarakteriseerd in het organisme. De expressie van deze genen nam toe naarmate de “hersteltijd” verstreek na een bepaalde behandeling met gammastraling. De analyse van genexpressie door R. rubrum na gammastraling creëert het potentieel voor verder microbiologisch onderzoek dat kan leiden tot vooruitgang in toegepaste stralingsresistentie in de toekomst.
Biologisch afbreekbare kunststoffen
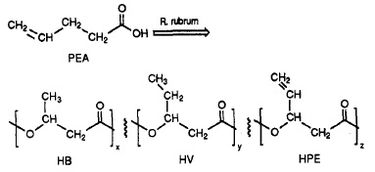
R. rubrum blijkt een klasse van biologisch afbreekbare kunststoffen te produceren, poly-bèta-hydroxyalkanoaten (PHA’s). De toepassingen van dit onderzoek kunnen een oplossing bieden voor veel problemen die worden veroorzaakt door synthetische, niet-afbreekbare kunststoffen die een negatieve invloed hebben gehad op het milieu. Een onderzoeksexperiment uitgevoerd door Herbert. W. Ulmer et al. beschrijft de productie van PHA’s met 3HV-eenheden door Rhodospriillum rubrum (1993). Ulmer gebruikte 4-pentenoëzuur (PEA) als groeimedium voor R. rubrum. Wanneer de bacterie onder “PHA-producerende omstandigheden” werd geplaatst, werden PHA’s gesynthetiseerd die 3 repeterende subeenheden bevatten (noot: R = substituentgroep): HB (R = methyl), HV (R = ethyl), HPE (R = vinyl) (zie figuur 1).
De synthese van functionele, biologisch afbreekbare kunststoffen door bacteriën heeft het potentieel om de wereldwijde vervuiling en het brandstofverbruik van plasticfabrieken te verminderen. R. rubrum kan worden gebruikt als microbiologisch hulpmiddel om milieuvriendelijke biopolymeren te produceren.
Hernieuwbare energie
De toenemende bezorgdheid over milieuvervuiling door het verbranden van fossiele brandstoffen heeft geleid tot een toename van het onderzoek naar Rhodospirillum rubrum. Het gebruik van R. rubrum als bron voor waterstof voor gebruik in hernieuwbare waterstofbrandstoffen pakt verschillende problemen aan die ontstaan door het verbruik van fossiele brandstoffen. Waterstof oxideert tot water als verbrandingsproduct, in tegenstelling tot fossiele brandstoffen die vervuilende stoffen creëren zoals CO, CO2, SOx en NOx. R. rubrum kan waterstof produceren door gebruik te maken van de volgende “water-gasverschuivingsreactie” (Najafpour et al, 2004):
CO + H2O → H2 + CO2
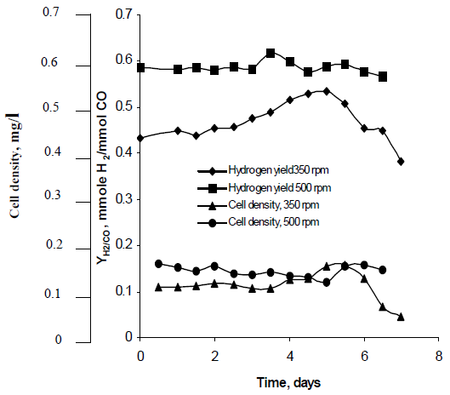
Najafpour’s onderzoeksmethode observeerde hoe agitatie, gecreëerd door sets van turbinewaaiers ingesteld op snelheden van 350 rpm evenals 500 rpm, de waterstofproductiesnelheden van R. rubrum beïnvloedde. Uit zijn onderzoek bleek dat waterstofbrandstof het potentieel heeft om de opwarming van de aarde tegen te gaan en een milieuvriendelijke technologische oplossing te bieden voor de productie en het verbruik van brandstof. Uit zijn onderzoek bleek dat “een hogere agitatiesnelheid een hogere waterstof- en celdichtheid” van R. rubrum opleverde (zie figuur 2).
In een ander microbiologisch onderzoek, uitgevoerd door Matthew Ross Melnicki, werd vastgesteld dat R. rubrum het potentieel biedt voor hernieuwbare energie, zoals waterstofbrandstof, via waterstofsynthese. Zijn biologische routes kunnen waterstof produceren aan hoge snelheden wanneer ze gecultiveerd worden met Chlamydomonas reinhardtii, een algensoort waar R. rubrum harmonieus mee kan groeien. Melnicki stelde een onconventionele co-cultivatie aanpak voor om waterstof te synthetiseren die verhoogde niveaus van waterstofsynthese produceerde die niet bereikt kunnen worden als de co-cultivatie ontkoppeld wordt. C. reinhardtii was bevoordeeld bij hogere lichtintensiteiten, terwijl R. rubrum productiever was bij lagere lichtintensiteiten, wat de voordelen van hun co-cultivatie benadrukt.
Door gebruik te maken van een fed-batch techniek voor het cultiveren van R. rubrum, werd ontdekt dat geïnoculeerde culturen waterstof produceerden tijdens de exponentiële groeifase, en de waterstofsynthese bleef gedurende 70 uur continu floreren. Toen de groei stopte, voegde Melnicki succinaat toe, dat als elektronendonor in de metabolische route fungeert, en de waterstofevolutie werd hervat, hoewel de bacterie nu niet meer groeide. Het is echter belangrijk op te merken dat bij voortdurende toevoeging van succinaat een verminderde waterstofevolutie werd vastgesteld. Zodra extra groeimedium werd toegevoegd, nam de waterstofproductie weer toe.
Melnicki verklaarde ook: “hoewel groei niet vereist is voor waterstofproductie, stelt dit werk de noodzaak van celgroei vast om maximale percentages te behouden, wat de industriële geschiktheid van een semi-continue kweekstrategie suggereert” (Melnicki, 2009).
Cool Factor
De genoomsequentie van Rhodospirillum rubrum is pas de tweede van het Rhodospirillum-geslacht die is gepubliceerd, na R. centenum (Munk et al, 2011).

Een interessant aspect van Rhodospirillum rubrum is zijn vermogen om onder verschillende omstandigheden van kleur te veranderen. Het is een zuurstofloze fototrofe soort, maar produceert geen extracellulaire zuurstof. In plaats daarvan produceert hij elementaire zwavel tijdens het oogsten van licht. Dit is te wijten aan het feit dat R. rubrum lichtoogstcomplex 2 mist (Munk et al, 2011). De bacterie gebruikt bacteriochlorofyl, waardoor hij golflengten van licht kan absorberen die planten niet gebruiken. Bacteriochlorofyl absorbeert golflengten van 800-925 nm.
Onder aërobe omstandigheden wordt de fotosyntheseactiviteit van R. rubrum genetisch onderdrukt, en wordt de bacterie kleurloos. Onder anaërobe omstandigheden wordt de fotosynthese echter geactiveerd en krijgt de bacterie een duidelijke paarsrode kleur (zie afbeelding 5). Dit komt door de activiteit in de chromatoforen, die zich in het membraan bevinden (Munk et al, 2011). Chromatoforen bevatten de bacteriochlorofylpigmenten van de bacterie, en ondergaan absorptieveranderingen tijdens de activering van de fotosynthese.
Benson, A. “Chloroplast lipid metabolism.” In Symposium no. VI. 5th international Congress on Biochemistry. 1961. Oxford: Pergamon Press. (In the Press.)
Benson, A., Wintermans, J. and Wiser, R. “Chloroplast lipids as carbohydrate reservoirs.” Plant Physiology. 1959. Volume 34. p. 815.
Bergey, D. and Holt, J. Bergey’s manual of determinative bacteriology. Negende editie. Baltimore. Lippincott Williams and Wilkins. 1994. p. 359.
Brock, T.D., M.T. Madigan, J.M. Martinko, and J Parker. Biologie van micro-organismen. 9e Editie. Upper Saddle River: Prentice Hall, 2000. p. 459.
Chance, B. and Smith, L. “Ademhalingspigmenten van Rhodospirillum rubrum.” Nature. Volume 174. p. 803-806.
Cohen-Bazire, G. and Kunisawa, R. “The Fine Structure of Rhodospirillum Rubrum.” Tijdschrift voor Celbiologie. 1963. Volume 16. p. 401-419.
Hulcher, M. and Conti, S. “Cytochronies in chlorophyll-containing particles of Chromatium and Chlorobium thiosuphatophilum.” Biochemistry and Biophysics Research Communications. 1960. Volume 3. p. 497.
Kamen, M. “The Haem Proteins of Photosynthetic Tissues.” In Symposium no. VI. 5th international Congress on Biochemie. 1961. Oxford: Pergamon Press. (In the Press.)
Keister, D. and Minton, N. “Energy-linked reactions in photosynthetic bacteria. 3. Further studies on energy-linked nicotinamide-adenine dinucleotide reduction by Rhodospirillum rubrum chromatophores.” Biochemistry. 1969. Volume 8. p. 167-173.
Mastroleo, F., Monsieurs, P., and Leys, N. “Inzicht in de radiotolerantie van de life support bacterie Rhodospirillum rubrum S1H door middel van fenotypische en transcriptomische methoden”. Wetenschappelijke vergadering COSPAR. 2010. p. 4.
Melnicki, M. R. “Modes van waterstofproductie in de fotosynthetische bacterie, Rhodosphirillum rubrum”. Universiteit van Californië, Berkeley. 2009.
Munk, C., Copeland, A., Lucas, C., Lapidus, A., et al. “Complete genome sequence of Rhodospirillum rubrum type strain (S1T)”. Standaarden in Genomische Wetenschappen. 2011. Volume 4. pp. 293-302.
Najafpour, G., Ismail, K., Younesi, H., Mohamed, A. R., and Kamaruddin, A. H. “Hydrogen as clean fuel via continuous fermentation by anaerobic photosynthetic bacteria, Rhodospirillum rubrum”. African Journal of Biotechnology. 2004. Volume 3. pp. 503-507.
Newton, J. and Newton, G. “Composition of the photoactive subcellular particles from Chromatium.” The Archives of Biochemistry and Biophysics. 1957. Volume 71. p. 250.
Oelze, J. and Weaver, P. “The adjustment of photosynthetically grown cells of Rhodospirillum rubrum to aerobic light conditions.” The Archives of Microbiology. 1982. Volume 79. p. 108-121.
Reslewic, S., Shigou, Z., Place, M., Zhang, Y., Briska A., Goldstein, S., Churas, C., Runnheim, R., Forrest, D., Lim, A., Lapidus, A., Han, C., Roberts, G., and Schwartz, D. “Whole-Genome Shotgun Optical Mapping of Rhodospirillum rubrum .” Toegepaste en Milieumicrobiologie. 2005. Volume 71. p. 5511-5522.
Schachman, H., Pardee, A., and Stanier, R. “Studies on the macromolecular organization of microbial cells.” The Archives of Biochemistry and Biophysics. 1952. Volume 38. p. 245-260.
Schön, G. and Biedermann, M. “Synthesis of volatile acids by fermentation of pyruvate and fructose in anaerobic dark cultures of Rhodospirillum rubrum.” Archiv fur Mikrobiologie.1972. Volume 85. p. 77-90.
Schultz, J. and Weaver, P. “Fermentation and anaerobic respiration by Rhodospirillum rubrum and Rhodopseudomonas capsulate.” The Journal of Bacteriology. 1982. Volume 149. p. 181-190.
Ulmer, H., Gross, R., Posada, M., Weisbach, P., Fuller, R. C., and Lenz, R. “Bacterial production of poly(.beta.-hydroxyalkanoates) containing unsaturated repeating units by Rhodospirillum rubrum”. Macromoleculen. 1994. Volume 27. p. 1675-1679.
Weaver, P. “Temperature-Sensitive Mutations of the Photosynthetic Apparatus of Rhodospirillum rubrum.” Proceedings of the National Academy of Sciences of the United States of America. 1971. Volume 68. p. 136-138.
Uitgegeven door studenten van Dr. Iris Keren: Allison Almeida, Matthew Cozzolino, Trung Nguyen, en Jessica Wong.
NEUF2011