Er werd een onderzoeksprogramma uitgevoerd ter verbetering van de verwerkingstechnologie voor het winnen van aluminiumoxide uit niet-bauxiet. Het succes van dit programma heeft de technologie opgeleverd die nodig is voor de produktie van een toereikende aanvoer van hoogwaardig aluminiumoxide uit binnenlandse bronnen, waarmee wordt voorzien in de nationale economische en strategische behoeften met betrekking tot de aluminiumproduktie. Het zoutzuurproces voor het terugwinnen van aluminiumoxide uit laagwaardige ertsen is een van de processen die in het onderzoekprogramma worden onderzocht.
Een fase van dit proces maakt gebruik van het effect van chloride-ionenconcentratie op de oplosbaarheid van aluminiumionen in oplossing. Bij 25° C is de oplosbaarheid van AlCl3 in zuiver water ongeveer 31 gewichtspercenten, en neemt af met toenemende concentratie van zoutzuur (HCl), en wordt 0,1 gewichtspercent wanneer de HCl-concentratie wordt verhoogd tot 37 gewichtspercenten. Dit gedrag is het onderwerp geweest van talrijke onderzoeken, processen en octrooien. Zo is het mogelijk een niet-bauxiethoudend erts met HCl uit te logen, de vloeistof te decanteren en te filtreren, en gasvormig HCl toe te voegen om AlCl3-6H2O te doen neerslaan. De overblijvende zure oplossing kan dan worden gebruikt voor het uitlogen van bijkomend erts en het neergeslagen AlCl3-6H2O kan worden gecalcineerd om Al2O3 te verkrijgen. Een uitvoerige bespreking en evaluatie van dit proces wordt gepresenteerd door Peters, Johnson en Kirby. Thermodynamische gegevens, zoals de ionische activiteiten en de oplosbaarheden, die nodig zijn voor een volledige analyse, interpretatie en verbetering van dit proces zijn schaars, en de bestaande oplosbaarheidsgegevens zijn beperkt tot een smal temperatuurbereik. Daarom waren de doelstellingen van dit onderzoek (1) het bepalen van de oplosbaarheid van AlCl3, in een temperatuurbereik van 25° tot 85° C met HCl-concentratie van 0,0 tot 37.2 pct; (2) het berekenen van de activiteit van AlCl3 en van H2O in oplossingen die verschillende elektrolyten bevatten, en de evenwichtsconstante voor het oplossen van AlCl3-6H2O; en (3) het suggereren van onderzoeksgebieden voor het genereren van bruikbare gegevens.
- Apparatuur
- Experimentele procedure
- Analyse
- Resultaten
- Vergelijking met andere gegevens
- Thermodynamische behandeling
- Solubiliteitsprodukt en Activiteiten in AlCl3-6H2O-H2O-systeem
- Raming van de activiteiten in AlCl3-6H2O-H2O-systeem
- Solubiliteitsprodukt en activiteiten in AlCl3-6H2O-HCl-H2O systeem
- Beschatting van de activiteiten in AlCl3-6H2O-HCl-H2O-systeem
- AlCl3-FeCl3-KCl-NaCl-HCl-H2O-systeem
- Gebieden die voor onderzoek worden aanbevolen
- Aluminiumchloride in waterige zoutzuuroplossingen
Apparatuur
De apparatuur die is gebruikt voor het meten van oplosbaarheden is weergegeven in figuur 1. Een kolf van 100 ml, A, bevat een oplossing van elektrolyten en wat overtollig zout. Een gespleten glasfilter, B, gesmolten op een 6-mm-OD Pyrex buis is verbonden met een buitenste buis bevestigd aan twee Teflon afsluitkranen, D en E. De bovenste assemblage is bevestigd aan A bij C door een schroefdraad nylon knelkoppeling met een neopreen 0-ring. Een polyethyleen buis van 6 mm, F-L, brengt een monster van de bij B gefiltreerde oplossing in de tweede kolf, K, wanneer A onder druk wordt gezet door afsluitkraan D en E wordt geopend. De flessen zijn vastgeklemd op een staaf, G, die bevestigd is aan een schommelmechanisme, met H als schommelas voor het afwisselend op en neer schudden van de flessen A en K. Een afgedekte thermostaat, 0, wordt geregeld tot op ±0,2° C. Een nauwere temperatuurregeling is niet nodig omdat de oplosbaarheid een zeer zwakke functie van de temperatuur is.
Experimentele procedure
Metingen van oplosbaarheden bij 25°, 45°, 65°, en 85° C werden uitgevoerd onder omstandigheden van fase-evenwicht met analytische reagent-grade materialen. Passende hoeveelheden AlCl3-6H2O, 37-pct HCl-oplossing, en gedestilleerd water werden in kolf A gedaan om ongeveer 90 ml oplossing te vormen met een kleine hoeveelheid overtollige zoutkristallen (hierna verwijst “zout” naar aluminiumchloride-hexahydraat). De hoeveelheden materiaal werden geschat op grond van de bestaande gegevens over de oplosbaarheid van het ternaire systeem AlCl3-6H2O-HCl-H2O. Nadat de oplossing in kolf A was gevormd en het apparaat in elkaar was gezet, werd het ondergedompeld in water tot niveau N, en werd de thermostaat op de gewenste temperatuur ingesteld. De kolven werden voortdurend mechanisch geroerd gedurende elke run van 2 tot 3 dagen. Op gezette tijden werd ook krachtig met de hand geroerd om te zorgen voor
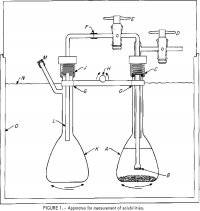
evenwicht, vooral als het zout een complex vast zout kon vormen met HCl. Aan het einde van de equilibratieperiode werden de kolven gedurende 1 uur onbeweeglijk gehouden om bezinking van vaste deeltjes te verzekeren. De kranen D en E werden vervolgens geopend om ongeveer de helft van de oplossing over te brengen in monsterkolf K. Het niveau van B onder de vloeistof in A bepaalde gewoonlijk de hoeveelheid oplossing die in K werd overgebracht. Het gewicht van de oplossing in K werd bepaald door de kolf te wegen vóór de assemblage en na de opname van de oplossing en de demontage. Een bekende hoeveelheid gedestilleerd water werd via L in de kolf geïnjecteerd om het monster te verdunnen en eventuele damp in de gasfase op te lossen. De partiële druk van HCl in zuiver water bedraagt meer dan 1 torr bij 25° C bij molaliteiten van meer dan 8 m (m na een getal in een zin staat voor molaal); bij concentraties van minder dan 8 m is het derhalve twijfelachtig dat tijdens de bemonstering enig verlies van HCl zou kunnen optreden. Om deze reden werd een deel van de runs bij 25° C, die minder dan 4 m HCl bevatten, uitgevoerd met een enkele kolf met stop, en, na equilibratie, werd een deel van de oplossing zorgvuldig gedecanteerd en gefiltreerd voor monstername.
Analyse
De oplossingen werden geanalyseerd na passende verdunningen voor totale chloride-ion en aluminium-ion concentraties. De totale chloride-ion concentratie werd bepaald door potentiometrische titratie met Ag+. De Al+++ concentratie werd bepaald door eerst complexvorming met een overmaat ethyleendiamine-tetraazijnzuur (EDTA) en vervolgens terugtitratie van de overmaat EDTA met Cu++ bij een pH van 3,8.
Het AlCl3-gehalte werd berekend uit de Al+++ analyse. Door het chloride-ion in de berekende hoeveelheid AlCl3 af te trekken van de totale chloride-ionconcentratie kon de HCl-concentratie in de verzadigde oplossingen worden berekend.
Deze berekeningsmethode werd gebruikt voor alle analyses, behalve die waarbij bekend was dat de HCl-concentratie nul was, dat wil zeggen wanneer AlCl3 de enige elektrolyt in zuiver water was. Voor deze analyses werd de AlCl3-concentratie eenvoudig berekend uit de chloride-ion analyse, die de nauwkeurigste van de twee analyses was, hoewel zowel Al++ als Cl- analyses nog steeds werden voltooid voor deze monsters.
Het verschil in Cl-analyse berekend uit de totale Cl-analyse en Cl- uit Al+++ analyse voor experimenten zonder toegevoegd HCl was ±0,2 wt-pct Cl-. Dit geeft aan dat, gemiddeld, de analyse van Al++ onderhevig was aan +0,05 wt-pct fout, aangezien de Cl-analyse bekend was aanzienlijk nauwkeuriger te zijn dan de Al+++ analyse. In oplossingen die HCl bevatten, werd een fout van ±0,05 procent in het Al+++ gehalte weergegeven als ±0,20 pct in het HCl gehalte; dit kwam omdat, terwijl het totale Cl gehalte zeer nauwkeurig was, de Cl bijgedragen door toegevoegd HCl en dus de molaliteit van HCl, werd berekend door verschil zoals eerder vermeld.
Resultaten
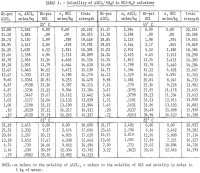
De resultaten zijn samengevat in tabel 1 en weergegeven in figuur 2. De maximale HCl-concentratie voor de gegevens in tabel 1 voor 85° C is ongeveer 30 wt-pct. De metingen werden bij deze concentratie stopgezet wegens de te hoge evenwichtsdrukken in het systeem bij hogere concentraties. Ook moet worden opgemerkt dat er bij 65° en 85° C minder bepalingen zijn uitgevoerd dan bij 25° en 45° C. Bij de twee lagere temperaturen zijn herhalingen uitgevoerd om een indicatie te geven van een bevredigende herhaalbaarheid van de resultaten. Uit figuur 2 blijkt dat de oplosbaarheid van aluminiumzout drastisch daalt met toenemende HCl-concentratie. Daarom is het uitlogen van niet-bauxiethoudende ertsen met HCl-oplossing en het neerslaan van het zuivere zout voor de extractie van aluminium door toevoeging van HCl een haalbaar proces; een dergelijk proces is het onderwerp geweest van verscheidene octrooien. De resultaten tonen aan dat de oplosbaarheid niet sterk verandert met de temperatuur, en voor een temperatuurverhoging van 60° C (25° tot 85° C) neemt de oplosbaarheid van zuiver zout alleen in water slechts toe met 2,2 procent ten opzichte van de oplosbaarheid bij 25° C.
Vergelijking met andere gegevens
De oplosbaarheid van zuiver zout in water bij 25° C bleek precies overeen te komen met de gegevens van Palitzch en met Ehret en Frere. De resultaten van Malquori zijn ongeveer 10 procent hoger. De door Tanaka verkregen oplosbaarheid is ongeveer 3,3 procent hoger dan in het onderhavige onderzoek bij 45° en 65° C.
Het effect van HCl in water op de oplosbaarheid van zout is onderzocht door Seidel en Fisher bij 0° C en door Malquori bij 25° C. De resultaten van de eerste onderzoekers bij 0° C komen zeer goed overeen met de gegevens in tabel 1, geëxtrapoleerd naar 0° C, terwijl die van de laatste onderzoeker bij 25° C enigszins uiteenlopen en ruwweg 3 pet verschillen bij lage HCl-concentraties; de overeenkomst in het bereik van 5 tot 30 wt-pct HCl is echter binnen 1 pct.
Thermodynamische behandeling
Solubiliteitsprodukt en Activiteiten in AlCl3-6H2O-H2O-systeem
De ionische activiteitscoëfficiënt Y12 van AlCl3 in water is tot 1,8 m door Mason gemeten, en herberekende waarden zijn gegeven door Robinson en Stokes. Aangezien verwacht wordt dat de activiteitscoëfficiënt van 1,8 m tot de verzadigingswaarde van 3,3835 m meer dan vervijfvoudigt, wordt de verzadigingswaarde gebruikt voor de berekening volgens de methode die in een eerder verslag uitvoerig is beschreven (1 m = 1 mol in 1 kg oplosmiddel). De methode, met de bijbehorende nieuwe toepassing, wordt in dit rapport kort samengevat. De gemiddelde ionische activiteit van AlCl3, aangeduid als a12, wordt uitgedrukt door de volgende machtsreeks in termen van molaliteit m:

De overeenkomstige vergelijking voor de activiteit van water aw, wordt verkregen door de toepassing van de Gibbs-Duhem relatie; het resultaat is
![]()
Merk op dat de exponenten van m met dezelfde coëfficiënten van C, D, enz, in vergelijking 2 1 hoger zijn dan in vergelijking 1, en de coëfficiënt van m in vergelijking 2 is afkomstig uit de Debye-Huckel-theorie zoals besproken door Gokcen.
De reactie voor het oplossen van het zout is
AlCl3-6H2O (S) = Al+++ + 3Cl- + 6H2O (l),………………………….(3)
waarin (s) vast betekent en (l) vloeibaar.
De bijbehorende evenwichtsconstante is
![]()
waarbij de noemer, de activiteit van de vaste stof, als eenheid wordt genomen omdat de samenstelling onveranderd blijft wanneer andere elektrolyten in oplossing worden toegevoegd. We substitueren voor a12 in 1n Kp rechtstreeks uit vergelijking 1 en voor aw uit vergelijking 2 na vermenigvuldiging van vergelijking 2 met 0,108093 om de coëfficiënt van 1n aw gelijk te maken aan 6. Aangezien Kp samenstellingsonafhankelijk is, is het duidelijk dat
![]()
Na de vereiste substituties uit vergelijkingen 1 en 2 en vervolgens de substitutie van de gemiddelde waarde m = 3.3835 uit de eerste twee reeksen in tabel 1, wordt één vergelijking verkregen voor het oplossen van de zes onbekende coëfficiënten in vergelijking 1, en de resterende vijf vergelijkingen worden verkregen door elk van de vijf experimentele waarden van de gemiddelde ionische activiteitscoëfficiënt van AlCl3 , y12 in tabel 2, te substitueren in
![]()
en vervolgens elk resultaat in vergelijking 1 te substitueren. Zes op deze wijze verkregen gelijktijdige vergelijkingen worden vervolgens met de computer opgelost. De resultaten zijn als volgt:
C = -57,5723,
D = +142,0288,
E = -202,5581,
F = +161,1919,
G = -67,7831,
en H = +11,6880.
Substitutie van deze waarden in vergelijkingen 1, 2 en 4 levert de waarden op van Y12, aw, en Kp. De resultaten zijn opgenomen in tabel 3 onder de rubriek “Bureau-resultaten:”. Opgemerkt zij dat de activiteit van water nu kan worden berekend uit vergelijking 2, en de dampspanning van water boven de oplossing, P, uit
aw = P/P°,……………………………….(7)
waarbij P° de dampspanning is van zuiver water bij dezelfde temperatuur. Merk op dat de dampspanning van water over de verzadigde oplossing iets meer dan de helft is van die over zuiver water, aangezien aw = 0,509. De voorgaande resultaten vormen de eerste reeks gegevens over de activiteiten op basis van de oplosbaarheid van het zout.
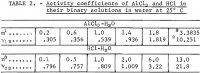
Noot.-In deze tabel verwijst m naar de molaliteit van AlCl3, n verwijst naar de molaliteit van HCl, en molaliteit is mol in 1 kg water.
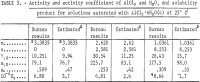
Noot.- In deze tabel verwijst m naar de molaliteit van AlCl3, n verwijst naar de molaliteit van HCl, en molaliteit is mol in 1 kg water.

Noot.-In deze tabel verwijst m naar de molaliteit van AlCl3, n verwijst naar de molaliteit van HCl, en molaliteit is mol in 1 kg water.
Raming van de activiteiten in AlCl3-6H2O-H2O-systeem
Twee bestaande betrouwbare schattingsmethoden worden gebruikt om de activiteiten in AlCl3-6H2O-H2O-systeem te verkrijgen buiten de bestaande directe experimentele gegevens bij m = 1,8. De eerste methode, zoals beschreven door Kusik en Meissner, geeft een geschatte waarde van γ12 = 9,94 op 3,3835 m. Deze geschatte waarde komt goed overeen met 10,251, de waarde die in het onderhavige onderzoek is verkregen. De corresponderende geschatte waarde van de activiteit van water, aw, is 0,47, wederom in nauwe overeenkomst met de in dit onderzoek gevonden waarde van 0,509. De uit deze waarden berekende evenwichtsconstante Kp ligt niet ver van 6,8 x 10 5, gezien het feit dat de vierde macht van a12 en de zesde macht van aw worden vermenigvuldigd om Kp te verkrijgen.
De tweede schattingsmethode van Bromley levert voor γ12 10,42 op, een waarde die dichter ligt bij die welke met de voorgaande methode wordt verkregen. De activiteitscoëfficiënt van water is door de huidige auteurs verkregen door de Gibbs-Duhem vergelijking te integreren waarin de waarden van a12, geschat volgens de methode Bromley, zijn gebruikt. Het resultaat is aw = 0,540. Het gemiddelde van beide methoden is 0,505, hetgeen zeer goed overeenkomt met de waarde van 0,509 van het Bureau. De Bromley-methode bevat echter geen handige methode voor de bepaling van aw die in de Kusik-Meissner-methode is opgenomen.
De overeenkomst van de geschatte waarden met de waarden uit de oplosbaarheidsgegevens is niet altijd zo goed als hier getoond voor elke elektrolyt bij elke samenstelling. Bijvoorbeeld, zelfs voor AlCl3 op 1 m, verschillen de twee schattingen van γ12 slechts 13 procent van elkaar.
Solubiliteitsprodukt en activiteiten in AlCl3-6H2O-HCl-H2O systeem
Het effect van toenemende concentratie HCl op de oplosbaarheid van het zout is grotendeels te wijten aan de toenemende concentratie van de chloride-ionen. De evenwichtsconstante in dit geval met de activiteiten a1 en a2 van de afzonderlijke ionen is
![]()
waar γ12 = γ1γ2 door definitie van γ12 uit de afzonderlijke ionische activiteiten γ1 (voor Al+++) en γ2 (voor Cl-), en n is de molaliteit van HCl. De waarde van Kp is dezelfde als die van vergelijking 4, maar de rechterkant in vergelijking 8 is anders dan die in vergelijking 4. Opgemerkt kan worden dat als n toeneemt, m, de concentratie Al+++, moet afnemen, mits γ12 en aw niet sterk afnemen; derhalve slaat het zout neer, hetgeen bekend staat als het salting out effect.
Voor de berekening van de activiteiten in de ternaire oplossing is een vergelijking nodig die vergelijkbaar is met vergelijking 1 voor HCl. Aangezien de gegevens voor HCl nauwkeurig bekend zijn over een groot concentratiebereik, is het mogelijk een vergelijking te maken met zoveel variabelen als gewenst. De volgende vergelijking geeft een nauwkeurige weergave van de gegevens voor de activiteitscoëfficiënt van HCl, γ32 waarbij het subscript 3 staat voor H+ en 2 voor Cl-:
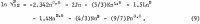
De voor dit doel geselecteerde gegevens van Haase, Naas en Thutnm zijn vermeld op de derde en vierde regel van tabel 2. De waarden van de uit deze gegevens berekende coëfficiënten zijn als volgt:
J = -1,88416,
K = +2,24342,
L = -1,98545,
M = +1,00091,
N = -0,25934,
en P = +0,02634.
De vergelijkingen voor de activiteit van AlCl3 en van H2O bevatten deze coëfficiënten en de coëfficiënten van de kruisproducten (m h/2)(n k/2), waarbij h en k gehele getallen zijn, en deze vergelijkingen luiden als volgt:
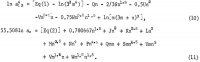
De vijf bijkomende coëfficiënten in deze vergelijkingen worden bepaald door vergelijking 10 en 6 1n aw uit vergelijking 11 op te tellen om 1n Kp te verkrijgen en door de volgende geselecteerde oplosbaarheidsgegevens uit tabel 1 te gebruiken:
m: 2.620, 2,016, 1,333, 0,953 en 0,535.
n: 2,581, 4,460, 6,780, 8,397 en 10,063.
De resulterende berekeningen leveren de volgende waarden op van de coëfficiënten in vergelijkingen 10 en 11:
Q = +23,27027,
S = -22.47064,
U = +4,29102,
V = -9,76081,
en W = +4,60246.
De resultaten voor γ12, a12, aw, en Kp berekend uit de voorgaande vergelijkingen staan vermeld in tabel 3. De waarden van γ12 uit vergelijking 9 komen overeen met die van Harned en Gary bij zeer lage concentraties van HCl en AlCl3.
De partiële druk van HCl(g), P32, over een oplossing kan worden berekend uit de volgende vergelijking (4):
Kp (HCl) = 4.94 x 10 -7 = P32/a²32………………………….(12)
waar Kp(HCl) de evenwichtsconstante is bij 25° C voor H+ + Cl- = HCl(g), en a32 de gemiddelde ionische activiteit van HCl in oplossing. Hiertoe moet een vergelijking voor a32 worden geschreven, vergelijkbaar met vergelijking 10, met gebruikmaking van de parameters van vergelijking 11, zoals elders uitvoerig is aangetoond.
Het effect van de temperatuur op de oplosbaarheid van het zout is gering, zoals blijkt uit tabel 1. Het effect op de ionische activiteiten zal naar verwachting dan ook klein zijn, aangezien alle parameters in vergelijking 11 uit de oplosbaarheidsgegevens hadden kunnen worden verkregen als de experimentele fout kleiner was geweest dan ±0,01 wt-pct voor de aluminiumanalyse. In het algemeen is voor een temperatuurbereik tot ongeveer 80° C elke parameter een lineaire functie van de temperatuur, en deze afhankelijkheid kan worden bepaald als vergelijking 11 bekend zou zijn bij een andere temperatuur die ten minste 50° C hoger is dan 25° C.
Beschatting van de activiteiten in AlCl3-6H2O-HCl-H2O-systeem
De waarden van de activiteiten, de activiteitscoëfficiënt, en het oplosbaarheidsproduct geschat in het huidige rapport volgens de methode bedacht door Kusik en Meissner, zijn vermeld in tabel 3. De activiteitscoëfficiënt γ12 voor AlCl3 is ongeveer tweemaal zo hoog als de geschatte waarde voor de geselecteerde oplossingen die HCl bevatten. De activiteit van water, aw, komt echter goed overeen met de geschatte waarden, behalve voor m = 2,620. Het is duidelijk dat de berekeningen aanzienlijk betrouwbaarder zouden zijn geweest als de dampspanning van water, aw, was gemeten, omdat aw in Kp wordt ingevoerd als aw, zodat kleine fouten in aw grote fouten in γ12 en Kp veroorzaken. Voor dit doel wordt een beperkt aantal dampdrukmetingen aanbevolen om de nauwkeurigheid van de huidige berekeningen en de schattingsmethoden te testen.
De temperatuurafhankelijkheid van de in tabel 3 genoemde thermodynamische eigenschappen kan worden geschat zoals beschreven door Kusik en Meissner. De schatting zal echter waarschijnlijk een hogere mate van temperatuurafhankelijkheid opleveren dan die welke wordt aangegeven door de zwakke temperatuurafhankelijkheid van de oplosbaarheid. Er kon geen poging worden ondernomen om het effect van de temperatuur volgens de methode van het Bureau te berekenen, omdat (1) a12 bij lage concentraties van AlCl3 bij verschillende temperaturen niet bekend is, (2) de oplosbaarheid van AlCl3 niet kon worden bepaald met een nauwkeurigheid die 0,01 pct in Al++ benadert, en (3) het concentratiebereik van HCl bij 65° en 85° C te klein is voor het selecteren van een voldoende aantal sterk verschillende oplosbaarheidsgegevens voor AlCl3 om de parameters in vergelijkingen 10 en 11 nauwkeurig te bepalen.
AlCl3-FeCl3-KCl-NaCl-HCl-H2O-systeem
Voorlopige gegevens over oplosbaarheden van AlCl3, FeCl3 , KCl, en NaCl in waterige oplossingen die 24 tot 31 wt-pct HCl bij 25° C bevatten, werden verkregen om de verontreiniging van AlCl3-6H2O te beoordelen die uit niet-bauxietertsen kan worden gewonnen. Daartoe werd 2 liter van een oplossing met bekende hoeveelheden zouten bereid, 90 ml van deze oplossing werd in een kolf gedaan voor elke run en vervolgens werd een bekende hoeveelheid gasvormig HCl toegevoegd om 24 tot 31 wt-pct opgelost HCl te bereiken. In dit bereik van HCl in oplossing werden kleurloze anisotrope kristallen van AlCl3-6H2O, heldere anisotrope kristallen van FeCl3-2KCl-H2O, en kubische isotrope transparante kristallen van KCl en NaCl neergeslagen en geïdentificeerd door microscopisch onderzoek. De procedure en analyses voor aluminium-ion en chloride-ion concentraties waren dezelfde als die gebruikt werden voor het AlCl3-6H2O-HCl-H2O systeem dat eerder in dit rapport werd gepresenteerd. Daarnaast werd de concentratie ferricium-ionen bepaald door standaard K2Cr2O7 titratie, de concentratie natrium-ionen werd bepaald door atoomabsorptietechnieken, en de concentratie kalium-ionen werd bepaald door het aftrekken van de concentratie natrium-ionen van een bepaling van de gecombineerde kalium-ionen- plus natrium-ionenconcentraties na scheiding door ionenuitwisseling. De resultaten staan vermeld in tabel 4 en zijn uitgezet in figuur 3. Soortgelijke resultaten van Miles zijn ook uitgezet in figuur 3 om aan te tonen dat de overeenkomst uitstekend is. Gepubliceerde gegevens voor verwante eenvoudiger systemen met minder componenten zijn bijeengebracht door Linke.
In de verdampings- of HCl-gas-sparging kristallisatieprocessen voor de productie van zuiver aluminiumchloride hexahydraat, wordt verontreiniging door andere metaalchloriden een probleem naarmate de onzuiverheidsniveaus in de uitloogoplossingen toenemen. Figuur 3 toont de concentratieniveaus waarbij onzuiverheden zoals NaCl, KCl en FeCl2-2KCl-H2O ook uit de oplossing kristalliseren als afzonderlijke afzonderlijke fasen, en zo verontreiniging van de AlCl3-6H2O kristallen veroorzaken. Bijvoorbeeld, bij minder dan 2,4 wt-pct FeCl3 in aanwezigheid van 1,6 wt-pct KCl bij 25° C, moet de concentratie van HCl minder dan 28 wt-pct zijn om verontreiniging van AlCl3-6H2O door het dubbelzout, FeCl3-2KCl-H2O, te voorkomen. Figuur 3 is ook nuttig bij het opnieuw oplossen van het neerslag fractionele herkristallisatie om het aluminiumzout te zuiveren. Bovendien kunnen sommige van de overgangselementzouten, zoals FeCl3, worden geminimaliseerd door gedeeltelijke elektrolyse om een voldoende hoeveelheid ijzer uit te platen alvorens aan te zuren met HCl.
Een thermodynamische behandeling van het systeem met de gebruikelijke fout van ±0,05 wt-pct in chloride-ion concentratie is niet haalbaar, vooral bij gebrek aan dampdrukgegevens voor H2O(g) en HCl(g). Toch kunnen ruwe schattingen van de activiteiten worden gemaakt met behulp van de methode Kusik-Meissner. Verwacht wordt dat dergelijke schattingen slechts ruwe waarden van de activiteiten voor de gehydrateerde en complexe zouten en voor het water kunnen opleveren.

Gebieden die voor onderzoek worden aanbevolen
De metingen van de activiteiten zijn nuttig bij de interpretatie van de thermodynamica en de kinetica van het uitlogen, neerslaan en zuiveren van gewenste bestanddelen van verschillende ertsen. Er zijn twee redenen waarom de activiteiten nauwkeurig kunnen worden bepaald uit de metingen van de dampspanning van water: (1) De dampspanning kan met grote nauwkeurigheid worden gemeten met behulp van drukverschilopnemers om aw te verkrijgen met behulp van vergelijking 7 en vervolgens de waarden van de parameters in vergelijking 11 te berekenen, zodat alle verwante eigenschappen kunnen worden berekend zoals eerder in detail is besproken (2) Het oplosbaarheidsprodukt en de activiteiten kunnen beide nauwkeurig worden bepaald voor multivalente zouten die grote aantallen watermoleculen bevatten in hun gehydrateerde kristallen. De tweede reden vloeit voort uit het feit dat de exponent van de activiteit van water in vergelijking 4 gelijk is aan het aantal mol water in het gehydrateerde kristal.
Aluminiumchloride in waterige zoutzuuroplossingen
Een ander interessant type experiment voor het hier besproken ternaire systeem is de meting van de partiële druk van HCl(g) over verschillende oplossingen die voldoende grote hoeveelheden opgelost HCl bevatten. De experimentele procedure voor dit doel is elders beschreven. Zouten van groep IIA, IIIA en overgangsmetalen zijn uitstekende kandidaten voor dit soort onderzoek, aangezien elektrolyten met hogere valenties dan 1:1 gewoonlijk gehydrateerde zouten vormen.
De oplosbaarheid en de activiteit van aluminiumchloride-hexahydraat, AlCl3-6H2O, in waterige oplossingen werden bepaald als onderdeel van het onderzoek van het Bureau of Mines, U.S. Department of the Interior, ter verbetering van de technologie voor mineraalverwerking voor het terugwinnen van aluminiumoxide uit laagwaardige binnenlandse voorraden. De oplosbaarheid van AlCl3 in zuiver water bleek 31,09 en 31,77 wt-pct te zijn bij respectievelijk 25° en 85° C, en daalde drastisch tot 10 en 0,1 wt-pct wanneer de respectieve hoeveelheden van 20,3 en 37 wt-pct zoutzuur (HCl) in oplossing werden toegevoegd. De evenwichtsconstante voor de oplosbaarheid van het hexahydraat, de activiteiten, en de activiteitscoëfficiënten van AlCl3 en H2O werden berekend en vergeleken met de resultaten van de beschikbare schattingsmethoden. De resultaten bleken bruikbaar te zijn voor het uitlogen van niet-bauxitische ertsen voor de extractie van aluminiumoxide door de oplosbaarheden van de samenstellende zouten bij toevoeging van HCl te veranderen.
Gelijktijdige oplosbaarheden van AlCl3 , FeCl3, KCl, en NaCl in oplossingen van HCl-H2O werden ook bepaald en hun effecten op de zuiverheid van AlCl3-6H2O gekristalliseerd uit gemengde zoutoplossingen worden kort besproken.