Generieke naam: lidocaine hydrochloride
Doseringsvorm: orale oplossing
Rx only
Een topisch verdovingsmiddel voor de slijmvliezen van de mond en keelholte.
Na het in de handel brengen zijn gevallen gemeld van epileptische aanvallen, hartstilstand en overlijden bij patiënten jonger dan 3 jaar na gebruik van Lidocaïne Visceus 2% wanneer het niet werd toegediend met strikte inachtneming van de aanbevelingen voor dosering en toediening. In het kader van tandjespijn, zou Lidocaine Viscous 2% over het algemeen niet moeten worden gebruikt. Voor andere aandoeningen dient het gebruik van het product bij patiënten jonger dan 3 jaar te worden beperkt tot die situaties waarin veiliger alternatieven niet beschikbaar zijn of zijn geprobeerd maar gefaald hebben.
Om het risico van ernstige bijwerkingen bij het gebruik van Lidocaine Viscous 2% te verminderen, moet u zorgverleners instrueren om zich strikt aan de voorgeschreven dosis en toedieningsfrequentie te houden en de voorgeschreven flacon veilig buiten het bereik van kinderen te bewaren.
- Beschrijving
- Lidocaine Topical Oral Solution – Clinical Pharmacology
- Mechanism of Action
- Hemodynamica
- Pharmacokinetiek en Metabolisme
- Indicaties en gebruik voor Lidocaine Topical Oral Solution
- Contra-indicaties
- Waarschuwingen
- Levensbedreigende en fatale voorvallen bij zuigelingen en jonge kinderen
- Methemoglobinemie
- Voorzorgsmaatregelen
- Informatie voor patiënten
- Algemeen
- Geneesmiddeleninteracties
- Carcinogenese, mutagenese, verminderde vruchtbaarheid
- zwangerschap
- Nursing Mothers
- Pediatrisch gebruik
- Bijwerkingen
- Centraal Zenuwstelsel
- Overdosering
- Beheersing van noodsituaties met plaatselijke verdovingsmiddelen
- DOSAGE EN ADMINISTRATIE
- Volwassene
- Pediatrisch
- HOW SUPPLIED
- Package/Label Display Panel
- Package/Label Display Panel
Beschrijving
Lidocaine Viscous 2% (Lidocaine Hydrochloride Oral Topical Solution USP) bevat een lokaal verdovingsmiddel en wordt plaatselijk toegediend. Lidocaine Viscous 2% (Lidocaine Hydrochloride Oral Topical Solution USP) bevat lidocaïnehydrochloride, dat chemisch wordt aangeduid als acetamide, 2-(diethylamino)-N-(2,6-dimethylfenyl)-,monohydrochloride, en heeft de volgende structuurformule:
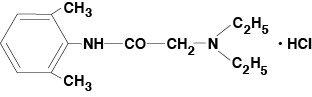
De molecuulformule van lidocaïne is C14H22N2O. Het molecuulgewicht is 234,34.
Samenstelling van de oplossing:
Elke ml bevat 20 mg (2%) lidocaïnehydrochloride USP en de volgende niet-actieve bestanddelen: carboxymethylcellulosenatrium, smaakstof, methylparaben, propylparaben, gezuiverd water en sacharinenatrium.
Lidocaine Topical Oral Solution – Clinical Pharmacology
Mechanism of Action
Lidocaine stabiliseert het neuronale membraan door de ionische stromen te remmen die nodig zijn voor de initiatie en geleiding van impulsen, waardoor een lokale anesthetische werking wordt bewerkstelligd.
Hemodynamica
Extra hoge bloedspiegels kunnen veranderingen veroorzaken in de cardiale output, de totale perifere weerstand en de gemiddelde arteriële druk. Deze veranderingen kunnen worden toegeschreven aan een direct depressief effect van het plaatselijke verdovingsmiddel op diverse componenten van het cardiovasculaire systeem. Het netto effect is normaal gesproken een bescheiden hypotensie wanneer de aanbevolen doseringen niet worden overschreden.
Pharmacokinetiek en Metabolisme
Lidocaïne wordt geabsorbeerd na plaatselijke toediening op slijmvliezen, waarbij de snelheid en de mate van absorptie afhankelijk zijn van de concentratie en de totale toegediende dosis, de specifieke plaats van toepassing, en de duur van de blootstelling. In het algemeen verloopt de absorptie van plaatselijke verdovingsmiddelen na plaatselijke toediening het snelst na intratracheale toediening. Lidocaïne wordt ook goed geabsorbeerd uit het maagdarmkanaal, maar er verschijnt weinig intact geneesmiddel in de circulatie als gevolg van biotransformatie in de lever. De plasmabinding van lidocaïne is afhankelijk van de geneesmiddelconcentratie, en de gebonden fractie neemt af met toenemende concentratie. Bij concentraties van 1 tot 4 mcg vrije base per ml, is 60 tot 80 procent van lidocaïne eiwitgebonden. Binding is ook afhankelijk van de plasmaconcentratie van het alfa-1-zuur-glycoproteïne.
Lidocaïne passeert de bloed-hersenbarrière en de placentabarrière, vermoedelijk door passieve diffusie.
Lidocaïne wordt snel gemetaboliseerd door de lever, en metabolieten en onveranderd geneesmiddel worden door de nieren uitgescheiden. De biotransformatie omvat oxidatieve N-dealkylering, ringhydroxylering, splitsing van de amidebinding, en conjugatie. N-dealkylering, een belangrijke route van de biotransformatie, levert de metabolieten monoethylglycinexylidide en glycinexylidide op. De farmacologische/toxicologische werking van deze metabolieten is vergelijkbaar met, maar minder krachtig dan, die van lidocaïne. Ongeveer 90% van de toegediende lidocaïne wordt uitgescheiden in de vorm van verschillende metabolieten, en minder dan 10% wordt onveranderd uitgescheiden. De primaire metaboliet in de urine is een conjugaat van 4-hydroxy-2, 6-dimethylaniline.
De eliminatiehalfwaardetijd van lidocaïne na een intraveneuze bolusinjectie is typisch 1,5 tot 2 uur. Vanwege de snelle snelheid waarmee lidocaïne wordt gemetaboliseerd, kan elke aandoening die de leverfunctie beïnvloedt, de lidocaïnekinetiek veranderen. De halfwaardetijd kan twee-voudig of meer verlengd worden bij patiënten met leverdisfunctie. Nierdisfunctie heeft geen invloed op de lidocaïnekinetiek, maar kan de accumulatie van metabolieten verhogen.
Factoren zoals acidose en het gebruik van CNS-stimulantia en depressantia beïnvloeden de CNS-niveaus van lidocaïne die nodig zijn om openlijke systemische effecten te produceren. Objectieve nadelige verschijnselen worden steeds duidelijker bij stijgende veneuze plasmaniveaus boven 6 mcg vrije base per ml. Bij de resusaap zijn arteriële bloedspiegels van 18 tot 21 mcg/mL aangetoond als drempel voor convulsieve activiteit.
Indicaties en gebruik voor Lidocaine Topical Oral Solution
Lidocaine is geïndiceerd voor de productie van topische anesthesie van geïrriteerde of ontstoken slijmvliezen van de mond en keelholte. Het is ook nuttig voor het verminderen van kokhalzen tijdens het nemen van röntgenfoto’s en tandafdrukken.
Contra-indicaties
Lidocaïne is gecontra-indiceerd bij patiënten met een bekende voorgeschiedenis van overgevoeligheid voor lokale anesthetica van het amidetype, of voor andere bestanddelen van de oplossing.
Waarschuwingen
EXECESSIEVE DOSERING, OF KORTE INTERVALS TUSSEN DOSES, KUNNEN RESULTEREN IN HOGE PLASMA NIVEAUS EN ZEER GEVERWIJZE EFFECTEN. PATIËNTEN MOETEN WORDEN GEÏNSTRUEERD OM ZICH STRIKT TE HOUDEN AAN DE AANBEVOLEN DOSERING EN TOEDIENINGSRICHTLIJNEN ZOALS UITEENGEZET IN DEZE BIJSLUITER. HET BEHEER VAN ERNSTIGE BIJWERKINGEN KAN HET GEBRUIK VAN RESUSCITATIEMIDDELEN, OXYGEN, EN ANDERE RESUSCITATIEMIDDELEN VERGENOMEN.
Lidocaïne dient met uiterste voorzichtigheid te worden gebruikt indien de mucosa in het gebied van toepassing getraumatiseerd is, aangezien onder dergelijke omstandigheden de mogelijkheid van snelle systemische absorptie bestaat.
Levensbedreigende en fatale voorvallen bij zuigelingen en jonge kinderen
Postmarketing gevallen van toevallen, cardiopulmonale arrestatie en overlijden bij patiënten jonger dan 3 jaar zijn gemeld met gebruik van Lidocaïne Visceus 2% wanneer het niet werd toegediend in strikte naleving van de aanbevelingen voor dosering en toediening. In het kader van tandjespijn, zou Lidocaine Viscous 2% over het algemeen niet moeten worden gebruikt. Voor andere aandoeningen dient het gebruik van het product bij patiënten jonger dan 3 jaar te worden beperkt tot die situaties waarin veiliger alternatieven niet beschikbaar zijn of zijn geprobeerd maar gefaald.
Methemoglobinemie
Er zijn gevallen van methemoglobinemie gemeld in verband met lokaal anesthetisch gebruik. Hoewel alle patiënten risico lopen op methemoglobinemie, zijn patiënten met glucose-6-fosfaatdehydrogenasedeficiëntie, congenitale of idiopathische methemoglobinemie, cardiale of pulmonale compromissen, zuigelingen jonger dan 6 maanden en gelijktijdige blootstelling aan oxiderende middelen of hun metabolieten gevoeliger voor het ontwikkelen van klinische manifestaties van de aandoening. Indien lokale anesthetica moeten worden gebruikt bij deze patiënten, wordt nauwgezette controle op symptomen en tekenen van methemoglobinemie aanbevolen.
Tekenen van methemoglobinemie kunnen onmiddellijk optreden of kunnen enkele uren na blootstelling worden uitgesteld, en worden gekenmerkt door een cyanotische huidverkleuring en/of een abnormale kleuring van het bloed. De methemoglobinespiegels kunnen blijven stijgen; daarom is de onmiddellijke behandeling vereist om ernstigere centrale zenuwstelsel en cardiovasculaire bijwerkingen, met inbegrip van beslagleggingen, coma, aritmie, en dood af te wenden. Beëindig Lidocaine Viskeuze 2% en een andere oxiderende agenten. Afhankelijk van de strengheid van de tekens en de symptomen, kunnen de patiënten aan ondersteunende zorg, d.w.z., zuurstoftherapie, hydratie antwoorden. Bij een ernstiger klinische presentatie kan behandeling met methyleenblauw, wisseltransfusie of hyperbare zuurstof nodig zijn.
Voorzorgsmaatregelen
Informatie voor patiënten
Voorouders en verzorgers moeten worden gewaarschuwd voor het volgende:
– Voor patiënten jonger dan 3 jaar moet er speciaal op worden gelet dat de voorgeschreven dosis nauwkeurig wordt afgemeten en dat het product niet vaker dan voorgeschreven wordt toegediend. – Om de nauwkeurigheid te waarborgen, raden wij u aan een meetapparaat te gebruiken om zorgvuldig het juiste volume af te meten. – Het product mag alleen voor de voorgeschreven indicatie worden gebruikt. – Om het risico van accidenteel inslikken te verminderen, dient de verpakking van het product goed gesloten te zijn en dient het product onmiddellijk na elk gebruik buiten het bereik van alle kinderen bewaard te worden. – Als de patiënt tekenen van systemische toxiciteit vertoont (bv. lethargie, oppervlakkige ademhaling, epileptische aanvallen), moet onmiddellijk medische hulp worden ingeroepen en mag geen extra product worden toegediend. – Ongebruikt product dient te worden weggegooid op een wijze die mogelijke blootstelling van kinderen en huisdieren voorkomt.
Alle patiënten dienen zich ervan bewust te zijn dat wanneer topische anesthetica in de mond of keel worden gebruikt, de productie van topische anesthesie het slikken kan belemmeren en zo het gevaar van aspiratie kan vergroten. Daarom mag gedurende 60 minuten na gebruik van lokale verdovingspreparaten in de mond of keel geen voedsel worden genuttigd. Dit is vooral belangrijk bij kinderen omdat zij zo vaak eten.
Numbiditeit van de tong of buccale mucosa kan het gevaar van bijttrauma vergroten. Om deze reden mag geen voedsel en/of kauwgom worden gebruikt terwijl het mond- of keelgebied verdoofd is.
Informeer patiënten dat het gebruik van lokale anesthetica methemoglobinemie kan veroorzaken, een ernstige aandoening die onmiddellijk moet worden behandeld. Adviseer patiënten of verzorgers onmiddellijk medische hulp in te roepen als zij of iemand onder hun hoede de volgende tekenen of symptomen ervaren: bleke, grijze of blauw gekleurde huid (cyanose); hoofdpijn; snelle hartslag; kortademigheid; licht in het hoofd; of vermoeidheid.
Algemeen
De veiligheid en effectiviteit van lidocaïne zijn afhankelijk van de juiste dosering, correcte techniek, adequate voorzorgsmaatregelen, en paraatheid voor noodgevallen (zie WAARSCHUWINGEN en BIJNA GEACTIVEERDE REACTIES). De laagste dosering die resulteert in effectieve anesthesie moet worden gebruikt om hoge plasmaspiegels en ernstige bijwerkingen te voorkomen. Herhaalde doses lidocaïne kunnen bij elke herhaalde dosis een aanzienlijke stijging van de bloedspiegels veroorzaken als gevolg van de langzame accumulatie van het geneesmiddel en/of zijn metabolieten. De tolerantie varieert met de status van de patiënt. De verzwakte, oudere patiënten, acuut zieke patiënten, en kinderen zouden verminderde dosissen moeten worden gegeven evenredig met hun leeftijd, gewicht en fysieke voorwaarde. Lidocaine zou ook met voorzichtigheid in patiënten met strenge schok of hart block.
Lidocaine zou met voorzichtigheid in personen met bekende drugovergevoeligheden moeten worden gebruikt. Patiënten die allergisch zijn voor paraaminobenzoëzuurderivaten (procaïne, tetracaïne, benzocaïne, enz.) hebben geen kruisgevoeligheid voor lidocaïne aangetoond.
Geneesmiddeleninteracties
Patiënten die lokale anesthetica toegediend krijgen, lopen een verhoogd risico op het ontwikkelen van methemoglobinemie bij gelijktijdige blootstelling aan de volgende geneesmiddelen, waartoe ook andere lokale anesthetica kunnen behoren:
Voorbeelden van geneesmiddelen die geassocieerd worden met methemoglobinemie:
|
Klasse |
Voorbeelden |
|
Nitraten/Nitrieten |
nitroglycerine, nitroprusside, stikstofmonoxide, lachgas |
|
Lokale anesthetica |
benzocaïne, lidocaïne, bupivacaïne, mepivacaïne, tetracaïne, prilocaïne, procaïne, articaïne, ropivacaïne |
|
Antineoplastische middelen |
cyclofosfamide, flutamide, rasburicase, ifosfamide, hydroxyurea |
|
Antibiotica |
dapson, sulfonamiden, nitrofurantoïne, para-aminosalicylzuur |
|
Antimalarialen |
chloroquine, primaquine |
|
Anticonvulsiva |
phenytoïne, natriumvalproaat, fenobarbital |
|
Andere geneesmiddelen |
acetaminofen, metoclopramide, sulfasalazine, kinine |
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Er is geen onderzoek gedaan naar lidocaïne bij dieren om het carcinogene en mutagene potentieel of het effect op de vruchtbaarheid te evalueren.
zwangerschap
Teratogene effecten
Zwangerschap Categorie B: Voortplantingsonderzoek is uitgevoerd bij ratten met doses tot 6,6 maal de menselijke dosis en heeft geen aanwijzingen opgeleverd voor schade aan de foetus veroorzaakt door lidocaïne. Er zijn echter geen adequate en goed gecontroleerde studies bij zwangere vrouwen. Omdat reproductiestudies bij dieren niet altijd voorspellend zijn voor de reactie bij de mens, dient dit geneesmiddel tijdens de zwangerschap alleen te worden gebruikt indien dit duidelijk nodig is.
Nursing Mothers
Het is niet bekend of dit geneesmiddel wordt uitgescheiden in de moedermelk. Omdat veel geneesmiddelen worden uitgescheiden in de moedermelk, is voorzichtigheid geboden wanneer lidocaïne wordt toegediend aan vrouwen die borstvoeding geven.
Pediatrisch gebruik
Dosering bij kinderen dient te worden verminderd, in overeenstemming met leeftijd, lichaamsgewicht en lichamelijke conditie. Zie BIJSLUITING EN TOEDIENING.
Bijwerkingen
Bijwerkingen na toediening van lidocaïne zijn van dezelfde aard als die welke zijn waargenomen bij andere amide lokale verdovingsmiddelen. Deze bijwerkingen zijn in het algemeen dosisgerelateerd en kunnen het gevolg zijn van hoge plasmaspiegels veroorzaakt door overmatige dosering of snelle absorptie, of kunnen het gevolg zijn van overgevoeligheid, idiosyncrasie of verminderde tolerantie bij de patiënt. Ernstige bijwerkingen zijn over het algemeen systemisch van aard. De volgende typen worden het meest gemeld:
Centraal Zenuwstelsel
Manifestaties van het CZS zijn prikkelend en/of depressief en kunnen worden gekenmerkt door lichtheid in het hoofd, nervositeit, vrees, euforie, verwardheid, duizeligheid, slaperigheid, oorsuizen, wazig of dubbel zien, braken, gevoel van warmte, koude of gevoelloosheid, stuiptrekkingen, tremoren, convulsies, bewusteloosheid, ademhalingsdepressie en ademstilstand. De opwindende verschijnselen kunnen zeer kort zijn of helemaal niet optreden, in welk geval de eerste uiting van toxiciteit slaperigheid kan zijn die overgaat in bewusteloosheid en ademhalingsstilstand.
Slaperigheid na de toediening van lidocaïne is gewoonlijk een vroeg teken van een hoge bloedspiegel van het geneesmiddel en kan optreden als gevolg van snelle absorptie.
Cardiovasculair systeem
Cardiovasculaire manifestaties zijn gewoonlijk depressief en worden gekenmerkt door bradycardie, hypotensie en cardiovasculaire collaps, die tot hartstilstand kan leiden.
Allergische
Allergische reacties worden gekenmerkt door cutane laesies, urticaria, oedeem of anafylactoïde reacties. Allergische reacties kunnen optreden als gevolg van gevoeligheid hetzij voor het lokaal anestheticum hetzij voor de in deze formulering gebruikte methylparaben en/of propylparaben. Allergische reacties ten gevolge van gevoeligheid voor lidocaïne zijn uiterst zeldzaam en dienen, indien zij zich voordoen, met conventionele middelen te worden behandeld. Het opsporen van gevoeligheid door huidtesten is van twijfelachtige waarde.
Overdosering
Acute noodsituaties als gevolg van lokale anesthetica zijn over het algemeen gerelateerd aan hoge plasmaspiegels die optreden tijdens therapeutisch gebruik van lokale anesthetica. (Zie BIJWERKINGEN, WAARSCHUWINGEN en VOORZORGSMAATREGELEN)
Beheersing van noodsituaties met plaatselijke verdovingsmiddelen
De eerste overweging is preventie, hetgeen het best kan worden bereikt door zorgvuldige en voortdurende controle van de vitale cardiovasculaire en respiratoire functies en van de bewustzijnstoestand van de patiënt na elke toediening van plaatselijke verdovingsmiddelen.
De eerste stap in de beheersing van convulsies bestaat uit onmiddellijke aandacht voor het handhaven van een open luchtweg en geassisteerde of gecontroleerde beademing met zuurstof. In situaties waarin opgeleid personeel gemakkelijk beschikbaar is, moet de beademing worden gehandhaafd en moet zuurstof worden toegediend via een toedieningssysteem dat onmiddellijke positieve luchtwegdruk met een masker mogelijk maakt. Onmiddellijk na het instellen van deze beademingsmaatregelen dient de toereikendheid van de circulatie te worden beoordeeld, rekening houdend met het feit dat geneesmiddelen die worden gebruikt om convulsies te behandelen soms de circulatie onderdrukken wanneer zij intraveneus worden toegediend. Mochten de convulsies aanhouden ondanks adequate ademhalingsondersteuning, en als de toestand van de circulatie dit toelaat, kunnen kleine hoeveelheden van een ultrakortwerkend barbituraat (zoals thiopental of thiamylal) of een benzodiazepine (zoals diazepam) intraveneus worden toegediend. De clinicus dient vertrouwd te zijn met deze anti-epileptica alvorens lokale anesthetica te gebruiken. Ondersteunende behandeling van circulatiedepressie kan toediening van intraveneuze vloeistoffen vereisen en, indien van toepassing, een vasopressor zoals aangegeven door de klinische situatie (bijv. efedrine).
Als ze niet onmiddellijk worden behandeld, kunnen zowel convulsies als cardiovasculaire depressie leiden tot hypoxie, acidose, bradycardie, aritmieën en hartstilstand. Indien een hartstilstand optreedt, dienen standaard cardiopulmonaire reanimatiemaatregelen te worden ingesteld.
Dialyse is van verwaarloosbare waarde bij de behandeling van acute overdosering met lidocaïne.
De orale LD50 van lidocaïne bij niet-gevoede vrouwelijke ratten is 459 (346 tot 773) mg/kg (als het zout) en 214 (159 tot 324) mg/kg (als het zout) bij gevaste vrouwelijke ratten.
DOSAGE EN ADMINISTRATIE
Volwassene
De aanbevolen maximale eenmalige dosis lidocaïne voor gezonde volwassenen dient zodanig te zijn dat de dosis lidocaïne niet hoger is dan 4.5 mg/kg of 2 mg/lb lichaamsgewicht en in geen geval een totaal van 300 mg overschrijdt.
Voor symptomatische behandeling van geïrriteerde of ontstoken slijmvliezen van de mond en keelholte is de gebruikelijke dosis voor volwassenen 15 ml onverdund. Voor gebruik in de mond moet de oplossing in de mond worden rondgeslingerd en uitgespuugd. Voor gebruik in de keelholte moet de onverdunde oplossing worden gegorgeld en mag worden doorgeslikt. Deze dosis mag niet met tussenpozen van minder dan drie uur worden toegediend, en er mogen niet meer dan acht doses per 24 uur worden gegeven. De dosering dient te worden aangepast aan de leeftijd, het gewicht en de lichamelijke conditie van de patiënt (zie VOORZORGSMAATREGELEN).
Pediatrisch
Voorzichtigheid is geboden bij de juiste dosering bij alle pediatrische patiënten, aangezien er gevallen zijn geweest van overdosering als gevolg van onjuiste dosering.
Het is moeilijk om een maximumdosis van enig geneesmiddel voor kinderen aan te bevelen, aangezien deze varieert als functie van leeftijd en gewicht. Voor kinderen ouder dan 3 jaar die een normale magere lichaamsmassa en een normale lichaamsontwikkeling hebben, wordt de maximumdosis bepaald door het gewicht of de leeftijd van het kind. Bijvoorbeeld: bij een kind van 5 jaar dat 50 pond weegt, mag de dosis lidocaïne niet hoger zijn dan 75 tot 100 mg (3,7 tot 5 mL lidocaïne).
Bij zuigelingen en bij kinderen jonger dan 3 jaar moet de oplossing nauwkeurig worden afgemeten en mag niet meer dan 1,2 mL op de onmiddellijke omgeving worden aangebracht met een katoenen applicator met een punt. Wacht minstens 3 uren alvorens de volgende dosis te geven; een maximum van vier dosissen kan in een periode van 12 uur worden gegeven. Lidocaïne mag alleen worden gebruikt als de onderliggende aandoening behandeling vereist met een volume van het product dat kleiner is dan of gelijk is aan 1,2 ml.
HOW SUPPLIED
Lidocaine Viscous 2% (Lidocaine Hydrochloride Oral Topical Solution USP)
De 2% orale topische oplossing wordt geleverd als een heldere, kleurloze, viskeuze oplossing.
NDC 0054-0548-44: Knijpflesje van 20 ml
NDC 0054-3500-49: Knijpflesje van 100 ml
Bewaren bij 20° tot 25°C (68° tot 77°F).
Doseren in een kindveilige verpakking zoals gedefinieerd in de USP/NF.
VOOR GEBRUIK GOED INWASSEN.
Dist. by: West-Ward
Pharmaceuticals Corp.
Eatontown, NJ 07724
Revised October 2018
Package/Label Display Panel
NDC 0054-3500-49 Lidocaine Viscous (Lidocaine Hydrochloride Oral Topical Solution USP) 100mL

Package/Label Display Panel
NDC 0054-0548-.44 Lidocaine visceus (Lidocaine hydrochloride orale topische oplossing USP) 15mL

| LIDOCAINE VISCOUS lidocaine hydrochloride oplossing |
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
| LIDOCAINE VISCOUS lidocaïnehydrochloride oplossing |
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
Etiketteerder – West-Ward Pharmaceuticals Corp. (080189610)
| Bedrijf | |||
| Naam | Adres | ID/FEI | Operations |
| West-Ward Columbus Inc. | 058839929 | MANUFACTURE(0054-3500, 0054-0548) | |
Medische Disclaimer