Inhoud
- 1 Functie
- 2 Humaan Lactaat Dehydrogenase
- 2.1 Structuur
- 2.2 Katalyse
- 2.3 Kinetiek
- 2.4 Regeling
- 3 3D-structuren van lactaatdehydrogenase
Functie
L-lactaatdehydrogenase (L-LDH) katalyseert de interconversie van pyruvaat en NADH+ naar L-lactaat en NAD+.
H-lactaatdehydrogenase (H-LDH) katalyseert de interconversie van D-lactaat en ferricytochroom c tot pyruvaat en ferrocytochroom c.
Lactaatdehydrogenase (LDH) is een belangrijk enzym bij de mens. Het komt in verschillende regio’s van het lichaam voor, waarbij elke regio een unieke conformatie van verschillende subeenheden heeft. LDH is een sleutelenzym bij de anaërobe ademhaling. Anaërobe ademhaling is de ademhaling in afwezigheid van zuurstof. Deze route is op twee manieren belangrijk voor de glycolyse. De eerste is dat als pyruvaat zich zou ophopen de glycolyse en dus de aanmaak van ATP zou vertragen. De tweede is dat anaërobe ademhaling de regeneratie van NAD+ uit NADH mogelijk maakt. NAD+ is nodig wanneer glyceraldehyde-3-fosfaatdehydrogenase glyceraldehyde-3-fosfaat oxideert in de glycolyse, waarbij NADH wordt gegenereerd. Lactaatdehydrogenase is verantwoordelijk voor de anaërobe omzetting van NADH in NAD+. in het Lactaatdehydrogenase van Cryptosporidium parvum (4nd4).
Menselijk Lactaat Dehydrogenase
Structuur
is een quaternair eiwit gevormd uit de combinatie van twee subeenheden, M en H (Spier en Hart) tot een structuur van vier van de subeenheden. De verschillende combinaties die in het menselijk lichaam worden aangetroffen zijn:
- (4H) Hart
- (3H1M) Reticuloendothelial
- (2H2M) Longen
- (1H3M) Nieren
- (4M) Spier en Lever
De hier afgebeelde LDH-structuur bestaat voor 40% uit alfa-helixen en voor 23% uit bètabladen. De SCOP-gegevens classificeren deze vorm van lactaatdehydrogenase als gemengd bèta-alpha-bèta, met hoofdzakelijk parallelle bètabladen.
Zie ook
- Human Lactate Dehydrogenase
- Jasper Lactate Final
- Rossmann fold.
Katalyse
Studies hebben aangetoond dat het reactiemechanisme van LDH een geordende volgorde volgt.
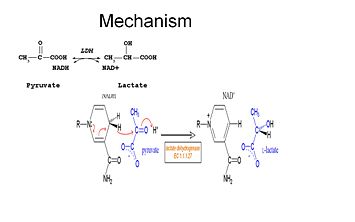
Om lactaat te kunnen oxideren moet NADH zich eerst aan het enzym binden, gevolgd door lactaat. . Zodra het NADH aan het enzym is gebonden, kan vervolgens lactaat worden gebonden (substraat oxamaat is afgebeeld; de -CH3 groep wordt vervangen door -NH2 om oxamaat te vormen). Lactaat bindt zich aan het enzym tussen de nicotinamide ring en verschillende LDH-residuen. De overdracht van een hydride-ion gebeurt dan snel in beide richtingen, waardoor een mengsel ontstaat van de twee tertiaire complexen, enzym-NAD+-lactaat en enzym-NADH-pyruvaat. Tenslotte dissocieert pyruvaat van het enzym, gevolgd door NAD+.
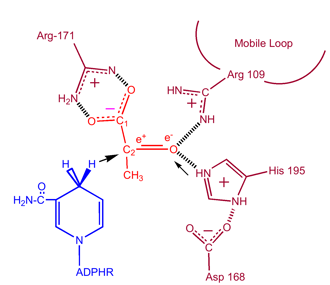
Kinetiek
Kinetische studies van lactaatdehydrogenase met oxalaat en oxamaat (structurele analogen van lactaat en pyruvaat) hebben het hierboven beschreven mechanisme aangetoond. De snelheidsbeperkende stap in deze reactie is de snelheid van dissociatie van NAD+ en NADH. De omzetting van pyruvaat in lactaat met de daaropvolgende regeneratie van NAD+ is zeer gunstig.
Regulering
Aangezien het mechanisme er een is van evenwicht, blijkt er geen regulering te zijn die specifiek is ontworpen voor lactaatdehydrogenase, in plaats daarvan is het afhankelijk van de activering van anaërobe reparatie en de aanwezigheid van pyruvaat en NADH, of lactaat en NAD+.
3D-structuren van lactaatdehydrogenase
Lactaatdehydrogenase 3D-structuren
