- Tabel van Geometrieën
- LEERDOELSTELLINGEN
- KEY TAKEAWAYS
- Key Points
- Key Terms
- VSEPR Model
- Moleculaire Geometrie
- Hoe bepaal je de moleculaire geometrie – YouTube: Deze video beschrijft een methode om snel de belangrijkste geometrische vormen voor eenvoudige moleculen te vinden.
- Moleculaire Geometrie
- LEERDOELSTELLINGEN
- KEY TAKEAWAYS
- Key Points
- Key Terms
- AXE Methode
- Basisgeometrieën (zonder eenzame elektronenparen):
- Trigonaal Planair
- Tetrahedraal
- Octahedral
- Interactief: Elektronengeometrie: Moleculen nemen verschillende vormen aan als gevolg van patronen van gedeelde en niet gedeelde elektronen. In deze voorbeelden worden alle elektronen die de vorm van de moleculen beïnvloeden gedeeld in de covalente bindingen die de atomen bij elkaar houden om de moleculen te vormen.
- Gedeelde elektronenparen
- LEERDOELSTELLINGEN
- KEY TAKEAWAYS
- Key Points
- Key Terms
- Moleculaire Geometrieën met Lone Pair Elektronen
- Coordinatiegetal en het centrale atoom
- Het afstotende effect van de elektronen van het eenpaar
- Interactief: Niet-gedeelde elektronen en de “gebogen” vorm: Gebruik het 3D-model om te zien hoe ongedeelde elektronen de gedeelde elektronen in de bindingen tussen waterstof en zuurstof afstoten, waardoor het molecuul een “gebogen” vorm heeft.
- LICENTIES EN ATTRIBUTIES
- CC LICENTED CONTENT, SHARED PREVIOUSLY
- CC LICENSED CONTENT, SPECIFIC ATTRIBUTION
Tabel van Geometrieën
De VSEPR-theorie bepaalt de moleculaire geometrieën (lineair, trigonaal, trigonaal bipyramidaal, tetrahedraal, en octahedraal).
LEERDOELSTELLINGEN
Het VSEPR-model toepassen om de geometrie te bepalen van een molecuul dat geen eenzame elektronenparen op het centrale atoom bevat.
KEY TAKEAWAYS
Key Points
- Fundamenteel theoretiseert het VSEPR-model dat gebieden met negatieve elektrische lading elkaar zullen afstoten, waardoor ze (en de chemische bindingen die ze vormen) zo ver mogelijk uit elkaar blijven.
- Moleculaire geometrieën houden rekening met het aantal atomen en het aantal lone pair elektronen.
- De belangrijkste geometrieën zonder eenpaarelektronen zijn: lineair, trigonaal, tetrahedraal, trigonaal bipyramidaal, en octahedraal.
Key Terms
- VSEPR-theorie: een scheikundig model dat wordt gebruikt om de vorm van individuele moleculen te voorspellen op basis van elektron-paar elektrostatische afstoting
VSEPR Model
Het valentieschil elektronpaar afstoting (VSEPR) model richt zich op de bindende en niet-bindende elektronparen die aanwezig zijn in de buitenste (valentie) schil van een atoom dat zich verbindt met twee of meer andere atomen.
Fundamenteel theoretiseert het VSEPR-model dat deze gebieden van negatieve elektrische lading elkaar zullen afstoten, waardoor zij (en de chemische bindingen die zij vormen) zo ver mogelijk uit elkaar blijven. Daarom zullen de twee elektronenwolken in een eenvoudig triatomisch molecuul ![]() zich in tegengestelde richtingen uitstrekken. Een hoekafstand van 180° plaatst de twee bindingsbanen zo ver mogelijk van elkaar; we verwachten daarom dat de twee chemische bindingen zich in tegengestelde richtingen uitstrekken, waardoor een lineair molecuul ontstaat.
zich in tegengestelde richtingen uitstrekken. Een hoekafstand van 180° plaatst de twee bindingsbanen zo ver mogelijk van elkaar; we verwachten daarom dat de twee chemische bindingen zich in tegengestelde richtingen uitstrekken, waardoor een lineair molecuul ontstaat.

 . De twee X-atomen (in het wit) zijn 180° van elkaar verwijderd.
. De twee X-atomen (in het wit) zijn 180° van elkaar verwijderd.Als het centrale atoom ook een of meer paren van niet-gebonden elektronen bevat, zullen deze extra gebieden van negatieve lading zich gedragen zoals de gebieden die geassocieerd zijn met de gebonden atomen. De banen die de verschillende bindende en niet-bindende paren in de valentieschil bevatten, zullen zich vanuit het centrale atoom uitstrekken in richtingen die hun onderlinge afstoting minimaliseren. Als het centrale atoom gedeeltelijk bezette d-banen bezit, kan het in staat zijn om vijf of zes elektronenparen te herbergen, wat soms een “uitgebreid octet” wordt genoemd.
Moleculaire Geometrie
Moleculaire geometrieën (lineair, trigonaal, tetrahedraal, trigonaal bipyramidaal, en octahedraal) worden bepaald door de VSEPR-theorie. Een tabel van geometrieën met behulp van de VSEPR-theorie kan het tekenen en begrijpen van moleculen vergemakkelijken. De tabel met molecuulgeometrieën is te vinden in de eerste figuur. De tweede figuur dient als visueel hulpmiddel bij de tabel.


Hoe bepaal je de moleculaire geometrie – YouTube: Deze video beschrijft een methode om snel de belangrijkste geometrische vormen voor eenvoudige moleculen te vinden.
Moleculaire Geometrie
De VSEPR-theorie beschrijft vijf hoofdvormen van eenvoudige moleculen: lineair, trigonaal planair, tetrahedraal, trigonaal bipyramidaal, en octahedraal.
LEERDOELSTELLINGEN
Het VSEPR-model toepassen om de geometrie te bepalen van moleculen waarin het centrale atoom een of meer eenzame elektronenparen bevat.
KEY TAKEAWAYS
Key Points
- Lineair: een eenvoudig triatomisch molecuul van het type
 ; de twee bindingsbanen liggen 180° uit elkaar.
; de twee bindingsbanen liggen 180° uit elkaar. - Trigonaal planair: driehoekig en in één vlak, met bindingshoeken van 120°.
- Tetrahedraal: vier bindingen op één centraal atoom met bindingshoeken van 109,5°.
- Trigonaal tweepiramidaal: vijf atomen rond het centrale atoom; drie in één vlak met bindingshoeken van 120° en twee aan tegenoverliggende uiteinden van het molecuul.
- Octahedraal: zes atomen rond het centrale atoom, alle met bindingshoeken van 90°.
Key Terms
- VSEPR-theorie: het Valence Shell Electron Pair Repulsion (VSEPR)-model wordt gebruikt om de vorm van individuele moleculen te voorspellen op basis van de mate van elektron-paar elektrostatische afstoting
AXE Methode
Een andere manier om naar molecuulgeometrieën te kijken is via de “AXE-methode” van elektronentelling. A in AXE staat voor het centrale atoom en heeft altijd een impliciet subscript één; X staat voor het aantal sigma bindingen tussen het centrale atoom en de atomen erbuiten (meervoudige covalente bindingen – dubbel, drievoudig, enz. – tellen als één X); en E staat voor het aantal eenzame elektronenparen rond het centrale atoom. De som van X en E, bekend als het sterische getal, wordt ook in verband gebracht met het totale aantal gehybridiseerde banen dat door de valentiebindingstheorie wordt gebruikt. VSEPR gebruikt het sterische getal en de verdeling van X’s en E’s om moleculaire geometrische vormen te voorspellen.

Merk op dat de geometrieën alleen volgens de atoomposities worden benoemd, niet volgens de elektronschikking.

Basisgeometrieën (zonder eenzame elektronenparen):
In een lineair model zijn atomen in een rechte lijn met elkaar verbonden, en een bindingshoek is eenvoudigweg de geometrische hoek tussen twee aangrenzende bindingen. Een eenvoudig triatomisch molecuul van het type ![]() heeft zijn twee bindingsbanen 180° uit elkaar liggen. Voorbeelden van triatome moleculen waarvoor de VSEPR-theorie een lineaire vorm voorspelt zijn
heeft zijn twee bindingsbanen 180° uit elkaar liggen. Voorbeelden van triatome moleculen waarvoor de VSEPR-theorie een lineaire vorm voorspelt zijn ![]() (dat niet genoeg elektronen heeft om aan de octetregel te voldoen) en
(dat niet genoeg elektronen heeft om aan de octetregel te voldoen) en ![]() . Merk bij het uitschrijven van de elektronenstippelformule voor koolstofdioxide op dat de C-O bindingen dubbele bindingen zijn; dit maakt geen verschil voor de VSEPR-theorie. Het centrale koolstofatoom is nog steeds verbonden met twee andere atomen. De elektronenwolken die de twee zuurstofatomen verbinden, staan 180° uit elkaar.
. Merk bij het uitschrijven van de elektronenstippelformule voor koolstofdioxide op dat de C-O bindingen dubbele bindingen zijn; dit maakt geen verschil voor de VSEPR-theorie. Het centrale koolstofatoom is nog steeds verbonden met twee andere atomen. De elektronenwolken die de twee zuurstofatomen verbinden, staan 180° uit elkaar.

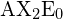 .
.Trigonaal Planair
Moleculen met de trigonaal planaire vorm zijn driehoekig en liggen in één vlak, of plat oppervlak. Een ![]() molecuul zoals
molecuul zoals ![]() heeft drie gebieden van elektronendichtheid die zich uitstrekken van het centrale atoom. De afstoting tussen deze gebieden zal minimaal zijn wanneer de hoek tussen twee ervan 120o is.
heeft drie gebieden van elektronendichtheid die zich uitstrekken van het centrale atoom. De afstoting tussen deze gebieden zal minimaal zijn wanneer de hoek tussen twee ervan 120o is.
Tetrahedraal
Tetra- betekent vier, en -hedral heeft betrekking op een vlak van een vaste stof; “tetrahedraal” betekent letterlijk “met vier vlakken. “Deze vorm wordt gevonden wanneer er vier bindingen zijn op één centraal atoom, zonder eenzame elektronenparen. In overeenstemming met de VSEPR theorie zijn de bindingshoeken tussen de elektronenbindingen 109,5o. Een voorbeeld van een tetrahedraal molecuul is methaan ![]() . De vier equivalente bindingen wijzen in vier geometrisch equivalente richtingen in drie dimensies, die overeenkomen met de vier hoeken van een tetraëder met het koolstofatoom als middelpunt.
. De vier equivalente bindingen wijzen in vier geometrisch equivalente richtingen in drie dimensies, die overeenkomen met de vier hoeken van een tetraëder met het koolstofatoom als middelpunt.

Een trigonale bipyramidale vorm ontstaat wanneer een centraal atoom in een molecuul wordt omgeven door vijf atomen. In de geometrie liggen drie atomen in hetzelfde vlak met bindingshoeken van 120°; de andere twee atomen liggen aan tegenovergestelde uiteinden van het molecuul. Sommige elementen uit groep 15 van het periodiek systeem vormen verbindingen van het type ![]() ; voorbeelden zijn
; voorbeelden zijn ![]() en
en ![]() .
.

Octahedral
Octa- betekent acht, en -hedral heeft betrekking op een vlak van een vaste stof, dus “octahedral” betekent letterlijk “met acht vlakken.” De bindingshoeken zijn allemaal 90°, en net zoals vier elektronenparen minimale afstoting ondervinden als ze naar de hoeken van een tetraëder gericht zijn, proberen zes elektronenparen naar de hoeken van een octaëder te wijzen. Een voorbeeld van een octaëdermolecuul (![]() ) is zwavelhexafluoride (
) is zwavelhexafluoride (![]() ).
).
https://lab.concord.org/embeddable.html#interactives/jsmol/electron-geometry.json
Interactief: Elektronengeometrie: Moleculen nemen verschillende vormen aan als gevolg van patronen van gedeelde en niet gedeelde elektronen. In deze voorbeelden worden alle elektronen die de vorm van de moleculen beïnvloeden gedeeld in de covalente bindingen die de atomen bij elkaar houden om de moleculen te vormen.
Gedeelde elektronenparen
Niet-gebonden elektronen bevinden zich in banen die ruimte innemen, de andere banen afstoten, en de vorm van een molecuul veranderen.
LEERDOELSTELLINGEN
Herken het effect van eenzame elektronenparen op de geometrie van moleculen.
KEY TAKEAWAYS
Key Points
- Orbitalen die de verschillende bindende en niet-bindende paren in de valentieschil bevatten, zullen zich vanuit het centrale atoom uitstrekken in richtingen die hun afstotingen minimaliseren.
- Een niet-bindende orbitaal heeft geen atoomkern aan het uiteinde om de elektronenwolk naar zich toe te trekken; de lading in zo’n orbitaal zal daarom dichter bij het centrale atoom geconcentreerd zijn.
- Niet-bindende orbitalen oefenen meer afstoting uit op andere orbitalen dan bindende orbitalen doen.
Key Terms
- Coördinatiegetal: in de chemie en kristallografie, het aantal buren van een centraal atoom in een molecuul of kristal
- lone pair: een valentiestel van twee elektronen dat bestaat zonder binding of deling met andere atomen
Moleculaire Geometrieën met Lone Pair Elektronen
Tot nu toe hebben we alleen geometrieën besproken zonder enige lone paren elektronen. Zoals u waarschijnlijk in de geometrietabel en de AXE-methode hebt gezien, verandert de vorm van een molecuul door het toevoegen van eenparen. We hebben al eerder gezegd dat als het centrale atoom ook een of meer paren van niet-bindende elektronen bevat, deze extra gebieden van negatieve lading zich zullen gedragen als die geassocieerd met de gebonden atomen. De banen die de verschillende bindende en niet-bindende paren in de valentieschil bevatten, zullen zich vanuit het centrale atoom uitstrekken in richtingen die hun onderlinge afstotingen minimaliseren.

Coordinatiegetal en het centrale atoom
Coordinatiegetal verwijst naar het aantal elektronenparen dat een bepaald atoom, vaak het centrale atoom genoemd, omringt. De geometrie van moleculen met lone paren zal verschillen van die zonder lone paren, omdat het lone paar eruit ziet als lege ruimte in een molecuul. Beide klassen van geometrie zijn genoemd naar de vormen van de denkbeeldige geometrische figuren (meestal regelmatige vaste veelhoeken) die gecentreerd zouden zijn op het centrale atoom en een elektronenpaar op elk hoekpunt zouden hebben.
In het watermolecuul (![]() ) is het centrale atoom
) is het centrale atoom ![]() , en de Lewis elektronendotformule voorspelt dat er twee paren van niet-bindende elektronen zullen zijn. Het zuurstofatoom zal daarom tetraëdrisch gecoördineerd zijn, wat betekent dat het in het centrum van het tetraëder zit. Twee van de coördinatieposities worden ingenomen door de gedeelde elektronenparen die de O-H bindingen vormen, en de andere twee door de niet-bindende paren. Daarom wordt, hoewel het zuurstofatoom tetrahedraal gecoördineerd is, de bindingsgeometrie (vorm) van het
, en de Lewis elektronendotformule voorspelt dat er twee paren van niet-bindende elektronen zullen zijn. Het zuurstofatoom zal daarom tetraëdrisch gecoördineerd zijn, wat betekent dat het in het centrum van het tetraëder zit. Twee van de coördinatieposities worden ingenomen door de gedeelde elektronenparen die de O-H bindingen vormen, en de andere twee door de niet-bindende paren. Daarom wordt, hoewel het zuurstofatoom tetrahedraal gecoördineerd is, de bindingsgeometrie (vorm) van het ![]() molecuul beschreven als gebogen.
molecuul beschreven als gebogen.

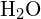 -molecuul beschreven als gebogen.
-molecuul beschreven als gebogen.Het afstotende effect van de elektronen van het eenpaar
Er is een belangrijk verschil tussen bindingsen niet-bondingselektronenbanen. Omdat een niet-bindende baan geen atoomkern aan het uiteinde heeft die de elektronenwolk naar zich toe trekt, zal de lading in zo’n baan dichter bij het centrale atoom geconcentreerd zijn; als gevolg daarvan oefenen niet-bindende banen meer afstoting uit op andere banen dan bindende banen. In ![]() duwen de twee niet-bindende orbitalen de bindende orbitalen dichter bij elkaar, waardoor de H-O-H hoek 104,5° wordt in plaats van de tetrahedrale hoek van 109,5°.
duwen de twee niet-bindende orbitalen de bindende orbitalen dichter bij elkaar, waardoor de H-O-H hoek 104,5° wordt in plaats van de tetrahedrale hoek van 109,5°.
De elektron-dot structuur van ![]() plaatst één paar niet-bindende elektronen in de valentieschil van het stikstofatoom. Dit betekent dat er drie gebonden atomen en één lone pair zijn voor een coördinatiegetal van vier rond het stikstof, hetzelfde als voorkomt in
plaatst één paar niet-bindende elektronen in de valentieschil van het stikstofatoom. Dit betekent dat er drie gebonden atomen en één lone pair zijn voor een coördinatiegetal van vier rond het stikstof, hetzelfde als voorkomt in ![]() .
.

 : Het lone pair verbonden aan de centrale stikstof creëert bindingshoeken die afwijken van de tetrahedrale 109,5 °.
: Het lone pair verbonden aan de centrale stikstof creëert bindingshoeken die afwijken van de tetrahedrale 109,5 °.We kunnen daarom voorspellen dat de drie waterstofatomen op de hoeken van een tetrahedron zullen liggen met het stikstofatoom als middelpunt. De baan van het lone-pair zal naar de vierde hoek van de tetraëder wijzen, maar aangezien die positie vacant zal zijn, kan het ![]() -molecuul zelf niet tetrahedraal zijn; in plaats daarvan neemt het een piramidale vorm aan, meer bepaald die van een trigonale piramide (een piramide met een driehoekig grondvlak). De waterstofatomen liggen allemaal in hetzelfde vlak, met de stikstof buiten het vlak. De niet-bindende elektronen duwen de bindende orbitalen iets naar elkaar toe, waardoor de H-N-H bindingshoeken ongeveer 107° zijn.
-molecuul zelf niet tetrahedraal zijn; in plaats daarvan neemt het een piramidale vorm aan, meer bepaald die van een trigonale piramide (een piramide met een driehoekig grondvlak). De waterstofatomen liggen allemaal in hetzelfde vlak, met de stikstof buiten het vlak. De niet-bindende elektronen duwen de bindende orbitalen iets naar elkaar toe, waardoor de H-N-H bindingshoeken ongeveer 107° zijn.
In 5-gecoördineerde moleculen die eenzame paren bevatten, zullen deze niet-bindende orbitalen (die dichter bij het centrale atoom liggen en dus meer kans hebben om door andere orbitalen te worden afgestoten) bij voorkeur in het equatoriale vlak liggen. Hierdoor staan ze onder een hoek van 90° ten opzichte van niet meer dan twee axiaal-georiënteerde bindingsbanen. We kunnen daarom voorspellen dat een ![]() -molecuul (een waarin het centrale atoom A is gecoördineerd met vier andere atomen X en met één niet-bindend elektronenpaar) zoals
-molecuul (een waarin het centrale atoom A is gecoördineerd met vier andere atomen X en met één niet-bindend elektronenpaar) zoals ![]() een “wip-wap”-vorm zal hebben.
een “wip-wap”-vorm zal hebben.

Door niet-bindende paren te vervangen door gebonden atomen, wordt de driehoekige tweepyramidecoördinatie gereduceerd tot nog eenvoudiger moleculaire vormen.
https://lab.concord.org/embeddable.html#interactives/jsmol/unshared-electrons.json
Interactief: Niet-gedeelde elektronen en de “gebogen” vorm: Gebruik het 3D-model om te zien hoe ongedeelde elektronen de gedeelde elektronen in de bindingen tussen waterstof en zuurstof afstoten, waardoor het molecuul een “gebogen” vorm heeft.
LICENTIES EN ATTRIBUTIES
CC LICENTED CONTENT, SHARED PREVIOUSLY
- Curation and Revision. Geleverd door: Boundless.com. Licentie: CC BY-SA: Attribution-ShareAlike
CC LICENSED CONTENT, SPECIFIC ATTRIBUTION
- VSEPR Theory. Ter beschikking gesteld door: Wikipedia. Gevestigd op: http://en.wikipedia.org/wiki/VSEPR_Theory. Licentie: CC BY-SA: Attribution-ShareAlike
- Moleculaire geometrie. Geleverd door: Wikipedia. Gevestigd op: http://en.wikipedia.org/wiki/Molecular_geometry. Licentie: CC BY-SA: Attribution-ShareAlike
- VSEPR Theorie. Ter beschikking gesteld door: Wikipedia. Gevestigd op: http://en.wikipedia.org/wiki/VSEPR%20Theory. Licentie: CC BY-SA: Attribution-ShareAlike
- Moleculaire geometrie. Geleverd door: Wikipedia. Gevestigd op: http://en.wikipedia.org/wiki/Molecular_geometry. Licentie: Publiek Domein: Geen bekende auteursrechten
- VSEPR geometrieën. Aangeboden door: Wikimedia. Gevestigd op: http://commons.wikimedia.org/wiki/File:VSEPR_geometries.PNG. Licentie: CC BY-SA: Naamsvermelding-GelijkDelen
- Hoe Moleculaire Geometrie Bepalen – YouTube. Gevestigd op: http://www.youtube.com/watch?v=pA9ML0HVOYE. Licentie: Publiek Domein: Geen bekend auteursrecht. Licentievoorwaarden: Standaard YouTube licentie
- Linear-3D-balls. Geleverd door: Wikipedia. Gevestigd op: http://en.wikipedia.org/wiki/File:Linear-3D-balls.png. Licentie: CC BY: Attribution
- Moleculaire geometrie. Geleverd door: Wikipedia. Gevestigd op: http://en.wikipedia.org/wiki/Molecular_geometry. Licentie: CC BY-SA: Attribution-ShareAlike
- VSEPR Theorie. Ter beschikking gesteld door: Wikipedia. Gevestigd op: http://en.wikipedia.org/wiki/VSEPR_Theory. Licentie: CC BY-SA: Attribution-ShareAlike
- VSEPR Theorie. Ter beschikking gesteld door: Wikipedia. Gevestigd op: http://en.wikipedia.org/wiki/VSEPR%20Theory. Licentie: CC BY-SA: Attribution-ShareAlike
- Moleculaire geometrie. Geleverd door: Wikipedia. Gevestigd op: http://en.wikipedia.org/wiki/Molecular_geometry. Licentie: Publiek Domein: Geen bekende auteursrechten
- VSEPR geometrieën. Aangeboden door: Wikimedia. Gevestigd op: http://commons.wikimedia.org/wiki/File:VSEPR_geometries.PNG. Licentie: CC BY-SA: Naamsvermelding-GelijkDelen
- Hoe Moleculaire Geometrie Bepalen – YouTube. Gevestigd op: http://www.youtube.com/watch?v=pA9ML0HVOYE. Licentie: Publiek Domein: Geen bekend auteursrecht. Licentievoorwaarden: Standaard YouTube licentie
- Linear-3D-balls. Geleverd door: Wikipedia. Gevestigd op: http://en.wikipedia.org/wiki/File:Linear-3D-balls.png. Licentie: CC BY: Naamsvermelding
- VSEPR Theorie. Ter beschikking gesteld door: Wikipedia. Gevestigd op: http://en.wikipedia.org/wiki/VSEPR_Theory%23AXE_method. Licentie: Publiek Domein: Geen bekend auteursrecht
- VSEPR Theorie. Ter beschikking gesteld door: Wikipedia. Gevestigd op: http://en.wikipedia.org/wiki/VSEPR_Theory%23AXE_method. Licentie: Publiek Domein: Geen bekend auteursrecht
- coordinatienummer. Geleverd door: Wiktionary. Bevindt zich op: http://en.wiktionary.org/wiki/coordination_number. Licentie: CC BY-SA: Attribution-ShareAlike
- John Hutchinson, Concept Development Studies in Chemistry. 18 september 2013. Ter beschikking gesteld door: OpenStax CNX. Gevestigd op: http://cnx.org/content/m12594/latest/?collection=col10264/latest. Licentie: CC BY: Naamsvermelding
- Grenzenloos. Geleverd door: Grenzeloos Leren. Gevestigd op: http://www.boundless.com//chemistry/definition/lone-pair. Licentie: CC BY-SA: Attribution-ShareAlike
- Moleculaire meetkunde. Aangeboden door: Wikipedia. Gevestigd op: http://en.wikipedia.org/wiki/Molecular_geometry. Licentie: Publiek Domein: Geen bekende auteursrechten
- VSEPR geometrieën. Geleverd door: Wikimedia. Gevestigd op: http://commons.wikimedia.org/wiki/File:VSEPR_geometries.PNG. Licentie: CC BY-SA: Naamsvermelding-GelijkDelen
- Hoe Moleculaire Geometrie Bepalen – YouTube. Gevestigd op: http://www.youtube.com/watch?v=pA9ML0HVOYE. Licentie: Publiek Domein: Geen bekend auteursrecht. Licentievoorwaarden: Standaard YouTube licentie
- Linear-3D-balls. Ter beschikking gesteld door: Wikipedia. Gevestigd op: http://en.wikipedia.org/wiki/File:Linear-3D-balls.png. Licentie: CC BY: Naamsvermelding
- VSEPR Theorie. Ter beschikking gesteld door: Wikipedia. Gevestigd op: http://en.wikipedia.org/wiki/VSEPR_Theory%23AXE_method. Licentie: Publiek Domein: Geen bekend auteursrecht
- VSEPR Theorie. Ter beschikking gesteld door: Wikipedia. Gevestigd op: http://en.wikipedia.org/wiki/VSEPR_Theory%23AXE_method. Licentie: Publiek Domein: Geen bekend auteursrecht
- VSEPR Theorie. Aangeboden door: Wikipedia. Gevestigd op: http://en.wikipedia.org/wiki/VSEPR_Theory. Licentie: Publiek Domein: No Known Copyright
- Tetrahedral_Structure_of_Water.png. Provided by: Wikimedia. Bevindt zich op: https://commons.wikimedia.org/wiki/File:Tetrahedral_Structure_of_Water.png. Licentie: Publiek Domein: No Known Copyright
een scheikundig model dat wordt gebruikt om de vorm van individuele moleculen te voorspellen op basis van elektron-paar elektrostatische afstoting
het totale aantal atomen dat direct grenst aan een centraal atoom in een molecuul of ion
twee (een paar) valentie-elektronen die niet worden gebruikt om een covalente binding te vormen