De opwekking van hernieuwbare energie voldoet niet altijd aan de vraag. Dit is om de eenvoudige reden dat consumenten energie willen gebruiken wanneer de zon niet schijnt of de wind niet waait. Batterijen kunnen worden gebruikt om dit probleem van opwekking en vraag in evenwicht te brengen. Batterijen kunnen worden opgeladen wanneer energie wordt opgewekt en ontladen wanneer energie nodig is.
Batterijen kunnen ook veel meer dan alleen maar energieopwekking en -vraag in evenwicht houden. Batterijen kunnen helpen bij een breed scala van netwerktoepassingen, waaronder back-updiensten, het genereren van synthetische traagheid en het omzetten van niet-synchrone stroom in synchrone stroom. Dit zijn allemaal diensten die essentieel zijn voor de betrouwbare werking van een elektriciteitsnet.
Dus hoe werken batterijen?
Batterijen bestaan uit drie belangrijke onderdelen:
- een positieve elektrode;
- een negatieve elektrode; en
- een elektrolyt dat de elektroden scheidt.
Verschillende elektroden en elektrolyten veroorzaken verschillende chemische reacties die van invloed zijn op de werking van de batterij. Dit is de reden waarom er een grote verscheidenheid van batterijen op de markt is en in ontwikkeling is. Verschillende eigenschappen van batterijen zijn onder meer:
- grootte;
- opslagcapaciteit;
- reactiesnelheid;
- laadsnelheid;
- levensduur;
- veiligheid;
- kosten; en
- recycleerbaarheid.
De vanadium redox batterij (VRB) is één van de recentste batterijen die op de commerciële markt is verschenen. Zij is bijzonder veelbelovend vanwege haar zeer grote opslagcapaciteit. Ook vanuit milieuoogpunt is de VRB veelbelovend. De VRB produceert geen afvalproducten en heeft een lange levensduur. De chemicaliën in een VRB hoeven niet te worden vervangen en kunnen eindeloos worden gebruikt. Alleen de VRB-behuizing en hardware moeten worden vervangen. De lange levensduur betekent ook dat de VRB de potentie heeft om een goedkoop alternatief te zijn voor andere opties.
De VRB heeft een positieve en negatieve kamer gescheiden door een membraan. De positieve kamer heeft een positieve elektrode en de negatieve kamer heeft een negatieve elektrode. Vanadium elektrolyten circuleren in beide kamers: – een positieve vanadiumelektrolyt of -soort in de positieve kamer, en een negatieve soort in de negatieve kamer. De kamers zijn verbonden met opslagtanks, zodat grote hoeveelheden vanadiumelektrolyten kunnen worden ingepompt en door de kamers kunnen circuleren. Het membraan voorkomt dat de positieve en negatieve elektrolyten zich vermengen, maar laat ionen (atomen met een positieve of negatieve lading) door.
Wanneer de VRB wordt opgeladen en ontladen, ondergaan de vanadiumsoorten gelijktijdig oxidatie en reductie, waarbij elektronen door het membraan worden overgedragen. De oxidatie-reductiereactie staat bekend als een redoxreactie. Bij reductie worden elektronen gewonnen. Bij oxidatie worden elektronen verloren. Tijdens het opladen wordt de elektrolyt in de positieve kamer geoxideerd, en de elektrolyt in de negatieve kamer gereduceerd. Tijdens het ontladen is het proces omgekeerd, en wordt de elektrolyt in de positieve kamer gereduceerd terwijl de elektrolyt in de negatieve kamer wordt geoxideerd.
De laad-redoxreactie kan worden gebruikt om elektriciteit op te slaan wanneer die wordt opgewekt en de ontlaad-redoxreactie kan elektriciteit leveren wanneer die wordt gevraagd. De VRB heeft een 75% – 80% laad/ontlaad efficiency.
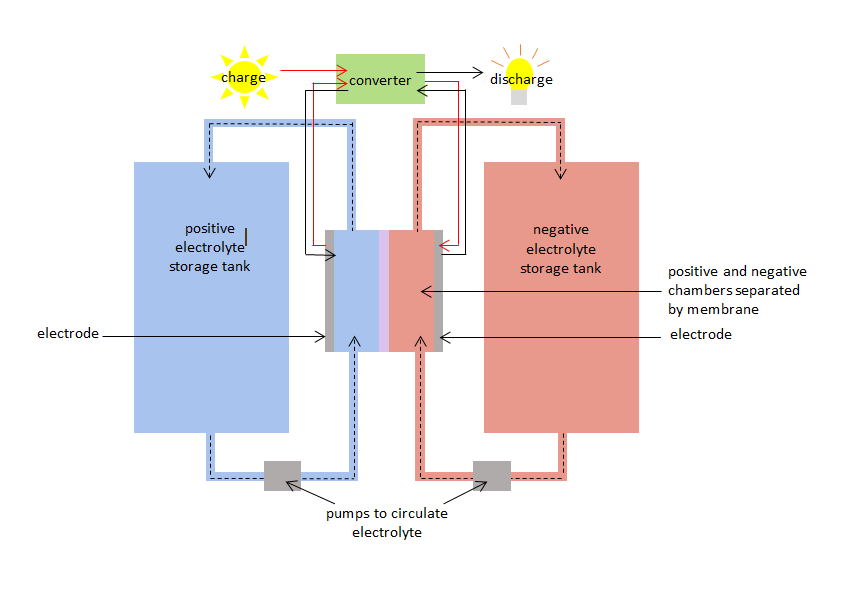
diagram van vanadium redox batterij