Wat zijn enzymen en wat doen ze in ons lichaam? Enzymen zijn in wezen eiwitten die door levende organismen worden geproduceerd om bepaalde metabolische en biochemische reacties in het lichaam tot stand te brengen. Het zijn biologische katalysatoren die reacties in het lichaam versnellen. Laten we er eens meer over te weten komen.
Suggested Videos:
Wat is de structuur van enzymen?
Enzymen zijn, zoals gezegd, biologische katalysatoren. Terwijl zij een proces versnellen of versnellen, bieden zij in feite een alternatieve route voor het proces. Maar daarbij blijft de structuur of samenstelling van de enzymen onveranderd.
Enzymen zijn eigenlijk opgebouwd uit 1000-en aminozuren die op een specifieke manier aan elkaar zijn gekoppeld om verschillende enzymen te vormen. De ketens van de enzymen vouwen zich om tot unieke vormen en het zijn deze vormen die het enzym zijn karakteristieke chemische potentie geven. De meeste enzymen bevatten ook een niet-eiwitbestanddeel dat bekend staat als de co-factor.
Bekijk meer onderwerpen onder Biomoleculen
- Biomacromoleculen
- Bondverbindende monomeren
- Enzymen
- Metabolische Basis Voor Leven
- Nucleïnezuren
- Polysacchariden
- Proteïnen
Typen Enzymen:
De biochemische reacties die in het lichaam plaatsvinden zijn in principe van 6 typen en de enzymen die deze reacties bewerkstelligen worden dienovereenkomstig genoemd:
- Oxidoreductases: Deze enzymen brengen oxidatie- en reductiereacties tot stand en worden daarom oxidoreductases genoemd. Bij deze reacties worden elektronen in de vorm van hydride-ionen of waterstofatomen overgedragen. Wanneer een substraat wordt geoxideerd, fungeren deze enzymen als de waterstofdonor. Deze enzymen worden dehydrogenases of reductases genoemd. Wanneer het zuurstofatoom de acceptor is, worden deze enzymen oxidases genoemd.
- Transferases: Deze enzymen zijn verantwoordelijk voor het overbrengen van functionele groepen van het ene molecuul naar het andere. Voorbeeld: alanine aminotransferase die de alfa-aminogroep tussen alanine en aspartaat enz. verwisselt. Sommige transferases brengen ook fosfaatgroepen over tussen ATP en andere verbindingen, suikerresiduen om disachariden te vormen, zoals hexokinase in de glycolyse.
- Hydrolases: Deze enzymen katalyseren reacties die het proces van hydrolyse met zich meebrengen.Zij verbreken enkelvoudige bindingen door water toe te voegen. Sommige hydrolasen fungeren als spijsverteringsenzymen omdat ze de peptidebindingen in eiwitten verbreken. Hydrolasen kunnen ook een soort transferasen zijn omdat ze de watermolecule van de ene verbinding naar de andere overbrengen. Voorbeeld: Glucose-6-fosfatase die de fosfaatgroep uit glucose-6-fosfaat verwijdert, waardoor glucose en H3PO4 overblijven.
- Lyasen: Deze enzymen katalyseren reacties waarbij functionele groepen worden toegevoegd om dubbele bindingen in moleculen te verbreken of waarbij dubbele bindingen worden gevormd door het verwijderen van functionele groepen. Voorbeeld: Pyruvaatdecarboxylase is een lyase dat CO2 uit pyruvaat verwijdert. Andere voorbeelden zijn deaminases en dehydratases.
- Isomerases: Deze enzymen katalyseren de reacties waarbij een functionele groep wordt verplaatst naar een andere positie binnen hetzelfde molecuul, zodanig dat het resulterende molecuul in feite een isomeer is van het eerdere molecuul. Voorbeeld: triosefosfaatisomerase en fosfoglucose-isomerase voor de omzetting van glucose-6-fosfaat in fructose-6-fosfaat.
- Ligasen: Deze enzymen vervullen een functie die tegengesteld is aan die van de hydrolasen. Waar hydrolasen bindingen verbreken door water toe te voegen, vormen ligasen bindingen door de watercomponent te verwijderen. Er zijn verschillende subklassen ligases waarbij ATP wordt gesynthetiseerd.
Hoe werken enzymen?
Voor elke reactie in het heelal is energie nodig. In gevallen waarin geen activeringsenergie voorhanden is, speelt een katalysator een belangrijke rol om de activeringsenergie te verminderen en de reactie voort te zetten. Dit werkt ook bij dieren en planten. Enzymen helpen de activeringsenergie van de complexe moleculen in de reactie te verminderen. De volgende stappen vereenvoudigen hoe een enzym werkt om een reactie te versnellen:
Stap 1: Elk enzym heeft een “actieve plaats”, dat is de plaats waar een van de substraatmoleculen zich aan kan binden. Zo wordt een enzym-substraatcomplex gevormd.
Stap 2: Dit enzym-substraatmolecuul reageert nu met het tweede substraat om het product te vormen en het enzym komt vrij als het tweede product.
Er zijn veel theorieën die verklaren hoe enzymen werken. Maar er zijn twee belangrijke theorieën die we hier zullen bespreken.
Theorie 1: Slot en Sleutel Hypothese
Dit is de meest geaccepteerde van de theorieën over de werking van enzymen.

Deze theorie stelt dat het substraat precies in de actieve site van het enzym past om een enzym-substraat complex te vormen. Dit model beschrijft ook waarom enzymen zo specifiek zijn in hun werking, omdat ze specifiek zijn voor de substraatmoleculen.
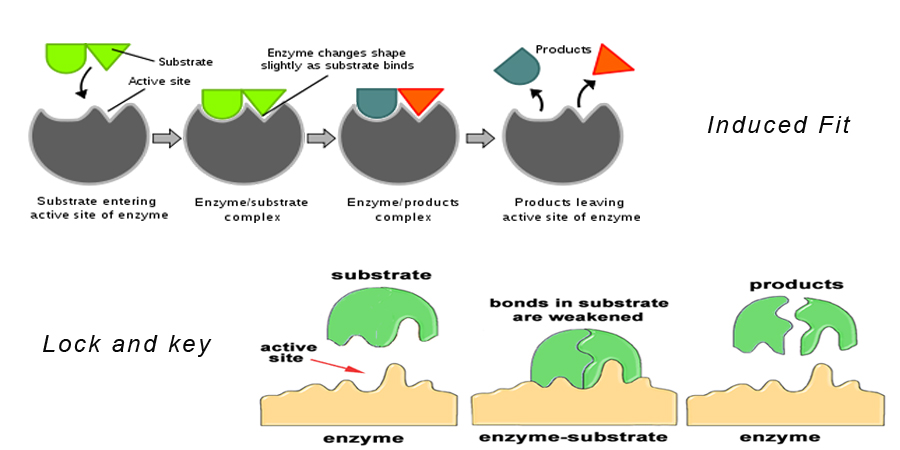
Theorie 2: Induced Fit Hypothese
Deze is vergelijkbaar met de slot-en-sleutel hypothese. Zij zegt dat de vorm van het enzymmolecuul verandert naarmate het dichter bij het substraatmolecuul komt, zodanig dat het substraatmolecuul precies in de actieve site van het enzym past.
Welke factoren beïnvloeden de enzymactiviteit in de cel?
- Concentratie van enzymen en substraten: De reactiesnelheid neemt toe met toenemende substraatconcentratie tot een punt, waarboven elke verdere toename van de substraatconcentratie geen significante verandering in reactiesnelheid oplevert. Dit komt doordat na een bepaalde concentratie van het substraat alle actieve sites op het enzym vol zijn en geen verdere reactie meer kan plaatsvinden.
- Temperatuur: Met de toename van de temperatuur neemt de enzymactiviteit toe door de toename van de kinetische energie van de moleculen. Er is een optimaal niveau waarop de enzymen op hun best en maximaal werken. Deze temperatuur is vaak de normale lichaamstemperatuur van het lichaam. Wanneer de temperatuur een bepaalde grens overschrijdt, beginnen enzymen, die eigenlijk uit eiwitten bestaan, uiteen te vallen en vertraagt de reactiesnelheid.
- pH: Enzymen zijn zeer gevoelig voor veranderingen in de pH en werken in een zeer klein venster van toelaatbare pH-niveaus. Onder of boven de optimale pH-waarde bestaat het risico dat de enzymen uiteenvallen en daardoor vertraagt de reactie.
- Inhibitoren: Aanwezigheid van bepaalde stoffen die de werking van een bepaald enzym remmen. Dit gebeurt wanneer de remmende stof zich hecht aan de actieve plaats van het enzym, waardoor de aanhechting van het substraat wordt verhinderd en het proces wordt vertraagd.
Opgelost voorbeeld voor U
Q: Een enzym werkt door?
a. De activeringsenergie te verhogen
b. De activeringsenergie te verlagen
c. Verlagen van de pH
d. Verhogen van de pH
Sol: a. Verhogen van de activeringsenergie
De reactanten ondergaan niet automatisch een chemische verandering. Zij doen dit in de overgangstoestand. De overgangstoestand heeft meer vrije energie dan de reactanten of de producten. Het onvermogen van reactanten om verandering te ondergaan als gevolg van het vereiste van extra energie om hen om te zetten in de overgangstoestand wordt “Energiebarrière” genoemd. De energie die nodig is om de energiebarrière te overwinnen, wordt “activeringsenergie” genoemd.