Watereigenschappen
Een van de dingen die onze planeet bijzonder maakt, is de aanwezigheid van vloeibaar water. Water is van fundamenteel belang voor al het leven; zonder water zou elk levend wezen sterven.
Water bedekt ongeveer 70% van het aardoppervlak en het maakt 65-75% van ons lichaam uit (82% van ons bloed is water). Hoewel water misschien saai lijkt – geen kleur, smaak of geur – heeft het verbazingwekkende eigenschappen die het noodzakelijk maken voor het ondersteunen van leven.
(Onze behoefte aan water en de oceaandieren die in water leven, is wat olielekkages zo schadelijk maakt.)
De chemische samenstelling van water is H2O – twee waterstofatomen en een zuurstofatoom. De eigenschappen van water zijn bijzonder door de manier waarop de atomen zich aan elkaar binden om een watermolecuul te vormen, en de manier waarop de moleculen op elkaar inwerken.
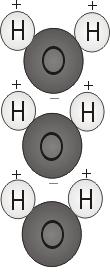
Waterpolariteit
Wanneer de twee waterstofatomen zich aan de zuurstof binden, hechten ze zich vast aan de bovenkant van het molecuul, een beetje zoals de oren van Mickey Mouse. Deze moleculaire structuur geeft het watermolecuul polariteit, of een scheve elektrische lading die andere atomen aantrekt.
Het uiteinde van het molecuul met de twee waterstofatomen is positief geladen. Het andere uiteinde, met de zuurstof, is negatief geladen. Net als bij een magneet, waar noordpolen worden aangetrokken door zuidpolen (’tegenpolen trekken elkaar aan’), zal het positieve uiteinde van het watermolecuul zich verbinden met het negatieve uiteinde van andere moleculen.
Wat betekent dit voor ons? Door de polariteit van water kan het heel gemakkelijk andere polaire stoffen oplossen. Wanneer een polaire stof in water wordt gedaan, worden de positieve uiteinden van zijn moleculen aangetrokken tot de negatieve uiteinden van de watermoleculen, en omgekeerd. De aantrekkingen zorgen ervoor dat de moleculen van de nieuwe stof gelijkmatig met de watermoleculen worden gemengd.
Water lost meer stoffen op dan welke andere vloeistof ook – zelfs het sterkste zuur! Daarom wordt het vaak het ‘universele oplosmiddel’ genoemd. Het oplossend vermogen van water is zeer belangrijk voor het leven op aarde. Overal waar water komt, neemt het opgeloste chemicaliën, mineralen en voedingsstoffen mee die worden gebruikt om levende wezens te ondersteunen.
Omwille van hun polariteit worden watermoleculen sterk tot elkaar aangetrokken, wat water een hoge oppervlaktespanning geeft. De moleculen aan het wateroppervlak “plakken aan elkaar” en vormen een soort “huid” op het water, sterk genoeg om zeer lichte voorwerpen te dragen. Insecten die over water lopen, profiteren van deze oppervlaktespanning.
De oppervlaktespanning zorgt ervoor dat water in druppels samenklontert in plaats van zich in een dunne laag te verspreiden.
Het zorgt er ook voor dat water zich door plantenwortels en -stengels, thermometers, en de kleinste bloedvaten in uw lichaam kan bewegen. Als een molecuul omhoog beweegt, ’trekt’ het de anderen met zich mee.
Drie staten van materie
Water is een van de vier elementen, en de enige natuurlijke stof die in alle drie de staten van materie – vast, vloeibaar en gas – kan bestaan bij de temperaturen die normaal op aarde voorkomen.
Vele andere stoffen moeten oververhit of afgekoeld worden om van toestand te veranderen.
De gasvormige toestand van water is voortdurend aanwezig in onze atmosfeer als waterdamp. De vloeibare toestand is overal te vinden in rivieren, meren en oceanen.
De vaste toestand van water, ijs, is uniek. De meeste vloeistoffen krimpen als ze worden afgekoeld, omdat de moleculen langzamer bewegen en minder energie hebben om aantrekkingskracht op elkaar te weerstaan. Wanneer ze bevriezen tot vaste stoffen, vormen ze dicht opeengepakte kristallen die veel dichter zijn dan de vloeistof oorspronkelijk was.
Water gedraagt zich niet op deze manier. Als het bevriest, zet het uit: de moleculen staan op een rij en vormen een zeer ‘open’ kristallijne structuur die minder dicht is dan vloeibaar water.
Daarom drijft ijs. En het is goed dat het dat doet! Als water zich zou gedragen als de meeste andere vloeistoffen, zouden meren en rivieren vastvriezen en zou al het leven erin sterven.
Drie andere eigenschappen van water
Water heeft een hoge soortelijke warmte. Dat wil zeggen dat water, in tegenstelling tot lucht, veel warmte kan absorberen zonder van temperatuur te veranderen. Daarom voelt zwemmen zo verfrissend aan op een warme dag.
Water verliest ook langzamer warmte dan lucht. Het resultaat is dat in de zomer het water van meren en oceanen meestal het koudst is aan het begin van het seizoen en het warmst aan het eind van het seizoen (na vele dagen energie van de zon te hebben geabsorbeerd).
Het kookpunt van water (212° F of 100°C op zeeniveau) wordt beïnvloed door de hoogte. In het algemeen geldt: hoe hoger de hoogte, hoe lager het kookpunt van water. Bijvoorbeeld, in Denver, CO (5,280 ft.), kookt water bij 202.4° F. Op de Mount Everest in Nepal (29,012 ft.), kookt water bij 156° F.
Waterkunde projecten:
- De watercyclus
- Waterrad
- Supergekoeld water
- Water Reservoir