- Achtergronden
- Normale fysiologie en pathofysiologie van kalium
- Actiepotentiaal van een niet-pacemaker cardiomyocyt
- Actiepotentiaal van een cardiale pacemakercel
- Stroomgeleiding
- Brekingsperiode
- Hyperkaliëmie, classificatie en oorzaken
- Classificatie
- Oorzaken
- Effecten van hyperkaliëmie
- Metabole effecten
- Natrium-kaliumpomp
- Conclusie
Achtergronden
Kalium is een zacht, zilverwit, zeer reactief kation dat behoort tot de familie van de alkalimetaalgroepen in het periodiek systeem. Het is het meest voorkomende kation in het menselijk lichaam als geheel, en het meest voorkomende ion in de intracellulaire compartimenten.
Gemiddeld bevat een westers dieet 80-100 mEq kalium per dag, en onder normale fysiologische omstandigheden wordt 90% daarvan passief geabsorbeerd, waardoor slechts 9,0 mmol overblijft voor uitscheiding via de feces. De 3500-4000 mmol die in het lichaam worden opgeslagen, staan in geen verhouding tot de dagelijkse kaliumspiegel in het plasma, die normaal tussen 3,5 en 5,3 mmol/L wordt gehouden door middel van een strak homeostase-mechanisme, waarbij de laagste waarden ’s nachts en in de vroege ochtenduren worden gemeten en de hoogste piekwaarden in de middaguren.
Eenmaal opgenomen in de bloedstroom wordt het de taak van de nieren om de kaliumopname af te stemmen op de kaliumafgifte; dit vergt verscheidene uren, gedurende welke tijd de “interne kaliumbalans” onder invloed van insuline en catecholamines de tijdelijke homeostase handhaaft door het kalium tussen de intracellulaire en extracellulaire ruimten te verplaatsen. Stimulatie van de alpha-receptoren belemmert de kalium-intrede in de cellen, en stimulatie van de beta-receptoren bevordert deze door activering van de natrium-kalium ATPase-pomp.
De natrium-kalium ATPase-pomp is het gate-keeper enzym dat zich in het sarcolemma bevindt. Het helpt om 98% van het kalium (ongeveer 144,0 mmol) dat in de cel wordt vastgehouden, veilig te stellen. Dit zorgt voor het behoud van het vitale potentiaalverschil over de celmembranen dat nodig is voor een goede celfunctie, vooral de exciteerbare cellen zoals zenuwcellen en hartspiercellen.
Normale fysiologie en pathofysiologie van kalium
Na de snelle absorptie helpt kalium zijn eigen lichaamsspiegels te orkestreren door het vrijkomen van insuline en aldosteron. Andere lichaamseigen stimuli die ook het kaliumgehalte regelen, zijn bèta-2 adrenerge receptoren, een alkalische PH van het bloed en cellulair anabolisme.
Vrijkomen van insuline en aldosteron: Ingenomen kalium komt snel in de circulatie. Wanneer het de portale circulatie bereikt, stimuleert het de pancreas tot afgifte van insuline. Tegelijkertijd leidt het circulerende kalium dat de juxtaglomerulaire cellen bereikt tot het vrijkomen van renine. Renine wordt bij aankomst in de lever omgezet in angiotensine I. Angiotensine I reist naar de longen, waar het wordt omgezet in angiotensine II. Angiotensine II voltooit dan zijn reis terug naar de nieren via het circulerende bloed om de zona glomerulosa te stimuleren aldosteron af te scheiden.
Intern Kaliumevenwicht: De insuline die post-prandiaal vrijkomt, werkt voornamelijk op de skeletspieren en activeert twee routes, de AKT-afhankelijke route die verantwoordelijk is voor de insluiting van de glucosetransporter GLUT4 en de APK-route die de cellulaire natrium-kalium ATPase activeert om het kalium naar de intracellulaire ruimte te verplaatsen. In tegenstelling tot de AKT-afhankelijke route wordt de APK-route niet gestoord door het metabool syndroom of chronische nierziekten (figuur 1).
Uitscheiding: Kalium dat door de nierglomeruli wordt gefilterd, wordt passief geherabsorbeerd in de proximale tubulus en de lus van Henle in verhouding tot de hoeveelheid natrium en water die wordt geleverd. Normaal bereikt slechts ongeveer 10% van de gefiltreerde lading het distale nefron.
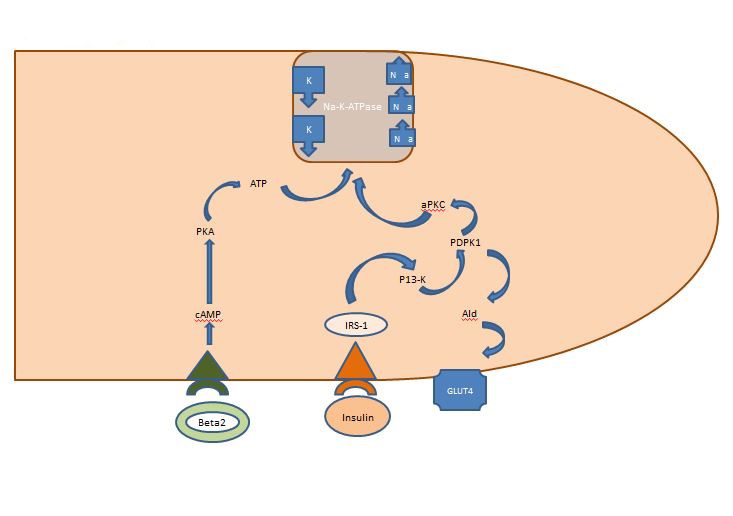
Figuur 1. Actie van insuline op een skeletspiercel. Insuline die post-prandiaal vrijkomt, activeert twee routes in skeletspieren, de AKT-afhankelijke route die verantwoordelijk is voor de insluiting van de glucosetransporter GLUT4 en de APK-route die de cellulaire natrium-kalium-ATPase activeert om het kalium naar de intracellulaire ruimte te verplaatsen.
Aan het begin van de distale convoluole tubulus begint de secretie van overtollig kalium en neemt deze geleidelijk toe naarmate deze verder vordert in de richting van het distale nefron en naar het verzamelbuisje. Dit wordt gemedieerd door de upregulatie van waterstof-kalium ATPase op de alpha-intercalated cellen .
De aanwezigheid van hogere kaliumniveaus in de peritubulaire cellen van de nieren activeert het RAAS-systeem om aldosteron vrij te geven, dat de natrium-kalium ATPase in het basolaterale membraan activeert, wat resulteert in een daling van het intracellulaire natrium, wat leidt tot het verhoogde elektrogenetische transport van kaliumopname door de membraanspanning te hyperpolariseren en de uitscheiding ervan in de urine mogelijk te maken .
Bij hyperkaliëmie kan de hoeveelheid kalium die via de dikke darm wordt uitgescheiden tot 30% toenemen, bijv, in gevallen van nierinsufficiëntie, waarbij het kalium dan actief wordt opgenomen door de geactiveerde natrium-kalium ATPase pomp in het basolaterale membraan van de colon enterocyten, om aan de andere kant te worden uitgescheiden in het colonlumen via de apicale grote calciumafhankelijke kaliumkanalen van de cellen.
Uit het bovenstaande blijkt dus dat het mechanisme van de homeostase van het kalium plasmaniveau hoofdzakelijk wordt bepaald door de interactie van drie gelijktijdige transacties – kaliuminname, kalium intra/extracellulaire verschuivingen en kalium urine-uitscheiding, die alle uiteindelijk afhankelijk zijn van de natrium-kalium pomp.
Om het mechanisme van dreigend gevaar van hyperkaliëmie en de beheersing ervan te begrijpen, moet men de fysiologie van de actiepotentiaal en het inwendige van het natrium-kalium ATPase enzym begrijpen.
Electrofysiologie van de actiepotentiaal, d.w.z., ionische beweging over de celmembranen, wordt bepaald door het verschil in twee potentialen, een “chemische potentiaal” waarin de ionen langs hun concentratiegradiënt bewegen en een “elektrische potentiaal” waarin ionen en moleculen gelijksoortige ladingen afstoten, wat de transmembraanpotentiaal (TMP) oplevert, waarvan wordt gezegd dat deze +ve is wanneer de netto beweging van +ve ionen naar de buitenkant van de cel is en vice versa.
Actiepotentiaal van een niet-pacemaker cardiomyocyt
Er zijn vijf fasen in een actiepotentiaal, die beginnen en eindigen bij fase 4. De pompen die hierbij betrokken zijn, zijn de sarcolemma natriumcalciumwisselaar, de calcium ATPase en, uiteindelijk, de natrium-kalium ATPase.
- Phase 4. De rustfase: deze heeft een rustpotentiaal van -90 mV als gevolg van de constante uitgaande beweging van kalium via de inward rectifier kanalen. Tijdens deze fase zijn zowel de natrium- als de calciumkanalen gesloten.
- Fase 0. De depolarisatiefase: het vuren van een pacemakercel of de geleiding door een naburige cel veroorzaakt de stijging van de TMP tot boven -90 mV. Op dit punt openen de “snelle natriumkanalen” zich één voor één, waardoor natrium de cel binnendringt, de TMP stijgt en, zodra er voldoende snelle natriumkanalen zijn geopend om -70 mV op te wekken, een zichzelf onderhoudende inwaartse natriumstroom in gang wordt gezet, waarbij de TMP snel wordt gedepolariseerd tot 0 mV voor een kortstondige tussentijd die bekend staat als de “overshoot”, op welk punt de tijdsafhankelijke snelle natriumkanalen sluiten en de “lang-openende” calciumkanalen openen om de TMP te verhogen tot -40 mV en een kleine gestage calciuminstroom langs de concentratiegradiënt mogelijk te maken.
- Fase 1. De vroege repolarisatiefase: deze begint met de licht +ve TMP en de korte opening van enkele kaliumkanalen, waardoor het kalium naar de buitenkant van de cel stroomt en de TMP terugkeert naar ongeveer 0 mV.
- Phase 2. De plateau-fase: hier zijn de twee tegenstromen elektrisch in evenwicht en resulteren in het in evenwicht houden van de TMP op iets onder 0 mV. “De lang-openende calciumkanalen” zijn nog steeds open, wat resulteert in een constante calciumstroom in de cel. Het vertraagd rectificerende kaliumkanaal zorgt voor de passage van kalium naar de buitenkant van de cel langs de concentratiegradiënt.
- Fase 3. De repolarisatiefase: tijdens deze fase worden de calciumkanalen geleidelijk geïnactiveerd en de aanhoudende kaliumstroom naar de buitenkant van de cel overtreft aldus de inwaartse calciumstroom, waardoor het kalium naar de intracellulaire ruimte en het natrium en calcium naar de buitenkant van de cel terugkeert.
Actiepotentiaal van een cardiale pacemakercel
De cardiale pacemakercellen hebben een aangeboren automatisme, waardoor hun depolarisatie in ritmische cycli kan verlopen. De sinoatriale knoop (SAN) heeft het hoogste zelfgeïnitieerde depolariserende ritme met een snelheid van 60-90/min, gevolgd door de atrioventriculaire knoop (AVN) met een snelheid van 40-60/min en vervolgens de Purkinjevezels en de ventriculaire spier met 20-40/min.
De membraanpotentialen van pacemakercellen zijn instabiel en hun actiepotentialen hebben geen duidelijk afgebakende fasen. Zij hebben minder inwendig rectificerende kaliumkanalen en hun TMP daalt nooit tot onder -60 mV, waardoor de rol van de snelle natriumkanalen, die een TMP van -90 mV vereisen, wordt geëlimineerd, hetgeen resulteert in de afwezigheid van de snelle depolarisatiefase.
Bij TMP >-60 mV komt de “grappige/pacemaker” stroom in actie met een spontane stroom van ionen door de langzame natriumkanalen, die de TMP depolariseert tot <-50 mV en dan terug naar -60 mV wanneer de calciumkanalen sluiten.
Stroomgeleiding
Alle cardiomyocyten zijn elektrisch gekoppeld via de gap junction, inclusief de pacemaker cel. Dit vergemakkelijkt de wijdverspreide depolarisatie van alle naburige cellen, waardoor het hart één functionele eenheid wordt waarin de cel met de hoogste inherente snelheid de “pacemaker” wordt.
Brekingsperiode
De langere refractaire periode tijdens het lange plateau in fase 2 als gevolg van de langzame calciumkanalen levert de tijd die nodig is voor de volledige lediging van de ventrikels vóór de volgende contractie. De refractaire perioden kunnen absoluut (ARP), effectief (ERP) of relatief (RRP) zijn. In een ARP is de cel absoluut niet oproepbaar.
Een ERP duurt van de ARP tot het korte segment van fase 3. Een stimulus op dit punt zou de cel minimaal kunnen depolariseren, maar het niveau van depolarisatie is zwakker dan het voortplanten van een actiepotentiaal naar de naburige cellen.
RRP wordt teweeggebracht door een bovennormale stimulus, die leidt tot depolarisatie van de cel en de productie van een actiepotentiaal.
Een “bovennormale periode” is een hyperexciteerbare toestand waarin een zwakker dan normale prikkel tot een aritmie zou kunnen leiden, waardoor de synchronisatie tijdens de cardioversie nodig is om ventrikelfibrillatie te voorkomen (figuur 2).
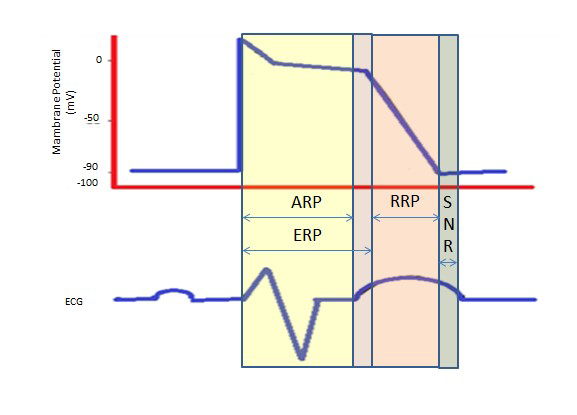
Figuur 2. Breekbare perioden. ARP: Absolute refractaire periode; ERP: Effectieve Breekbare Periode; RRP: Relative Refractory Period; SNR: Supranormal Refractory Period
Hyperkaliëmie, classificatie en oorzaken
Classificatie
Hyperkaliëmie wordt geclassificeerd als mild bij niveaus in het bereik van 5,5-6,0 mmol/L, matig bij 6,1-6,9 mmol/L en ernstig bij niveaus van 7.0 mmol/L of hoger, en bij elk niveau waarbij ECG-veranderingen optreden.
Oorzaken
Hyperkaliëmie treedt op wanneer compensatiemechanismen niet langer in staat zijn de onbalans aan te kunnen, waardoor het meestal multifactorieel is.
- Verhoging van de inname van kalium via elke route, bijv, orale inname via de voeding, of intraveneuze toediening van kaliumbevattende vloeistoffen zoals penicilline G.
- Opname door de nieren: Aangezien de kaliumuitscheiding afhankelijk is van aldosteron en de levering van een voldoende distale hoeveelheid natrium en water binnen de nefronen, kunnen aandoeningen zoals nierinsufficiëntie, bijnierinsufficiëntie (ziekte van Addison) , hyporeninemisch hypoaldosteronisme type IV, renale tubulaire acidose, vooral bij patiënten met diabetische nefropathie, alsmede elke aandoening die hypoperfusie bevordert, zoals bij volumedepletie en congestief hartfalen, zal het ingewikkelde kaliumevenwicht in het lichaam beïnvloeden en predisponeren tot hyperkaliëmie.
- Bijnierinsufficiëntie: dit moet worden uitgesloten bij hyperkaliëmische patiënten, vooral in aanwezigheid van hyponatriëmie en spierzwakte. Om te screenen op primaire bijnierinsufficiëntie wordt een standaard cosyntropine-stimulatietest uitgevoerd waarbij 0,25 mg synthetisch cosyntropine wordt toegediend als een intraveneuze bolus, gevolgd door plasmacortisolmeting 45 minuten tot 1 uur later. Waarden lager dan 20 mcg/dL duiden op bijnierinsufficiëntie.
- Drugs die kalium vasthouden: voorgeschreven geneesmiddelen die de natrium-kalium ATPase activiteit verminderen, zoals beta-adrenerge receptor blokkers, en geneesmiddelen die de aldosteron secretie verminderen, zoals ACE en ARB remmers, niet-steroïde anti-inflammatoire geneesmiddelen, en kalium sparende diuretica, moeten nauwgezet worden gevolgd om iatrogene hyperkaliëmie te voorkomen, vooral in de geriatrische leeftijdsgroep met hun progressieve afname van de nierfunctie als onderdeel van het verouderingsproces.
- Storingen in de transcellulaire verschuiving van kalium: dit kan voorkomen bij condities van acidose, hyperglykemie, hyperosmolaliteit, zware inspanning, weefselafbraak, hyperkalemische periodieke verlamming, en met bèta-adrenerge blokkers. Voor elke 0,1 eenheid daling van de PH van het bloed, stijgt het serumkalium met ongeveer 0,6 mmol/L (minder als de acidose wordt veroorzaakt door organische zuren).
- Pseudo-hypoaldosteronisme is een aangeboren autosomaal recessieve ziekte waarbij de nieren resistent zijn tegen de werking van aldosteron.
- Pseudo-hyperkaliëmie mag ook niet over het hoofd worden gezien: zoals de naam al aangeeft, is er sprake van een verhoogd serumkalium bij een normaal plasmakalium. Het kan worden waargenomen bij hemolyse van bloed, bij langdurig strak aantrekken van de tourniquet tijdens een bloedafnameprocedure, waardoor extracellulair kalium vrijkomt, bij herhaaldelijk dichtknijpen van de vuist tijdens flebotomie, bij een traumatische venepunctie, bij leukocytose en trombocytose, en bij enkele zeldzame genetische syndromen zoals familiaire pseudo-hyperkaliëmie en hereditaire sferocytose. Het kan echter ook gewoon het gevolg zijn van een simpele laboratoriumfout.
Effecten van hyperkaliëmie
Milde hyperkaliëmie is vaak asymptomatisch en wordt toevallig ontdekt door laboratoriumtests, vanwege de vage symptomen zoals malaise, spierzwakte en paresthesie. Ernstige hyperkaliëmie tast de neuromusculaire functie aan in de vorm van skeletspierzwakte en verlamming; dit is echter geen frequente presentatie omdat de cardiale toxiciteit het beeld domineert en de eerste presentatie is. De cardiale toxiciteit zal zich op het ECG gewoonlijk op de volgende trapsgewijze escalerende wijze presenteren, hoewel dit niet noodzakelijkerwijs het geval hoeft te zijn, afhankelijk van de etiologie:
- Bij niveaus van meer dan 5,5 mEq/L neemt door de toename van de geleiding van kaliumkanalen de lkr-stroom toe, hetgeen leidt tot snelle repolarisatie in de vorm van een gepiekte T-golf op het oppervlakte-ECG. Deze T-golven kunnen worden onderscheiden van die van myocardinfarct en CVA door hun korte duur, variërend van 150-250 msec.
- Bij kaliumgehalten hoger dan 6,5 mEq/L treedt een toestand van aanhoudende subthreshold depolarisatie op, waardoor een vertraging in atriale en ventriculaire depolarisatie optreedt. De afname in fase 0 van de actiepotentiaal leidt tot een langere actiepotentiaal, waardoor een vertraging in de intraventriculaire en atrioventriculaire geleiding optreedt. Op het oppervlakte-ECG zal dit tot uiting komen in een afvlakking en verlies van P-golven en een verbreding van QRS-complexen. Met toenemende vertraging in de intraventriculaire geleiding, begint het oppervlakte-ECG tekenen van linker- en rechterbundeltakblok te vertonen. Dit kan worden onderscheiden van bundeltakziekte door het feit dat bij hyperkaliëmie de vertraging in het gehele QRS-complex aanhoudt en niet alleen in het begin- of eindgedeelte.
- Bij 10 mEq/L treedt geen sinoatriale geleiding meer op en neemt het versnelde junctionele ritme het over. Ventriculaire aritmieën ontwikkelen zich met het samensmelten van de verbrede QRS-complexen met de T-golven om uiteindelijk het klassieke sinusgolfpatroon te vormen. Zodra dit zich voordoet, zijn VF en asystole ophanden en volgt er een hartstilstand.
- Soms zijn de veranderingen grillig en onvoorspelbaar en springt het ECG van normaal naar asystolie als gevolg van de variabiliteit in de etiologische factoren en hun invloedrijke effecten, bijv. de snelheid van kaliumverandering, calciumconcentratie, pH, en natriumconcentratie. Daarom moet hyperkaliëmie met spoed worden behandeld wanneer de kaliumspiegel hoger wordt dan 6,5 mmol/L, of bij aanwezigheid van ECG manifestaties van hyperkaliëmie, ongeacht de kaliumspiegel. Andere gerapporteerde associaties met acute hyperkaliëmie zijn: beeld van pseudo MI op de ECG-opname, met massief ST-T segment als gevolg van stoornissen in de repolarisatie van myocyten, korte PR- en QT-intervallen, sinustachycardie, sinusbradycardie, idioventriculair ritme, 1e en 2e graads hartblok.
Metabole effecten
Hyperkaliëmie leidt tot hyperchloremische metabole acidose omdat de hyperkaliëmie de intracellulaire opname van kalium bevordert in ruil voor waterstofionen. Hierdoor ontstaat intracellulaire alkalose, die de ammoniakproductie in de proximale tubuli van de nieren onderdrukt, wat leidt tot een daling van de uitscheiding van ammonium en zuur in de urine en een type IV renale tubulaire acidose .
Natrium-kaliumpomp
De natrium-kalium ATPase werd in 1957 ontdekt door Skou, die voor zijn ontdekking later een deel van de Nobelprijs voor Scheikunde 1997 kreeg.
Skou ontdekte als eerste de natrium-kalium ATPase in het sarcolemma van het celoppervlak van de hartspier. Later werd de aanwezigheid ervan ontdekt in elk eukaryotisch een- en meercellig organisme.
De natrium-kaliumpomp functioneert door de hydrolyse van ATP te koppelen aan de cellulaire export van drie natriumionen in ruil voor twee kaliumionen tegen hun elektrochemische gradiënten in. Het is het moleculaire doelwit van digitalis en digoxine, die sinds de 18e eeuw in gebruik zijn als extracten van vingerhoedskruid.
De werking van de natriumkaliumpomp wordt gereguleerd door een fosfoproteïne fosfolemann, waarvan defosforylering leidt tot remming van de pomp en waarvan fosforylering leidt tot verhoging van de pompactiviteit. Het heeft drie fosforyleringsplaatsen, twee palmitoyleringsplaatsen en een glutathionyleringsplaats, hetgeen de veelheid van signalen verklaart die de pomp kunnen stimuleren en remmen.
De natriumkaliumpomp zelf is een enzym dat is samengesteld uit meerdere subeenheden met meerdere isovormen. De aanwezigheid van de alpha- en beta-subeenheden (hoofdzakelijk B1 in het hart) is essentieel voor de functie. Onlangs is een derde gamma subeenheid geïdentificeerd in de nieren, maar de functie daarvan is tot op heden onbekend.
De alfa subeenheid is de katalytische kern van het natrium-kalium pomp enzym. Hij is ongeveer 100 kDa en bevat de bindingsplaatsen voor natrium, kalium, ATP, en cardiotone steroïden zoals ouabain. Alleen alfa 1 en alfa 2 vertonen een significante aanwezigheid in een normale hartmyocyt en zijn functioneel verbonden met de natriumcalciumwisselaar (NCX). Er is gemeld dat alfa 3 alfa 2 vervangt in experimentele hartinsufficiëntiemodellen.
Gegevens van recente experimenten pleiten voor de betrokkenheid van zowel alfa 1 als alfa 2 subeenheden van de pomp bij de regeling van de excitatie-contractie (E-C) koppeling. De alpha 1, die gelijkmatiger over het sarcolemma verdeeld bleek te zijn, zou meer een “huishoudelijke” rol spelen, en zowel de contractiliteit als de bulk intracellulair natrium controleren, terwijl de alpha 2, waarvan de expressie geconcentreerd is in de T-tubuli samen met andere sleutelcomponenten van de E-C koppeling, zich hoofdzakelijk zou richten op de contractiliteit
Bekende factoren die de natrium-kalium pomp kunnen controleren zijn onder andere: ATP, intracellulair natrium, sub-sarcolemmale barrières en vage ruimten, membraanpotentiaal, intracellulaire signaalwegen (adrenerge signaalwegen, proteïne kinase A & C, stikstofmonoxide, fosfolemman), directe regulatie door kleine moleculen (lipiden, endogene cardiotone steroïden), andere geassocieerde eiwitten (caveolae en caveolines, en ankyrine).
Conclusie
Hyperkaliëmie is een klinische uitdaging en kan zich bij tot 10% van de gehospitaliseerde patiënten voordoen. Het eindresultaat is levensbedreigend. Aangezien alle cellen in het lichaam uiteindelijk door de natrium-kaliumpomp worden beïnvloed, en van ischemische hartspieren bekend is dat zij hun kalium extracellulair extraheren, wat leidt tot een verlaging van de aritmiedrempel met de mogelijkheid van ventriculaire aritmieën die de hypopolarisatie verergeren en de drempel nog meer verlagen, moeten meer studies worden gericht op de manipulatie van het natrium-kaliumenzym, aangezien de controle ervan de resultaten van hartstilstanden gunstig zou kunnen veranderen en de huidige reanimatierichtlijnen zou kunnen herschrijven.