Kern- en valentie-elektronen
Als we op deze manier door het periodiek systeem gaan en de elektronenconfiguraties van steeds grotere atomen noteren, wordt het vervelend om steeds de configuraties van de gevulde binnenste subschillen te kopiëren. In de praktijk vereenvoudigen scheikundigen de notatie door een edelgassymbool tussen haakjes te gebruiken om de configuratie van het edelgas uit de vorige rij weer te geven, omdat alle orbitalen in een edelgas gevuld zijn. Bijvoorbeeld, de 1s2 2s2 2p6 elektronenconfiguratie van neon (Z = 10), dus de elektronenconfiguratie van natrium, met Z = 11, die 1s2 2s2 2p6 3s1, wordt geschreven als 3s1
| Volledige Elektronenconfiguratie | Nobel Gas Shorthand | ||
| Neon | Z = 10 | Ne: 1s2 2s2 2p6 | Ne: 2s2 2p6 |
| Natrium | Z = 11 |
Na: 1s2 2s2 2p6 3s1 |
Na: 3s1 |
Elektronen in gevulde binnenste banen liggen dichter bij de kern en zijn er nauwer aan gebonden, en daarom zijn ze zelden betrokken bij chemische reacties. We zullen deze elektronen kernelektronen noemen. Voor de representatieve elementen (kolommen 1, 2, en 13-18 van het Periodiek Systeem) zijn de kernelektronen alle elektronen met een n-waarde lager dan de maximale n-waarde in de elektronenconfiguratie. Bijvoorbeeld, in het natriumatoom is de hoogste n-waarde 3. De kernelektronen zijn dus die in de atomaire banen met n < 3, namelijk die in de 1s-, 2s- en 2p-banen. Natrium heeft dus 10 kernelektronen. Wij zullen later op deze definitie van kernelektronen terugkomen voor overgangsmetalen.
Dit betekent dat de chemie van een atoom hoofdzakelijk afhangt van de elektronen in zijn buitenste schil, die met de hoogste n-waarde, die de valentie-elektronen worden genoemd. Door de vereenvoudigde notatie kunnen we de valentie-elektronenconfiguratie gemakkelijker zien. Als we deze notatie gebruiken om de elektronenconfiguraties van natrium en lithium te vergelijken, hebben we
| Natrium | 1s2 2s2 2p6 3s1 | 3s1 |
| Lithium | 1s2 2s1 | 2s1 |
Het is gemakkelijk te zien dat zowel natrium als lithium één s-elektron in hun valentieschil hebben. We zouden daarom voorspellen dat natrium en lithium een zeer vergelijkbare chemie hebben, wat inderdaad het geval is.
Naarmate we verder gaan met het bouwen van de acht elementen van periode 3, worden de 3s en 3p orbitalen gevuld, één elektron per keer. Deze rij wordt afgesloten met het edelgas argon, dat de elektronenconfiguratie 3s2 3p6 heeft, wat overeenkomt met een gevulde valentieschil.
Voorbeeld 2.2.2
Teken een banendiagram en gebruik het om de elektronenconfiguratie af te leiden van fosfor, Z = 15. Wat is de valentie-elektronenconfiguratie?
Gegeven: atoomnummer
Vraag: orbitaaldiagram en valentie-elektronenconfiguratie voor fosfor
Strategie:
- Localiseer het edelgas dat in het periodiek systeem het dichtst bij fosfor komt. Trek vervolgens zijn aantal elektronen af van dat van fosfor om het aantal valentie-elektronen van fosfor te verkrijgen.
- Teken, met verwijzing naar figuur 2.1.1, een orbitaaldiagram om deze valentie-elektronen weer te geven. Plaats, volgens de regel van Hund, de valentie-elektronen in de beschikbare banen, te beginnen met de baan met de laagste energie. Noteer de elektronenconfiguratie uit uw banendiagram.
- Negeer de binnenste banen (die overeenkomen met de elektronenconfiguratie van het dichtstbijzijnde edelgas) en schrijf de valentie-elektronenconfiguratie voor fosfor.
Oplossing:
A Omdat fosfor in de derde rij van het periodiek systeem staat, weten we dat het een gesloten schil heeft met 10 elektronen. We beginnen met 10 elektronen af te trekken van de 15 in fosfor.
B De extra vijf elektronen worden geplaatst in de eerstvolgende beschikbare banen, die volgens figuur 2.1.1 vertelt ons dat dit de 3s en 3p orbitalen zijn:
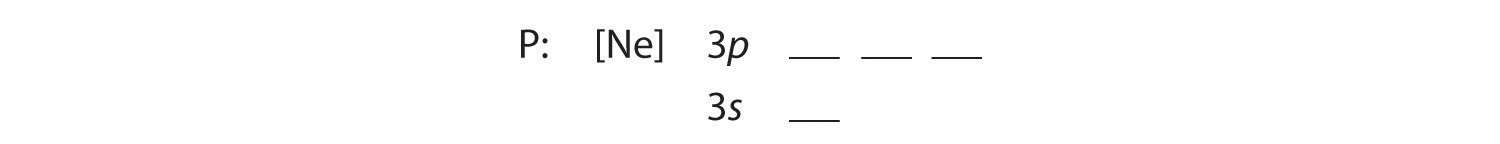
Omdat de 3s orbitaal lager in energie is dan de 3p orbitalen, vullen we deze als eerste:
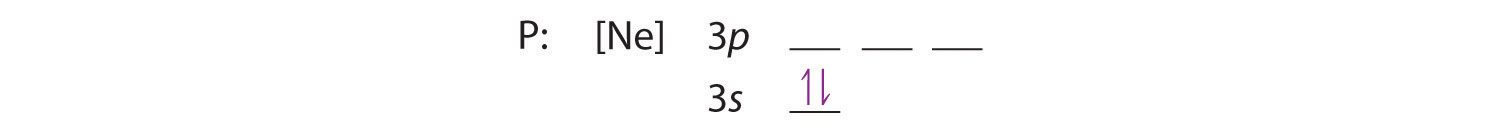
De regel van Hund vertelt ons dat de resterende drie elektronen de ontaarde 3p-banen afzonderlijk zullen bezetten, maar met hun spins uitgelijnd:
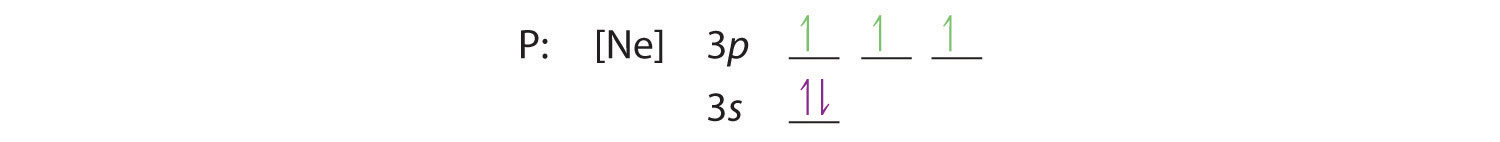
De elektronenconfiguratie is 3s2 3p3.
C We verkrijgen de valentie-elektronenconfiguratie door de binnenste banen te negeren, wat voor fosfor betekent dat we de gesloten schil negeren. Dit geeft een valentie-elektronenconfiguratie van 3s2 3p3.
Oefening 2.2.2
Teken een banendiagram en gebruik het om de elektronenconfiguratie af te leiden van chloor, Z = 17. Wat is de valentie-elektronenconfiguratie?
Antwoord: 3s2 3p5
Valentie-elektronenconfiguratie: 3s23p5
De algemene volgorde waarin de orbitalen worden gevuld, is weergegeven in figuur 2.2.1. De subschillen die overeenkomen met elke waarde van n zijn van links naar rechts geschreven op opeenvolgende horizontale lijnen, waarbij elke rij een rij in het periodiek systeem voorstelt. De volgorde waarin de banen worden gevuld wordt aangegeven door de diagonale lijnen die van rechtsboven naar linksonder lopen. Zo is de 4s-baan eerder gevuld dan de 3d-baan vanwege afschermings- en penetratie-effecten. Dientengevolge is de elektronenconfiguratie van kalium, dat de vierde periode begint, 4s1, en de configuratie van calcium 4s2. Vijf 3d-banen worden gevuld door de volgende 10 elementen, de overgangsmetalen, gevolgd door drie 4p-banen. Merk op dat het laatste lid van deze rij het edelgas krypton (Z = 36) is, Kr: 4s2 3d10 4p6, dat gevulde 4s, 3d en 4p banen heeft. De vijfde rij van het periodiek systeem is in wezen gelijk aan de vierde, behalve dat de 5s-, 4d- en 5p-banen opeenvolgend worden gevuld.
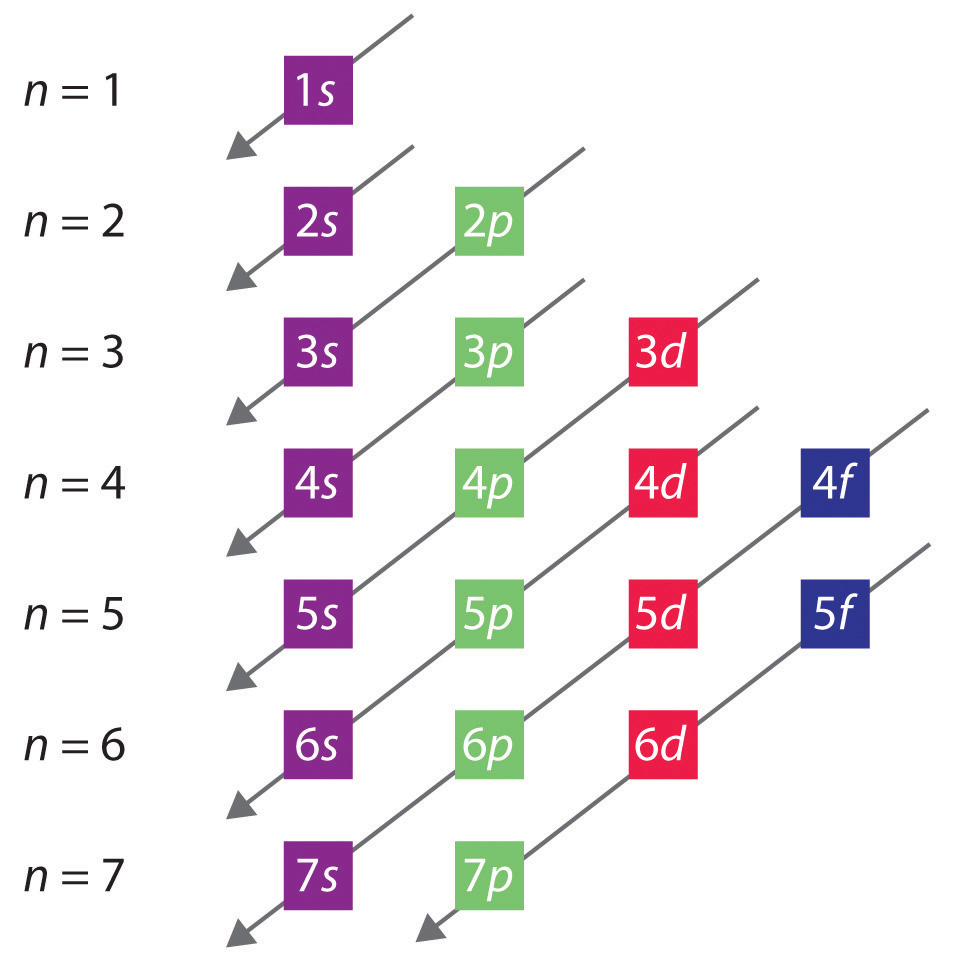
Figuur 2.2.1 Voorspellen van de volgorde waarin de banen in multielectronenatomen worden gevuld. Als u de subschillen voor elke waarde van het hoofdkwantumgetal op opeenvolgende lijnen schrijft, wordt de waargenomen volgorde waarin ze worden gevuld aangegeven door een reeks diagonale lijnen die van rechtsboven naar linksonder lopen.
De zesde rij van het periodiek systeem zal verschillen van de vorige twee omdat de 4f-banen, die 14 elektronen kunnen bevatten, worden gevuld tussen de 6s en de 5d-banen. De elementen die 4f banen in hun valentieschil hebben zijn de lanthaniden. Wanneer de 6p-banen eindelijk gevuld zijn, hebben we het volgende (en laatst bekende) edelgas bereikt, radon (Z = 86), Rn: 6s2 4f14 5d10 6p6. In de laatste rij zijn de 5f-banen opgevuld tussen de 7s en de 6d-banen, wat de 14 actinide-elementen oplevert. Omdat het grote aantal protonen hun kernen instabiel maakt, zijn alle actiniden radioactief.
Voorbeeld 2.2.3
Schrijf de elektronenconfiguratie van kwik (Z = 80), met vermelding van alle binnenste baanvakken.
Gegeven: atoomnummer
Vraag: volledige elektronenconfiguratie
Strategie:
Met behulp van het banendiagram in figuur 2.2.1 en het periodiek systeem als leidraad, vul je de banen totdat alle 80 elektronen geplaatst zijn.
Oplossing:
Door de elektronen in banen te plaatsen volgens de volgorde in figuur 2.2.1 en met behulp van het periodiek systeem als een gids, verkrijgen we
| 1s2 | rij 1 | 2 elektronen |
| 2s22p6 | rij 2 | 8 elektronen |
| 3s23p6 | row 3 | 8 elektronen |
| 4s23d104p6 | rij 4 | 18 elektronen |
| 5s24d105p6 | rij 5 | 18 elektronen |
| rij 1-5 | 54 elektronen |
Na het vullen van de eerste vijf rijen, moeten we nog 80 – 54 = 26 elektronen onderbrengen. Volgens figuur 2.2.2 moeten we de banen 6s (2 elektronen), 4f (14 elektronen), en 5d (10 elektronen) vullen. Het resultaat is de elektronenconfiguratie van kwik:
Hg: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10
Hg: 6s2 4f14 5d10
met een gevulde 5d-dubbelschaal, een 6s2 4f14 5d10 valentieschilconfiguratie, en in totaal 80 elektronen. (Je moet altijd controleren of het totale aantal elektronen gelijk is aan het atoomnummer.)
Oefening 2.2.3
Hoewel element 114 niet stabiel genoeg is om in de natuur voor te komen, werden twee isotopen van element 114 voor het eerst gemaakt in een kernreactor in 1999 door een team van Russische en Amerikaanse wetenschappers. Schrijf de volledige elektronenconfiguratie op voor element 114.
Antwoord: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p2
De elektronenconfiguraties van de elementen zijn weergegeven in figuur 2.2.3, waarin de orbitalen zijn opgesomd in de volgorde waarin ze zijn gevuld. In verscheidene gevallen wijken de elektronenconfiguraties van de grondtoestand af van die welke worden voorspeld in figuur 2.2.1. Sommige van deze afwijkingen treden op wanneer de 3d orbitalen worden gevuld. Bijvoorbeeld, de waargenomen elektronenconfiguratie van de grondtoestand van chroom is 4s1 3d5 in plaats van de voorspelde 4s2 3d4. Evenzo is de waargenomen elektronenconfiguratie van koper 4s1 3d10 in plaats van s2 3d9. De werkelijke elektronenconfiguratie kan worden beredeneerd in termen van een extra stabiliteit die samenhangt met een halfgevulde (ns1, np3, nd5, nf7) of gevulde (ns2, np6, nd10, nf14) subshell. Gezien de kleine verschillen tussen hogere energieniveaus is deze extra stabiliteit voldoende om een elektron van de ene naar de andere orbitaal te verschuiven. In zwaardere elementen kunnen ook andere, complexere effecten van belang zijn, die leiden tot enkele van de in figuur 2.2.3 aangegeven extra anomalieën. Zo heeft cerium bijvoorbeeld een elektronenconfiguratie van 6s2 4f1 5d1, die onmogelijk in eenvoudige termen te rationaliseren is. In de meeste gevallen hebben deze schijnbare afwijkingen echter geen belangrijke chemische gevolgen.
Noot
Extra stabiliteit wordt geassocieerd met halfgevulde of gevulde subschillen.