Dosierung Form: Kapsel
Medizinisch überprüft von Drugs.com. Last updated on Oct 1, 2020.
- Übersicht
- Nebenwirkungen
- Dosierung
- Professional
- Tipps
- Interaktionen
- Mehr
Um die Entwicklung von arzneimittel-resistenten Bakterien zu verringern und die Wirksamkeit von Nitrofurantoin (Makrokristalle) und anderen antibakteriellen Arzneimitteln zu erhalten, sollte Nitrofurantoin (Makrokristalle) nur zur Behandlung oder Vorbeugung von Infektionen verwendet werden, die nachweislich oder mit hoher Wahrscheinlichkeit durch Bakterien verursacht werden.
- BESCHREIBUNG:
- KLINISCHE PHARMAKOLOGIE:
- MIKROBIOLOGIE
- Wirkungsmechanismus
- Interaktionen mit anderen Antibiotika
- Resistenzentwicklung
- INDIKATIONEN UND ANWENDUNG:
- KONTRAINDIKATIONEN:
- Warnhinweise:
- Pulmonale Reaktionen:
- Hepatotoxizität:
- Neuropathie:
- Hämolytische Anämie:
- Clostridium difficile-assoziierte Diarrhö:
- HINWEISE:
- Informationen für Patienten:
- Allgemein:
- Wechselwirkungen mit Arzneimitteln:
- Wechselwirkungen zwischen Arzneimitteln und Labortests:
- Karzinogenität, Mutagenese, Beeinträchtigung der Fruchtbarkeit:
- Schwangerschaft:
- Schwangerschaftskategorie B.
- Labor und Geburt:
- Stillende Mütter:
- Pädiatrische Anwendung:
- Geriatrische Anwendung:
- UNERWÜNSCHTE REAKTIONEN:
- Atemwegsreaktionen:
- Hepatisch:
- Neurologisch:
- Dermatologisch:
- Allergisch:
- Gastrointestinal:
- Hämatologisch:
- Sonstiges:
- Unerwünschte Ereignisse im Labor:
- Überdosierung
- DOSIERUNG UND ANWENDUNG:
- Erwachsene:
- Pädiatrische Patienten:
- VERSORGUNG:
- Hauptanzeigetafel – 50 mg
- Hauptanzeigetafel – 100 mg
- Häufig gestellte Fragen
- Mehr über Nitrofurantoin
- Ressourcen für Verbraucher
- Ressourcen für Fachleute
- Verwandte Behandlungsleitfäden
BESCHREIBUNG:
Nitrofurantoin, USP (Makrokristalle) ist eine synthetische Chemikalie mit kontrollierter Kristallgröße. Es ist eine stabile, gelbe, kristalline Verbindung. Nitrofurantoin, USP (Makrokristalle) ist ein antibakterielles Mittel für bestimmte Harnwegsinfektionen. Es ist in 25 mg, 50 mg und 100 mg Kapseln zur oralen Einnahme erhältlich.
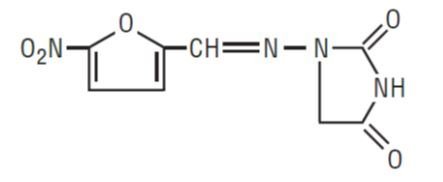
1-AMINO]-2, 4-IMIDAZOLIDINEDIONE
Wirkstoffe: Jede Kapsel enthält D&C Gelb Nr. 10, FD&C Blau Nr. 1, FD&C Blau Nr. 2, FD&C Rot Nr. 40, Gelatine, Eisenoxid schwarz, Lactose wasserfrei, Magnesiumstearat, vorgelatinierte Maisstärke, Natriumlaurylsulfat, Talkum und Titandioxid. Die 50 mg und 100 mg Kapseln enthalten auch FD&C Gelb Nr. 6.
KLINISCHE PHARMAKOLOGIE:
Nitrofurantoin (Makrokristalle) ist eine größere Kristallform von Nitrofurantoin. Im Vergleich zu Nitrofurantoin wird Nitrofurantoin (Makrokristalle) langsamer resorbiert und in geringerem Maße ausgeschieden. Die Blutkonzentrationen bei therapeutischer Dosierung sind in der Regel niedrig. Es ist gut löslich im Urin, dem es eine braune Farbe verleihen kann.
Nach einem Dosierungsschema von 100 mg viermal täglich über 7 Tage betrug die durchschnittliche Wiederfindungsrate des Arzneimittels im Urin (0 bis 24 Stunden) an Tag 1 und Tag 7 37.Tag 37,9 % und 35,0 %.
Im Gegensatz zu vielen anderen Arzneimitteln kann das Vorhandensein von Nahrungsmitteln oder Mitteln, die die Magenentleerung verzögern, die Bioverfügbarkeit von Nitrofurantoin (Makrokristalle) erhöhen, indem es vermutlich eine bessere Auflösung in den Magensäften ermöglicht.
MIKROBIOLOGIE
Nitrofurantoin ist ein antimikrobielles Nitrofuran, das gegen bestimmte grampositive und gramnegative Bakterien wirkt.
Wirkungsmechanismus
Der Mechanismus der antimikrobiellen Wirkung von Nitrofurantoin ist unter den Antibiotika ungewöhnlich. Nitrofurantoin wird von bakteriellen Flavoproteinen zu reaktiven Zwischenprodukten reduziert, die bakterielle ribosomale Proteine und andere Akromoleküle inaktivieren oder verändern. Infolge solcher Inaktivierungen werden die lebenswichtigen biochemischen Prozesse der Proteinsynthese, des aeroben Energiestoffwechsels, der DNA-Synthese, der RNA-Synthese und der Zellwandsynthese gehemmt. Nitrofurantoin ist in therapeutischen Dosen im Urin bakterizid. Der breit angelegte Charakter dieser Wirkungsweise könnte das Fehlen einer erworbenen bakteriellen Resistenz gegen Nitrofurantoin erklären, da die erforderlichen mehrfachen und gleichzeitigen Mutationen der Zielmakromoleküle für die Bakterien wahrscheinlich tödlich wären.
Interaktionen mit anderen Antibiotika
In vitro wurde ein Antagonismus zwischen Nitrofurantoin und antimikrobiellen Chinolonen nachgewiesen. Die klinische Bedeutung dieses Befundes ist nicht bekannt.
Resistenzentwicklung
Die Entwicklung von Resistenzen gegen Nitrofurantoin ist seit seiner Einführung im Jahr 1953 kein nennenswertes Problem gewesen. Eine Kreuzresistenz mit Antibiotika und Sulfonamiden wurde nicht beobachtet, und eine übertragbare Resistenz ist allenfalls ein sehr seltenes Phänomen.
Nitrofurantoin hat sich gegen die meisten Stämme der folgenden Bakterien sowohl in vitro als auch bei klinischen Infektionen als wirksam erwiesen (siehe Indikationen und Anwendung):
Aerobische und fakultative grampositive Mikroorganismen:
Staphylococcus aureus
Enterokokken (z.B.. Enterococcus faecalis)
Aerobische und fakultativ gramnegative Mikroorganismen:
Escherichia coli
Hinweis: Während Nitrofurantoin eine ausgezeichnete Aktivität gegen Enterococcus faecalis aufweist, ist die Mehrheit der Enterococcus faecium-Isolate nicht empfindlich gegenüber Nitrofurantoin.
Mindestens 90 Prozent der folgenden Mikroorganismen weisen eine minimale In-vitro-Hemmkonzentration (MHK) auf, die kleiner oder gleich dem empfindlichen Bruchpunkt für Nitrofurantoin ist. Die Wirksamkeit von Nitrofurantoin bei der Behandlung klinischer Infektionen durch diese Mikroorganismen wurde jedoch nicht in angemessenen und gut kontrollierten Studien nachgewiesen.
Aerobische und fakultative Gram-positive Mikroorganismen:
Koagulase-negative Staphylokokken (einschließlich Staphylococcus
epidermidis und Staphylococcus saprophyticus)
Streptococcus agalactiae
Streptokokken der Gruppe D
Viridans-Gruppe
Aerobische und fakultative Gram-negative Mikroorganismen:
Citrobacter amalonaticus
Citrobacter diversus
Citrobacter freundii
Klebsiella oxytoca
Klebsiella ozaenae
Hinweis: Einige Stämme von Enterobacter-Arten und Klebsiella-Arten sind resistent gegen Nitrofurantoin.
Empfindlichkeitstests:
Spezifische Informationen zu den Kriterien für die Auslegung von Empfindlichkeitstests und den damit verbundenen Testmethoden und Qualitätskontrollstandards, die von der FDA für dieses Arzneimittel anerkannt sind, finden Sie unter: https://www.fda.gov/STIC.
INDIKATIONEN UND ANWENDUNG:
Nitrofurantoin-Kapseln (Makrokristalle) sind speziell für die Behandlung von Harnwegsinfektionen indiziert, wenn diese durch anfällige Stämme von Escherichia coli, Enterokokken, Staphylococcus aureus und bestimmte anfällige Stämme von Klebsiella- und Enterobacter-Arten verursacht werden.
Nitrofurantoin ist nicht indiziert für die Behandlung von Pyelonephritis oder perinephrischen Abszessen.
Um die Entwicklung arzneimittelresistenter Bakterien zu verringern und die Wirksamkeit von Nitrofurantoin-Kapseln (Makrokristalle) und anderen antibakteriellen Arzneimitteln aufrechtzuerhalten, sollten Nitrofurantoin-Kapseln (Makrokristalle) nur zur Behandlung oder Vorbeugung von Infektionen verwendet werden, die nachweislich oder mit hoher Wahrscheinlichkeit durch anfällige Bakterien verursacht werden. Wenn Kultur- und Empfindlichkeitsdaten verfügbar sind, sollten sie bei der Auswahl oder Änderung der antibakteriellen Therapie berücksichtigt werden. In Ermangelung solcher Daten können die lokale Epidemiologie und Empfindlichkeitsmuster zur empirischen Auswahl der Therapie beitragen.
Nitrofurantoine haben nicht die breitere Gewebeverteilung anderer therapeutischer Mittel, die für Harnwegsinfektionen zugelassen sind. Daher sind viele Patienten, die mit Nitrofurantoin-Kapseln (Makrokristalle) behandelt werden, prädisponiert für eine Persistenz oder ein Wiederauftreten einer Bakteriurie. Vor und nach Beendigung der Therapie sollten Urinproben für Kultur- und Empfindlichkeitstests entnommen werden. Wenn nach der Behandlung mit Nitrofurantoin-Kapseln (Makrokristalle) eine Persistenz oder ein Wiederauftreten der Bakteriurie auftritt, sollten andere Therapeutika mit breiterer Gewebeverteilung gewählt werden. Bei der Erwägung des Einsatzes von Nitrofurantoin-Kapseln (Makrokristalle) sollten die niedrigeren Eradikationsraten gegen das erhöhte Potenzial für systemische Toxizität und für die Entwicklung einer antimikrobiellen Resistenz abgewogen werden, wenn Wirkstoffe mit einer breiteren Gewebeverteilung verwendet werden.
KONTRAINDIKATIONEN:
Anurie, Oligurie oder eine erhebliche Beeinträchtigung der Nierenfunktion (Kreatinin-Clearance unter 60 ml pro Minute oder klinisch signifikant erhöhtes Serumkreatinin) sind Kontraindikationen. Die Behandlung dieser Patienten birgt ein erhöhtes Toxizitätsrisiko, da die Ausscheidung des Arzneimittels beeinträchtigt ist. Wegen der Möglichkeit einer hämolytischen Anämie aufgrund unausgereifter Enzymsysteme der Erythrozyten (Glutathioninstabilität) ist das Medikament bei schwangeren Patientinnen im Endstadium (38 bis 42 Schwangerschaftswochen), während der Wehen und der Entbindung oder bei unmittelbar bevorstehenden Wehen kontraindiziert. Aus dem gleichen Grund ist das Arzneimittel bei Neugeborenen unter einem Monat kontraindiziert.
Nitrofurantoin-Kapseln (Makrokristalle) sind kontraindiziert bei Patienten mit cholestatischer Gelbsucht/hepatischer Dysfunktion in Verbindung mit Nitrofurantoin in der Vorgeschichte.
Nitrofurantoin-Kapseln (Makrokristalle) sind auch bei Patienten mit bekannter Überempfindlichkeit gegen Nitrofurantoin kontraindiziert.
Warnhinweise:
Pulmonale Reaktionen:
AKUTE, SUBAKTE ODER CHRONISCHE PULMONARE REAKTIONEN WURDEN BEI MIT NITROFURANTOIN BEHANDELTEN PATIENTEN BEOBACHTET. WENN DIESE REAKTIONEN AUFTRETEN, SOLLTE NITROFURANTOIN (MAKROKRISTALLE) ABGESETZT UND ENTSPRECHENDE MASSNAHMEN ERGRIFFEN WERDEN. IN BERICHTEN WURDEN PULMONALE REAKTIONEN ALS EINE MITWIRKENDE TODESURSACHE GENANNT.
CHRONISCHE PULMONALE REAKTIONEN (DIFFUSE INTERSTITIELLE PNEUMONITIS ODER LUNGENFIBROSE ODER BEIDES) KÖNNEN SICH SCHLEICHEND ENTWICKELN. DIESE REAKTIONEN TRETEN SELTEN UND IM ALLGEMEINEN BEI PATIENTEN AUF, DIE SECHS MONATE ODER LÄNGER BEHANDELT WERDEN. EINE ENGMASCHIGE ÜBERWACHUNG DES PULMONALEN ZUSTANDS VON PATIENTEN, DIE EINE LANGZEITTHERAPIE ERHALTEN, IST GERECHTFERTIGT UND ERFORDERT EINE ABWÄGUNG DES NUTZENS DER THERAPIE GEGEN MÖGLICHE RISIKEN (SIEHE ATEMWEGSREAKTIONEN).
Hepatotoxizität:
Hepatische Reaktionen, einschließlich Hepatitis, cholestatische Gelbsucht, chronisch aktive Hepatitis und Lebernekrose, treten selten auf. Es wurde über Todesfälle berichtet. Der Beginn einer chronisch aktiven Hepatitis kann schleichend sein, und die Patienten sollten regelmäßig auf Veränderungen in biochemischen Tests überwacht werden, die auf eine Leberschädigung hinweisen. Wenn Hepatitis auftritt, sollte das Medikament sofort abgesetzt und geeignete Maßnahmen ergriffen werden.
Neuropathie:
Eine periphere Neuropathie, die schwerwiegend oder irreversibel werden kann, ist aufgetreten. Es wurde über Todesfälle berichtet. Zustände wie Niereninsuffizienz (Kreatinin-Clearance unter 60 ml pro Minute oder klinisch signifikant erhöhtes Serumkreatinin), Anämie, Diabetes mellitus, Elektrolyt-Ungleichgewicht, Vitamin-B-Mangel und schwächende Krankheiten können das Auftreten einer peripheren Neuropathie verstärken. Patienten, die eine Langzeittherapie erhalten, sollten regelmäßig auf Veränderungen der Nierenfunktion überwacht werden.
Optische Neuritis wurde in seltenen Fällen in der Postmarketing-Erfahrung mit Nitrofurantoin-Formulierungen berichtet.
Hämolytische Anämie:
Fälle von hämolytischer Anämie vom Primaquin-Sensitivitätstyp wurden durch Nitrofurantoin ausgelöst. Die Hämolyse scheint mit einem Mangel an Glucose-6-Phosphat-Dehydrogenase in den roten Blutkörperchen der betroffenen Patienten zusammenzuhängen. Dieser Mangel findet sich bei 10 Prozent der Schwarzen und einem kleinen Prozentsatz der ethnischen Gruppen mediterraner und nahöstlicher Herkunft. Die Hämolyse ist eine Indikation für das Absetzen von Nitrofurantoin (Makrokristalle); die Hämolyse hört auf, wenn das Arzneimittel abgesetzt wird.
Clostridium difficile-assoziierte Diarrhö:
Clostridium difficile-assoziierte Diarrhö (CDAD) wurde bei der Anwendung fast aller antibakteriellen Mittel, einschließlich Nitrofurantoin, berichtet und kann in ihrem Schweregrad von leichter Diarrhö bis zu tödlicher Kolitis reichen. Die Behandlung mit antibakteriellen Mitteln verändert die normale Darmflora und führt zu einem übermäßigen Wachstum von C. difficile.
C. difficile produziert die Toxine A und B, die zur Entwicklung von CDAD beitragen. Hypertoxin-produzierende Stämme von C. difficile verursachen eine erhöhte Morbidität und Mortalität, da diese Infektionen gegenüber einer antimikrobiellen Therapie refraktär sein können und eine Kolektomie erfordern können. Eine CDAD muss bei allen Patienten in Betracht gezogen werden, die nach der Einnahme von Antibiotika Durchfall haben. Eine sorgfältige Anamnese ist erforderlich, da CDAD Berichten zufolge über zwei Monate nach der Verabreichung von antibakteriellen Mitteln auftreten kann. Besteht der Verdacht auf CDAD oder hat sich dieser bestätigt, muss die weitere Einnahme von Antibiotika, die nicht gegen C. difficile gerichtet sind, unter Umständen eingestellt werden. Ein angemessenes Flüssigkeits- und Elektrolytmanagement, eine Proteinzufuhr, eine antibiotische Behandlung von C. difficile und eine chirurgische Untersuchung sollten je nach klinischer Indikation eingeleitet werden.
HINWEISE:
Informationen für Patienten:
Die Patienten sollten angewiesen werden, Nitrofurantoin (Makrokristalle) mit Nahrung einzunehmen, um die Verträglichkeit weiter zu erhöhen und die Arzneimittelabsorption zu verbessern. Die Patienten sollten angewiesen werden, die Therapie vollständig durchzuführen; sie sollten jedoch darauf hingewiesen werden, ihren Arzt zu kontaktieren, wenn während der Therapie ungewöhnliche Symptome auftreten.
Viele Patienten, die mikrokristallines Nitrofurantoin nicht vertragen, können Nitrofurantoin (Makrokristalle) ohne Übelkeit einnehmen.
Patienten sollten darauf hingewiesen werden, dass sie während der Einnahme von Nitrofurantoin (Makrokristalle) keine säurehemmenden Präparate verwenden sollten, die Magnesiumtrisilikat enthalten.
Patienten sollten darauf hingewiesen werden, dass antibakterielle Arzneimittel, einschließlich Nitrofurantoin (Makrokristalle), nur zur Behandlung bakterieller Infektionen verwendet werden sollten. Sie sind nicht zur Behandlung von Virusinfektionen (z. B. Erkältung) geeignet. Wenn Nitrofurantoin (Makrokristalle) zur Behandlung einer bakteriellen Infektion verschrieben wird, sollten die Patientinnen und Patienten darauf hingewiesen werden, dass es zwar üblich ist, sich zu Beginn der Therapie besser zu fühlen, das Medikament aber genau nach Anweisung eingenommen werden muss. Das Auslassen von Dosen oder die nicht vollständige Beendigung der Therapie kann (1) die Wirksamkeit der unmittelbaren Behandlung verringern und (2) die Wahrscheinlichkeit erhöhen, dass Bakterien eine Resistenz entwickeln und in Zukunft nicht mehr mit Nitrofurantoin (Makrokristalle) oder anderen antibakteriellen Arzneimitteln behandelt werden können.
Durchfall ist ein häufiges Problem, das durch Antibiotika verursacht wird und in der Regel endet, wenn das Antibiotikum abgesetzt wird. Manchmal können Patienten nach Beginn einer Antibiotikabehandlung wässrige und blutige Stühle (mit oder ohne Magenkrämpfe und Fieber) auch noch zwei oder mehr Monate nach Einnahme der letzten Dosis des Antibiotikums entwickeln. Wenn dies auftritt, sollten die Patienten so bald wie möglich ihren Arzt kontaktieren.
Allgemein:
Die Verschreibung von Nitrofurantoin (Makrokristalle) bei Fehlen einer nachgewiesenen oder stark vermuteten bakteriellen Infektion oder einer prophylaktischen Indikation ist wahrscheinlich nicht von Nutzen für den Patienten und erhöht das Risiko der Entwicklung arzneimittelresistenter Bakterien.
Wechselwirkungen mit Arzneimitteln:
Magnesiumtrisilikat-haltige Antazida verringern bei gleichzeitiger Verabreichung mit Nitrofurantoin sowohl die Geschwindigkeit als auch das Ausmaß der Resorption. Der Mechanismus für diese Wechselwirkung ist wahrscheinlich die Adsorption von Nitrofurantoin an die Oberfläche von Magnesiumtrisilikat.
Uricosurische Arzneimittel, wie Probenecid und Sulfinpyrazon, können die renale tubuläre Sekretion von Nitrofurantoin hemmen. Der daraus resultierende Anstieg der Nitrofurantoin-Serumspiegel kann die Toxizität erhöhen, und die verringerten Urinspiegel könnten seine Wirksamkeit als antibakterielles Mittel gegen Harnwegserkrankungen verringern.
Wechselwirkungen zwischen Arzneimitteln und Labortests:
Als Folge des Vorhandenseins von Nitrofurantoin kann eine falsch-positive Reaktion auf Glukose im Urin auftreten. Dies wurde mit Benedict’s und Fehling’s Lösungen beobachtet, nicht aber mit dem enzymatischen Glucosetest.
Karzinogenität, Mutagenese, Beeinträchtigung der Fruchtbarkeit:
Nitrofurantoin war nicht karzinogen, wenn es an weibliche Holtzman-Ratten über 44,5 Wochen oder an weibliche Sprague-Dawley-Ratten über 75 Wochen verfüttert wurde. Zwei chronische Nagetier-Bioassays mit männlichen und weiblichen Sprague-Dawley-Ratten und zwei chronische Bioassays mit Schweizer Mäusen und BDF1-Mäusen ergaben keine Hinweise auf Karzinogenität.
Nitrofurantoin zeigte Hinweise auf eine karzinogene Aktivität bei weiblichen B6C3F1-Mäusen, was sich in einer erhöhten Inzidenz von tubulären Adenomen, gutartigen gemischten Tumoren und Granulosazelltumoren des Ovars zeigte. Bei männlichen F344/N-Ratten traten vermehrt seltene tubuläre Nierenzellneubildungen, Osteosarkome des Knochens und Neubildungen des Unterhautgewebes auf. In einer Studie, in der trächtigen weiblichen Mäusen 75 mg/kg Nitrofurantoin subkutan verabreicht wurde, wurden in der F1-Generation papilläre Adenome der Lunge von unbekannter Bedeutung beobachtet.
Nitrofurantoin induziert nachweislich Punktmutationen in bestimmten Stämmen von Salmonella typhimurium und Vorwärtsmutationen in L5178Y-Lymphomzellen der Maus. Nitrofurantoin induzierte eine erhöhte Anzahl von Schwesterchromatidaustauschen und Chromosomenaberrationen in Ovarialzellen des chinesischen Hamsters, jedoch nicht in menschlichen Zellen in Kultur. Die Ergebnisse des geschlechtsgebundenen rezessiven Letalitätstests bei Drosophila waren nach Verabreichung von Nitrofurantoin durch Fütterung oder Injektion negativ. Nitrofurantoin löste in den untersuchten Nagetiermodellen keine vererbbaren Mutationen aus.
Die Bedeutung der Befunde zur Karzinogenität und Mutagenität in Bezug auf die therapeutische Anwendung von Nitrofurantoin beim Menschen ist nicht bekannt.
Die Verabreichung hoher Nitrofurantoin-Dosen an Ratten führt zu einem vorübergehenden Spermatogenitätsstillstand; dieser ist nach Absetzen des Arzneimittels reversibel. Dosen von 10 mg/kg/Tag oder mehr können bei gesunden menschlichen Männern in bestimmten, nicht vorhersehbaren Fällen einen leichten bis mäßigen Spermatogenitätsstillstand mit einer Abnahme der Spermienzahl verursachen.
Schwangerschaft:
Teratogene Wirkungen:
Schwangerschaftskategorie B.
Es wurden mehrere Reproduktionsstudien an Kaninchen und Ratten mit Dosen bis zum Sechsfachen der menschlichen Dosis durchgeführt, die keine Hinweise auf eine Beeinträchtigung der Fruchtbarkeit oder Schädigung des Fötus durch Nitrofurantoin ergaben. In einer einzigen veröffentlichten Studie an Mäusen, die mit dem 68-fachen der Humandosis (auf der Grundlage der dem Muttertier verabreichten mg/kg) durchgeführt wurde, wurden Wachstumsverzögerungen und ein geringes Auftreten kleinerer und allgemeiner Missbildungen beobachtet. Beim 25-fachen der menschlichen Dosis wurden jedoch keine fötalen Missbildungen beobachtet; die Relevanz dieser Ergebnisse für den Menschen ist ungewiss. Es gibt jedoch keine angemessenen und gut kontrollierten Studien an schwangeren Frauen. Da Reproduktionsstudien an Tieren nicht immer auf die Reaktion beim Menschen schließen lassen, sollte dieses Arzneimittel während der Schwangerschaft nur bei eindeutigem Bedarf angewendet werden.
Nicht-teratogene Wirkungen:
Nitrofurantoin hat in einer veröffentlichten Studie zur transplazentaren Karzinogenität gezeigt, dass es bei Mäusen der F1-Generation bei Dosen, die dem 19-fachen der menschlichen Dosis auf mg/kg-Basis entsprechen, Lungenpapillenadenome hervorruft. Der Zusammenhang zwischen diesem Ergebnis und einer möglichen Karzinogenese beim Menschen ist derzeit nicht bekannt. Wegen der Ungewissheit über die Auswirkungen dieser Tierdaten auf den Menschen sollte dieses Arzneimittel während der Schwangerschaft nur bei eindeutigem Bedarf angewendet werden.
Labor und Geburt:
Siehe KONTRAINDIKATIONEN.
Stillende Mütter:
Nitrofurantoin wurde in Spuren in der menschlichen Muttermilch nachgewiesen. Wegen des Potenzials für schwerwiegende unerwünschte Wirkungen von Nitrofurantoin bei stillenden Säuglingen unter einem Monat sollte unter Berücksichtigung der Bedeutung des Arzneimittels für die Mutter entschieden werden, ob das Stillen unterbrochen oder das Arzneimittel abgesetzt werden soll (siehe KONTRAINDIKATIONEN).
Pädiatrische Anwendung:
Nitrofurantoin (Makrokristalle) ist bei Säuglingen unter einem Monat kontraindiziert (siehe KONTRAINDIKATIONEN).
Geriatrische Anwendung:
Klinische Studien zu Nitrofurantoin (Makrokristalle) schlossen nicht genügend Probanden im Alter von 65 Jahren und darüber ein, um festzustellen, ob sie anders reagieren als jüngere Probanden. In anderen Berichten über klinische Erfahrungen wurden keine Unterschiede im Ansprechen zwischen älteren und jüngeren Patienten festgestellt. Spontanberichte deuten auf einen höheren Anteil an pulmonalen Reaktionen, einschließlich Todesfällen, bei älteren Patienten hin; diese Unterschiede scheinen mit dem höheren Anteil älterer Patienten zusammenzuhängen, die eine Langzeittherapie mit Nitrofurantoin erhalten. Wie bei jüngeren Patienten werden chronische Lungenreaktionen im Allgemeinen bei Patienten beobachtet, die eine Therapie über sechs Monate oder länger erhalten (siehe WARNHINWEISE). Spontane Berichte deuten auch auf einen erhöhten Anteil an schweren Leberreaktionen, einschließlich Todesfällen, bei älteren Patienten hin (siehe WARNHINWEISE).
Im Allgemeinen sollte bei der Verschreibung von Nitrofurantoin (Makrokristalle) die größere Häufigkeit von eingeschränkter Leber-, Nieren- oder Herzfunktion sowie von Begleiterkrankungen oder anderer medikamentöser Therapie berücksichtigt werden. Es ist bekannt, dass dieses Medikament im Wesentlichen über die Nieren ausgeschieden wird, und das Risiko toxischer Reaktionen auf dieses Medikament kann bei Patienten mit eingeschränkter Nierenfunktion größer sein. Anurie, Oligurie oder eine erhebliche Beeinträchtigung der Nierenfunktion (Kreatinin-Clearance unter 60 ml pro Minute oder klinisch signifikant erhöhtes Serumkreatinin) sind Kontraindikationen (siehe KONTRAINDIKATIONEN). Da bei älteren Patienten die Wahrscheinlichkeit einer eingeschränkten Nierenfunktion größer ist, sollte die Dosis mit Vorsicht gewählt werden, und es kann sinnvoll sein, die Nierenfunktion zu überwachen.
UNERWÜNSCHTE REAKTIONEN:
Atemwegsreaktionen:
CHRONISCHE, SUBAKUTE ODER AKTE PULMONARE HYPERSENSITIVITÄTSREAKTIONEN KÖNNEN AUFTRETEN.
CHRONISCHE PULMONARE REAKTIONEN KOMMEN ALLGEMEIN BEI PATIENTEN VOR, DIE SECHS MONATE ODER LÄNGER KONTINUIERLICH BEHANDELT WURDEN. UNWOHLSEIN, DYSPNOE BEI ANSTRENGUNG, HUSTEN UND EINE VERÄNDERTE LUNGENFUNKTION SIND HÄUFIGE ERSCHEINUNGEN, DIE SCHLEICHEND AUFTRETEN KÖNNEN. RADIOLOGISCHE UND HISTOLOGISCHE BEFUNDE EINER DIFFUSEN INTERSTITIELLEN PNEUMONITIS ODER FIBROSE ODER BEIDES SIND EBENFALLS HÄUFIGE MANIFESTATIONEN DER CHRONISCHEN PULMONALEN REAKTION. FIEBER TRITT SELTEN AUF.
DER SCHWEREGRAD DER CHRONISCHEN PULMONALEN REAKTION UND IHR ABKLINGEN SCHEINEN MIT DER DAUER DER THERAPIE NACH DEM AUFTRETEN DER ERSTEN KLINISCHEN ANZEICHEN ZUSAMMENZUHÄNGEN. DIE LUNGENFUNKTION KANN DAUERHAFT BEEINTRÄCHTIGT SEIN, AUCH NACH BEENDIGUNG DER THERAPIE. DAS RISIKO IST GRÖSSER, WENN CHRONISCHE PULMONARE REAKTIONEN NICHT FRÜHZEITIG ERKANNT WERDEN.
Bei subakuten pulmonalen Reaktionen treten Fieber und Eosinophilie seltener auf als bei der akuten Form. Nach Beendigung der Therapie kann die Erholung mehrere Monate dauern. Wenn die Symptome nicht als arzneimittelbedingt erkannt werden und die Nitrofurantoin-Therapie nicht abgesetzt wird, können sich die Symptome verschlimmern.
Akute pulmonale Reaktionen äußern sich in der Regel durch Fieber, Schüttelfrost, Husten, Brustschmerzen, Dyspnoe, Lungeninfiltration mit Konsolidierung oder Pleuraerguss im Röntgenbild und Eosinophilie. Akute Reaktionen treten in der Regel innerhalb der ersten Woche der Behandlung auf und sind nach Absetzen der Therapie reversibel. Die Auflösung ist oft dramatisch (siehe WARNHINWEISE).
Veränderungen im EKG (z.B., unspezifische ST/T-Wellenveränderungen, Schenkelblock) wurden in Verbindung mit pulmonalen Reaktionen berichtet.
Selten wurde über Zyanose berichtet.
Hepatisch:
Hepatische Reaktionen, einschließlich Hepatitis, cholestatische Gelbsucht, chronisch aktive Hepatitis und Lebernekrose, treten selten auf (siehe WARNHINWEISE).
Neurologisch:
Periphere Neuropathie, die schwerwiegend oder irreversibel werden kann, ist aufgetreten. Es wurde über Todesfälle berichtet. Zustände wie Niereninsuffizienz (Kreatinin-Clearance unter 60 ml pro Minute oder klinisch signifikant erhöhtes Serumkreatinin), Anämie, Diabetes mellitus, Elektrolyt-Ungleichgewicht, Vitamin-B-Mangel und schwächende Krankheiten können die Wahrscheinlichkeit einer peripheren Neuropathie erhöhen (siehe WARNHINWEISE).
Asthenie, Schwindel, Nystagmus, Schwindel, Kopfschmerzen und Schläfrigkeit wurden ebenfalls im Zusammenhang mit der Anwendung von Nitrofurantoin berichtet.
Selten wurde über eine gutartige intrakranielle Hypertension (Pseudotumor cerebri), Verwirrung, Depression, Sehnervenentzündung und psychotische Reaktionen berichtet. Selten wurde über vorgewölbte Fontanellen als Zeichen einer benignen intrakraniellen Hypertension bei Säuglingen berichtet.
Dermatologisch:
Selten wurde über exfoliative Dermatitis und Erythema multiforme (einschließlich Stevens-Johnson-Syndrom) berichtet. Es wurde auch über vorübergehende Alopezie berichtet.
Allergisch:
Ein lupusähnliches Syndrom in Verbindung mit pulmonalen Reaktionen auf Nitrofurantoin wurde berichtet. Außerdem wurde über Angioödeme, makulopapulöse, erythematöse oder ekzematöse Eruptionen, Juckreiz, Urtikaria, Anaphylaxie, Arthralgie, Myalgie, Arzneimittelfieber, Schüttelfrost und Vaskulitis (manchmal in Verbindung mit pulmonalen Reaktionen) berichtet. Überempfindlichkeitsreaktionen stellen die häufigsten spontan gemeldeten unerwünschten Ereignisse in der weltweiten Postmarketing-Erfahrung mit Nitrofurantoin-Formulierungen dar.
Gastrointestinal:
Übelkeit, Erbrechen und Anorexie treten am häufigsten auf. Bauchschmerzen und Durchfall sind weniger häufige gastrointestinale Reaktionen. Diese dosisabhängigen Reaktionen können durch eine Verringerung der Dosis minimiert werden. Es wurde über Sialadenitis und Pankreatitis berichtet. Es gibt vereinzelte Berichte über pseudomembranöse Kolitis bei der Anwendung von Nitrofurantoin. Das Auftreten von Symptomen einer pseudomembranösen Kolitis kann während oder nach der antimikrobiellen Behandlung auftreten (siehe WARNHINWEISE).
Hämatologisch:
Selten wurde über Zyanose als Folge einer Methämoglobinämie berichtet.
Sonstiges:
Wie bei anderen antimikrobiellen Mitteln können Superinfektionen durch resistente Organismen, z.B., Pseudomonas-Arten oder Candida-Arten, auftreten können.
Unerwünschte Ereignisse im Labor:
Die folgenden unerwünschten Ereignisse im Labor wurden im Zusammenhang mit der Anwendung von Nitrofurantoin berichtet: Erhöhte AST (SGOT), erhöhte ALT (SGPT), vermindertes Hämoglobin, erhöhter Serumphosphor, Eosinophilie, Glucose-6-Phosphat-Dehydrogenase-Mangelanämie (siehe WARNHINWEISE), Agranulozytose, Leukopenie, Granulozytopenie, hämolytische Anämie, Thrombozytopenie, megaloblastische Anämie. In den meisten Fällen bildeten sich diese hämatologischen Anomalien nach Absetzen der Therapie zurück. Selten wurde über eine aplastische Anämie berichtet.
Überdosierung
Gelegentliche Fälle von akuter Überdosierung von Nitrofurantoin (Makrokristalle) haben außer Erbrechen zu keinen besonderen Symptomen geführt. Es wird empfohlen, Erbrechen herbeizuführen. Es gibt kein spezifisches Antidot, aber eine hohe Flüssigkeitszufuhr sollte beibehalten werden, um die Ausscheidung des Arzneimittels über den Urin zu fördern. Es ist dialysierbar.
DOSIERUNG UND ANWENDUNG:
Nitrofurantoin-Kapseln (Makrokristalle) sollten mit der Nahrung verabreicht werden, um die Absorption des Medikaments und, bei einigen Patienten, die Verträglichkeit zu verbessern.
Erwachsene:
50 mg bis 100 mg viermal täglich – die niedrigere Dosierungsstufe wird für unkomplizierte Harnwegsinfektionen empfohlen.
Pädiatrische Patienten:
5 bis 7 mg/kg Körpergewicht pro 24 Stunden, verabreicht in vier geteilten Dosen (kontraindiziert unter einem Monat).
Die Therapie sollte für eine Woche oder für mindestens 3 Tage fortgesetzt werden, nachdem die Sterilität des Urins erreicht ist. Eine fortgesetzte Infektion weist auf die Notwendigkeit einer Neubewertung hin.
Für eine Langzeit-Suppressionstherapie bei Erwachsenen kann eine Reduzierung der Dosis auf 50-100 mg vor dem Schlafengehen angemessen sein. Für eine Langzeit-Suppressionstherapie bei pädiatrischen Patienten können Dosen bis zu 1 mg/kg pro 24 Stunden, verabreicht in einer Einzeldosis oder in zwei geteilten Dosen, angemessen sein. SIEHE ABSCHNITT WARNHINWEISE ZU RISIKEN BEI LANGFRISTIGER THERAPIE.
VERSORGUNG:
Nitrofurantoin-Kapseln USP (Makrokristalle) sind wie folgt erhältlich:
50 mg undurchsichtiger, weißer Körper und undurchsichtige, gelbe Kappe mit schwarzem Aufdruck „WATSON“ auf der Kappe und „5780“ auf dem Körper.
NDC 0115-2023-10 Flaschen zu 100
100 mg undurchsichtige, gelbe Kapsel mit dem Aufdruck „WATSON“ in schwarzer Tinte auf der Kappe und „5781“ auf dem Körper.
NDC 0115-2024-10 Flaschen zu 100
Behalten bei 20° bis 25°C (68° bis 77°F) .
Hergestellt von:
Watson Pharma Private Limited
Verna, Salcette Goa 403722 INDIA
Vertrieben von:
Amneal Pharmaceuticals LLC
Bridgewater, NJ 08807
Um VERMUTETE NEBENWIRKUNGEN zu melden, wenden Sie sich an Amneal Pharmaceuticals unter 1-877-835-5472 oder an die FDA unter 1-800-FDA-1088 oder www.fda.gov/medwatch.
Rev. 11-2019-00
Hauptanzeigetafel – 50 mg

Hauptanzeigetafel – 100 mg

| NITROFURANTOIN Nitrofurantoin Kapsel |
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
| NITROFURANTOIN Nitrofurantoin Kapsel |
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
Labeler -. Amneal Pharmaceuticals of New York LLC (123797875)
Häufig gestellte Fragen
- Welche Antibiotika werden zur Behandlung von Harnwegsinfektionen eingesetzt?
- Was ist Nitrofurantoin mit doppelter Wirkstofffreisetzung?
Mehr über Nitrofurantoin
- Nebenwirkungen
- Während der Schwangerschaft oder Stillzeit
- Dosierungshinweise
- Patiententipps
- Medikament Bilder
- Wechselwirkungen
- Alternativen vergleichen
- Selbsthilfegruppe
- Preise&Gutscheine
- En Español
- 1538 Bewertungen
- Medikamentenklasse: Urin-antiInfektiöse Mittel
Ressourcen für Verbraucher
- Patienteninformationen
- Nitrofurantoin (Erweiterte Lektüre)
Ressourcen für Fachleute
- Rezeptpflicht Informationen
- Nitrofurantoin (Professionelle Patientenberatung)
- Nitrofurantoin Kapseln (FDA)
- Nitrofurantoin Mundsuspension (FDA)
Andere Marken Macrobid, Macrodantin, Furadantin
Verwandte Behandlungsleitfäden
- Harnwegsinfektion
- Vorbeugung von Blaseninfektionen
- Blaseninfektion
Medizinischer Haftungsausschluss