Inhalt
- 1 Funktion
- 2 Humane Lactat-Dehydrogenase
- 2.1 Struktur
- 2.2 Katalyse
- 2.3 Kinetik
- 2.4 Regulation
- 3 3D-Strukturen der Laktatdehydrogenase
Funktion
L-Laktatdehydrogenase (L-LDH) katalysiert die Umwandlung von Pyruvat und NADH+ zu L-Laktat und NAD+.
H-Lactat-Dehydrogenase (H-LDH) katalysiert die Umwandlung von D-Lactat und Ferricytochrom c zu Pyruvat und Ferrocytochrom c.
Lactat-Dehydrogenase (LDH) ist ein wichtiges Enzym des Menschen. Es kommt in verschiedenen Regionen des Körpers vor, wobei jede Region eine einzigartige Konformation der verschiedenen Untereinheiten aufweist. LDH ist ein Schlüsselenzym der anaeroben Atmung. Die anaerobe Atmung erfolgt in Abwesenheit von Sauerstoff. Dieser Stoffwechselweg ist für die Glykolyse in zweierlei Hinsicht wichtig. Erstens würde sich die Glykolyse verlangsamen, wenn sich Pyruvat ansammeln würde, und damit auch die ATP-Bildung. Zum anderen ermöglicht die anaerobe Atmung die Regeneration von NAD+ aus NADH. NAD+ wird benötigt, wenn die Glyceraldehyd-3-phosphat-Dehydrogenase Glyceraldehyd-3-phosphat in der Glykolyse oxidiert, wodurch NADH entsteht. Lactat-Dehydrogenase ist für die anaerobe Umwandlung von NADH in NAD+ verantwortlich. in der Lactat-Dehydrogenase von Cryptosporidium parvum (4nd4).
Die menschliche Laktat-Dehydrogenase
Struktur
ist ein quaternäres Protein, das aus der Kombination von zwei Untereinheiten, M und H (Muskel und Herz), zu einer Struktur von vier Untereinheiten gebildet wird. Die verschiedenen Kombinationen, die im menschlichen Körper vorkommen, sind:
- (4H) Herz
- (3H1M) Retikuloendothelial
- (2H2M) Lunge
- (1H3M) Niere
- (4M) Muskel und Leber
Das hier gezeigte LDH besteht zu 40% aus Alpha-Helices und zu 23% aus Beta-Sheets. Die SCOP-Daten klassifizieren diese Form der Laktatdehydrogenase als gemischtes Beta-Alpha-Beta, mit hauptsächlich parallelen Beta-Folien.
Siehe auch
- Humane Lactat-Dehydrogenase
- Jasper Lactate Final
- Rossmann-Faltung.
Katalyse
Studien haben gezeigt, dass der Reaktionsmechanismus der LDH einer geordneten Abfolge folgt.
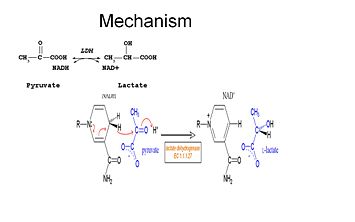
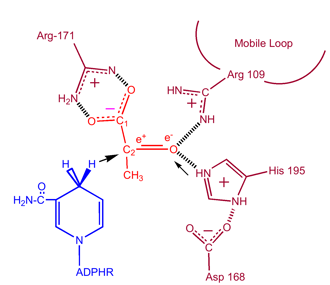
Damit Laktat oxidiert werden kann, muss zuerst NADH an das Enzym binden, gefolgt von Laktat. . Sobald das NADH an das Enzym gebunden ist, kann Laktat gebunden werden (das Substrat Oxamat ist abgebildet; die -CH3-Gruppe wird durch -NH2 ersetzt und bildet Oxamat). Laktat bindet sich an das Enzym zwischen dem Nicotinamidring und mehreren LDH-Resten. Der Transfer eines Hydrid-Ions erfolgt dann schnell in beide Richtungen, so dass eine Mischung der beiden tertiären Komplexe Enzym-NAD+-Lactat und Enzym-NADH-Pyruvat entsteht. Schließlich dissoziiert Pyruvat vom Enzym, gefolgt von NAD+.
Kinetik
Kinetische Untersuchungen der Laktatdehydrogenase mit Oxalat und Oxamat (strukturelle Analoga von Laktat und Pyruvat) haben den oben beschriebenen Mechanismus bestätigt. Der geschwindigkeitsbeschränkende Schritt bei dieser Reaktion ist die Dissoziationsrate von NAD+ und NADH. Die Umwandlung von Pyruvat in Laktat mit anschließender Regeneration von NAD+ ist sehr günstig.
Regulation
Da es sich um einen Gleichgewichtsmechanismus handelt, scheint es keine speziell für die Laktatdehydrogenase konzipierte Regulation zu geben, sondern sie ist abhängig von der Aktivierung der anaeroben Reparation und dem Vorhandensein von Pyruvat und NADH bzw. Laktat und NAD+.
3D-Strukturen der Laktatdehydrogenase
Laktatdehydrogenase 3D-Strukturen
