Ein Forschungsprogramm wurde durchgeführt, um die Verarbeitungstechnologie zur Gewinnung von Aluminiumoxid aus Nicht-Bauxit zu verbessern. Der Erfolg dieses Programms lieferte die Technologie, die für eine ausreichende Versorgung mit hochwertigem Aluminiumoxid aus einheimischen Quellen erforderlich ist, um die nationalen wirtschaftlichen und strategischen Bedürfnisse in Bezug auf die Aluminiumproduktion zu erfüllen. Das Salzsäureverfahren zur Gewinnung von Aluminiumoxid aus minderwertigen Erzen ist eines der Verfahren, die im Rahmen des Forschungsprogramms untersucht werden.
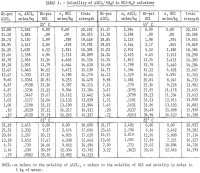
Eine Phase dieses Verfahrens nutzt die Wirkung der Chloridionenkonzentration auf die Löslichkeit von Aluminiumionen in Lösung. Bei 25° C beträgt die Löslichkeit von AlCl3 in reinem Wasser etwa 31 Gewichtsprozent und nimmt mit zunehmender Konzentration von Salzsäure (HCl) auf 0,1 Gewichtsprozent ab, wenn die HCl-Konzentration auf 37 Gewichtsprozent erhöht wird. Dieses Verhalten war bereits Gegenstand zahlreicher Untersuchungen, Verfahren und Patente. So ist es möglich, ein nicht-bauxitisches Erz mit HCl zu laugen, die Lauge zu dekantieren und zu filtern und gasförmiges HCl hinzuzufügen, um AlCl3-6H2O auszufällen. Die verbleibende saure Lösung kann dann zur Auslaugung weiterer Erze verwendet werden, und das ausgefällte AlCl3-6H2O kann kalziniert werden, um Al2O3 zu erhalten. Eine ausführliche Diskussion und Bewertung dieses Verfahrens wird von Peters, Johnson und Kirby vorgelegt. Thermodynamische Daten, wie z. B. die Ionenaktivitäten und die Löslichkeiten, die für eine vollständige Analyse, Interpretation und Verbesserung dieses Prozesses erforderlich sind, sind kaum vorhanden, und die vorhandenen Löslichkeitsdaten sind auf einen engen Temperaturbereich beschränkt. Daher waren die Ziele dieser Untersuchung (1) die Bestimmung der Löslichkeit von AlCl3 in einem Temperaturbereich von 25° bis 85° C mit einer HCl-Konzentration von 0,0 bis 37.2 pct; (2) die Berechnung der Aktivitäten von AlCl3 und H2O in Lösungen, die verschiedene Elektrolyte enthalten, und der Gleichgewichtskonstante für die Auflösung von AlCl3-6H2O; und (3) Vorschläge für Forschungsbereiche zur Gewinnung nützlicher Daten.
- Apparatur
- Experimentelles Verfahren
- Analyse
- Ergebnisse
- Vergleich mit anderen Daten
- Thermodynamische Behandlung
- Löslichkeitsprodukt und Aktivitäten im System AlCl3-6H2O-H2O
- Schätzung der Aktivitäten im System AlCl3-6H2O-H2O
- Löslichkeitsprodukt und Aktivitäten im System AlCl3-6H2O-HCl-H2O
- Schätzung der Aktivitäten im System AlCl3-6H2O-HCl-H2O
- AlCl3-FeCl3-KCl-NaCl-HCl-H2O System
- Forschungsempfehlungen
- Aluminiumchlorid in wässrigen Salzsäurelösungen
Apparatur
Die für die Löslichkeitsmessungen verwendete Apparatur ist in Abbildung 1 dargestellt. Ein 100-ml-Kolben, A, enthält eine Elektrolytlösung und etwas überschüssiges Salz. Ein Glasfrittefilter (B), der auf ein 6 mm-OD-Pyrexrohr aufgeschmolzen ist, ist mit einem Außenrohr verbunden, das an zwei Teflonhähnen (D und E) befestigt ist. Die obere Einheit ist an A bei C durch eine Nylon-Kompressionsverschraubung mit einem Neoprenring befestigt. Ein 6-mm-OD-Polyethylenrohr, F-L, liefert eine Probe der bei B gefilterten Lösung in den zweiten Kolben, K, wenn A durch den Absperrhahn D unter Druck gesetzt und E geöffnet wird. Die Kolben werden auf eine Stange G aufgespannt, die an einem Schaukelmechanismus mit H als Schaukelachse befestigt ist, mit dem die Kolben A und K abwechselnd auf und ab geschüttelt werden. Ein abgedeckter Thermostat, 0, wird mit einer Genauigkeit von ±0,2° C geregelt. Eine genauere Temperaturkontrolle ist nicht erforderlich, da die Löslichkeit eine sehr schwache Funktion der Temperatur ist.
Experimentelles Verfahren
Messungen der Löslichkeiten bei 25°, 45°, 65° und 85° C wurden unter Phasengleichgewichtsbedingungen mit analytischen Reagenzien durchgeführt. Entsprechende Mengen von AlCl3-6H2O, 37-prozentiger HCl-Lösung und destilliertem Wasser wurden in Kolben A gegeben, um eine Lösung von etwa 90 ml mit einer kleinen Menge überschüssiger Salzkristalle zu erhalten (im Folgenden bezieht sich „Salz“ auf Aluminiumchloridhexahydrat). Die Mengen der Materialien wurden anhand der vorhandenen Löslichkeitsdaten für das ternäre System AlCl3-6H2O-HCl-H2O geschätzt. Nachdem sich die Lösung im Kolben A gebildet hatte und die Apparatur zusammengebaut war, wurde sie bis zum Niveau N in das Wasser eingetaucht und der Thermostat auf die gewünschte Temperatur eingestellt. Die Kolben wurden bei jedem Durchlauf, der 2 bis 3 Tage dauerte, kontinuierlich mechanisch geschüttelt. Von Zeit zu Zeit wurde auch kräftig von Hand geschüttelt, um das Gleichgewicht sicherzustellen, insbesondere wenn das Salz mit HCl ein komplexes festes Salz bilden konnte. Am Ende des Gleichgewichtszeitraums wurden die Kolben eine Stunde lang in aufrechter Position stillstehen gelassen, um das Absetzen der festen Teilchen zu gewährleisten. Anschließend wurden die Absperrhähne D und E geöffnet, um etwa die Hälfte der Lösung in den Probenahmekolben K zu überführen. Der Füllstand von B unterhalb der Flüssigkeit in A bestimmte in der Regel die Menge der in K überführten Lösung. Das Gewicht der Lösung in K wurde durch Wiegen des Kolbens vor dem Zusammenbau und nach dem Einfüllen der Lösung und dem Zerlegen bestimmt. Eine bekannte Menge destilliertes Wasser wurde durch L in den Kolben eingespritzt, um die Probe zu verdünnen und etwaige Dämpfe in der Gasphase zu lösen. Der Partialdruck von HCl in reinem Wasser beträgt bei 25 °C mehr als 1 Torr bei einer Molalität von mehr als 8 m (m nach einer Zahl in einem Satz bedeutet molal); daher ist es zweifelhaft, dass bei Konzentrationen von weniger als 8 m ein Verlust von HCl während der Probenahme auftreten könnte. Aus diesem Grund wurden einige der Läufe bei 25° C, die weniger als 4 m HCl enthielten, mit einem einzigen verschlossenen Kolben durchgeführt, und nach der Äquilibrierung wurde ein Teil der Lösung sorgfältig dekantiert und für die Probenahme filtriert.
Analyse
Die Lösungen wurden nach entsprechender Verdünnung auf die Gesamtkonzentration an Chlorid-Ionen und Aluminium-Ionen analysiert. Die Gesamtchlorid-Ionen-Konzentration wurde durch potentiometrische Titration mit Ag+ bestimmt. Die Al+++-Konzentration wurde bestimmt, indem zunächst ein Komplex mit einem Überschuss an Ethylendiamin-Tetraessigsäure (EDTA) gebildet und dann der EDTA-Überschuss mit Cu++ bei einem pH-Wert von 3,8 rücktitriert wurde.
Der AlCl3-Gehalt wurde aus der Al+++-Analyse berechnet. Durch Subtraktion des Chlorid-Ions in der berechneten AlCl3-Menge von der Gesamt-Chlorid-Ionen-Konzentration konnte die HCl-Konzentration in den gesättigten Lösungen berechnet werden.
Diese Berechnungsmethode wurde für alle Analysen verwendet, mit Ausnahme derjenigen, bei denen die HCl-Konzentration bekanntlich Null war, d.h. wenn AlCl3 der einzige Elektrolyt in reinem Wasser war. Für diese Analysen wurde die AlCl3-Konzentration einfach aus der Chlorid-Ionen-Analyse berechnet, die die genauere der beiden Analysen war, obwohl sowohl Al+++- als auch Cl–Analysen für diese Proben durchgeführt wurden.
Die Differenz der Cl–Analyse, die aus der gesamten Cl–Analyse und der Cl- aus der Al+++-Analyse für Experimente ohne zugesetztes HCl berechnet wurde, betrug ±0,2 Gew.-Prozent Cl-. Dies deutet darauf hin, dass die Analyse von Al+++ im Durchschnitt mit einem Fehler von +0,05 Gew.-Prozent behaftet war, da die Cl-Analyse bekanntermaßen wesentlich genauer ist als die Al+++-Analyse. In HCl-haltigen Lösungen spiegelte sich ein Fehler von ±0,05 % im Al+++-Gehalt als ±0,20 Gew.-% im HCl-Gehalt wider; dies lag daran, dass der Gesamt-Cl-Gehalt zwar sehr genau war, der Cl-Anteil des zugesetzten HCl und damit die HCl-Molalität jedoch, wie bereits erwähnt, durch Differenzbildung berechnet wurde.
Ergebnisse
Die Ergebnisse sind in Tabelle 1 zusammengefasst und in Abbildung 2 dargestellt. Die maximale HCl-Konzentration für die in Tabelle 1 angegebenen Daten beträgt bei 85° C etwa 30 Gew.-Prozent. Die Messungen wurden bei dieser Konzentration abgebrochen, da die Gleichgewichtsdrücke im System bei höheren Konzentrationen zu hoch waren. Es ist auch anzumerken, dass bei 65° und 85° C weniger Bestimmungen durchgeführt wurden als bei 25° und 45° C. Es wurden Wiederholungen bei den beiden niedrigeren Temperaturen durchgeführt, um einen Hinweis auf eine zufriedenstellende Wiederholbarkeit der Ergebnisse zu erhalten. Abbildung 2 zeigt, dass die Löslichkeit des Aluminiumsalzes mit zunehmender HCl-Konzentration drastisch abnimmt. Daher ist die Auslaugung nicht-bauxitischer Erze mit HCl-Lösung und die Ausfällung des reinen Salzes zur Aluminiumgewinnung durch Zugabe von HCl ein praktikables Verfahren; ein solches Verfahren ist Gegenstand mehrerer Patente. Die Ergebnisse zeigen, dass sich die Löslichkeit nicht wesentlich mit der Temperatur ändert, und dass bei einer Temperaturerhöhung von 60° C (25° bis 85° C) die Löslichkeit von reinem Salz allein in Wasser nur um 2,2 Prozent im Vergleich zur Löslichkeit bei 25° C zunimmt.
Vergleich mit anderen Daten
Die Löslichkeit von reinem Salz in Wasser bei 25° C stimmt genau mit den Daten von Palitzch und mit Ehret und Frere überein. Die Ergebnisse von Malquori liegen etwa 10 % höher. Die von Tanaka ermittelte Löslichkeit ist bei 45° C und bei 65° C etwa 3,3 % höher als in der vorliegenden Untersuchung.
Die Wirkung von HCl in Wasser auf die Löslichkeit von Salz wurde von Seidel und Fisher bei 0° C und von Malquori bei 25° C untersucht. Die Ergebnisse der erstgenannten Forscher bei 0° C stimmen sehr gut mit den auf 0° C extrapolierten Daten in Tabelle 1 überein, während die Ergebnisse des letztgenannten Forschers bei 25° C etwas streuen und bei niedrigen HCl-Konzentrationen ungefähr um 3 pet voneinander abweichen; die Übereinstimmung im Bereich von 5 bis 30 Gew.-ppt HCl liegt jedoch innerhalb von 1 pct.
Thermodynamische Behandlung
Löslichkeitsprodukt und Aktivitäten im System AlCl3-6H2O-H2O
Der ionische Aktivitätskoeffizient Y12 von AlCl3 in Wasser wurde von Mason bis zu 1,8 m gemessen, und die neu berechneten Werte werden von Robinson und Stokes angegeben. Da der Aktivitätskoeffizient von 1,8 m bis zum Sättigungswert von 3,3835 m um mehr als das Fünffache ansteigen dürfte, wird der Sättigungswert zur Berechnung nach der in einem früheren Bericht ausführlich beschriebenen Methode verwendet (1 m = 1 Mol in 1 kg Lösungsmittel). Die Methode mit ihrer entsprechenden neuen Anwendung wird in diesem Bericht kurz zusammengefasst. Die mittlere Ionenaktivität von AlCl3, bezeichnet als a12, wird durch die folgende Potenzreihe in Bezug auf die Molalität m ausgedrückt:

Die entsprechende Gleichung für die Aktivität von Wasser aw, erhält man durch Anwendung der Gibbs-Duhem-Beziehung; das Ergebnis ist
![]()
Beachten Sie, dass die Exponenten von m mit den gleichen Koeffizienten von C, D, usw., in Gleichung 2 um 1 höher sind als in Gleichung 1, und der Koeffizient von m in Gleichung 2 stammt aus der Debye-Huckel-Theorie, wie sie von Gokcen diskutiert wurde.
Die Reaktion zur Auflösung des Salzes ist
AlCl3-6H2O (S) = Al+++ + 3Cl- + 6H2O (l),………………………….(3)
wobei (s) fest und (l) flüssig bedeutet.
Die entsprechende Gleichgewichtskonstante ist
![]()
wobei der Nenner, die Aktivität des Festkörpers, als Einheit angenommen wird, da seine Zusammensetzung unverändert bleibt, wenn andere Elektrolyte in Lösung zugegeben werden. Wir setzen a12 in 1n Kp direkt aus Gleichung 1 und aw aus Gleichung 2 ein, nachdem wir Gleichung 2 mit 0,108093 multipliziert haben, damit der Koeffizient von 1n aw gleich 6 ist. Da Kp unabhängig von der Zusammensetzung ist, ist es offensichtlich, dass
![]()
Nach den erforderlichen Substitutionen aus den Gleichungen 1 und 2 und dann der Substitution des Durchschnittswertes m = 3.3835 aus den ersten beiden Durchläufen in Tabelle 1 erhält man eine Gleichung zur Lösung der sechs unbekannten Koeffizienten in Gleichung 1, und die restlichen fünf Gleichungen erhält man, indem man jeden der fünf experimentellen Werte des mittleren Ionenaktivitätskoeffizienten von AlCl3 , y12 in Tabelle 2, in
![]()
einsetzt und dann jedes Ergebnis in Gleichung 1 substituiert. Die sechs auf diese Weise erhaltenen Gleichungen werden dann mit dem Computer gelöst. Die Ergebnisse sind wie folgt:
C = -57.5723,
D = +142.0288,
E = -202.5581,
F = +161.1919,
G = -67.7831,
und H = +11.6880.
Durch Einsetzen dieser Werte in die Gleichungen 1, 2 und 4 erhält man die Werte für Y12, aw und Kp. Die Ergebnisse sind in Tabelle 3 unter der Überschrift „Bureau results“ aufgeführt:“ Es sei darauf hingewiesen, dass die Aktivität von Wasser nun aus Gleichung 2 und der Dampfdruck von Wasser über der Lösung, P, aus
aw = P/P°,……………………………….(7)
berechnet werden kann, wobei P° der Dampfdruck von reinem Wasser bei derselben Temperatur ist. Man beachte, dass der Dampfdruck des Wassers über der gesättigten Lösung etwas mehr als die Hälfte des Dampfdrucks über reinem Wasser beträgt, da aw = 0,509. Die vorstehenden Ergebnisse stellen den ersten Satz von Daten über Aktivitäten dar, die auf der Löslichkeit des Salzes beruhen.
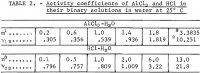
Anmerkung: In dieser Tabelle bezieht sich m auf die Molalität von AlCl3, n auf die Molalität von HCl, und die Molalität ist Mol in 1 kg Wasser.
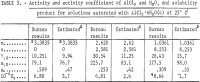
Anmerkung.In dieser Tabelle bezieht sich m auf die Molalität von AlCl3, n auf die Molalität von HCl, und die Molalität ist Mol in 1 kg Wasser.
Schätzung der Aktivitäten im System AlCl3-6H2O-H2O
Zwei bestehende zuverlässige Schätzmethoden werden verwendet, um die Aktivitäten im System AlCl3-6H2O-H2O über die bestehenden direkten experimentellen Daten bei m = 1,8 hinaus zu erhalten. Die erste Methode, wie sie von Kusik und Meissner beschrieben wurde, ergibt einen Schätzwert von γ12 = 9,94 bei 3,3835 m. Dieser Schätzwert steht in enger Übereinstimmung mit 10,251, dem in der vorliegenden Untersuchung erhaltenen Wert. Der entsprechende Schätzwert für die Aktivität von Wasser, aw, beträgt 0,47, ebenfalls in enger Übereinstimmung mit dem in der vorliegenden Untersuchung ermittelten Wert von 0,509. Die aus diesen Werten berechnete Gleichgewichtskonstante Kp ist nicht weit von 6,8 x 10 5 entfernt, wenn man bedenkt, dass die vierte Potenz von a12 und die sechste Potenz von aw multipliziert werden, um Kp zu erhalten.
Die zweite Schätzmethode nach Bromley ergibt 10,42 für γ12, ein Wert, der näher an dem mit der vorhergehenden Methode erhaltenen liegt. Der Aktivitätskoeffizient von Wasser wurde von den vorliegenden Autoren durch Integration der Gibbs-Duhem-Gleichung ermittelt, in die die nach der Bromley-Methode geschätzten Werte für a12 eingesetzt wurden. Das Ergebnis ist aw = 0,540. Der Mittelwert beider Methoden beträgt 0,505, was in sehr guter Übereinstimmung mit dem Wert des Bureaus von 0,509 ist. Die Bromley-Methode enthält jedoch keine bequeme Methode zur Bestimmung von aw, die in der Kusik-Meissner-Methode enthalten ist.
Die Übereinstimmung der geschätzten Werte mit den Werten aus den Löslichkeitsdaten ist nicht immer so gut, wie hier für jeden Elektrolyten bei jeder Zusammensetzung gezeigt. Zum Beispiel weichen selbst für AlCl3 bei 1 m die beiden Schätzungen von γ12 nur um 13 Prozent voneinander ab.
Löslichkeitsprodukt und Aktivitäten im System AlCl3-6H2O-HCl-H2O
Die Auswirkung einer steigenden HCl-Konzentration auf die Löslichkeit des Salzes ist weitgehend auf die steigende Konzentration der Chloridionen zurückzuführen. Die Gleichgewichtskonstante mit den Aktivitäten a1 und a2 der einzelnen Ionen ist in diesem Fall
![]()
wobei γ12 = γ1γ2 durch Definition von γ12 aus den einzelnen Ionenaktivitäten γ1 (für Al+++) und γ2 (für Cl-), und n die Molalität von HCl ist. Der Wert von Kp ist derselbe wie in Gleichung 4, aber die rechte Seite in Gleichung 8 unterscheidet sich von der in Gleichung 4. Es ist zu beachten, dass mit zunehmendem n m, die Konzentration von Al+++, abnehmen muss, vorausgesetzt, dass γ12 und aw nicht stark abnehmen; daher fällt das Salz aus, was als Aussalzungseffekt bekannt ist.
Die Berechnung der Aktivitäten in der ternären Lösung erfordert eine Gleichung ähnlich der Gleichung 1 für HCl. Da die Daten für HCl über einen weiten Konzentrationsbereich genau bekannt sind, ist es möglich, eine Gleichung mit beliebig vielen Variablen aufzustellen. Die folgende Gleichung gibt eine genaue Darstellung der Daten für den Aktivitätskoeffizienten von HCl, γ32, wieder, wobei der tiefgestellte Index 3 für H+ und 2 für Cl- steht:
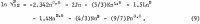
Die für diesen Zweck ausgewählten Daten von Haase, Naas und Thutnm sind in der dritten und vierten Zeile von Tabelle 2 aufgeführt. Die Werte der aus diesen Daten berechneten Koeffizienten sind wie folgt:
J = -1,88416,
K = +2,24342,
L = -1,98545,
M = +1,00091,
N = -0,25934,
und P = +0,02634.
Die Gleichungen für die Aktivitäten von AlCl3 und von H2O enthalten diese Koeffizienten sowie die Koeffizienten der Kreuzprodukte (m h/2)(n k/2), wobei h und k ganze Zahlen sind, und diese Gleichungen lauten wie folgt:
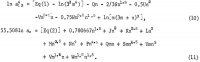
Die fünf zusätzlichen Koeffizienten in diesen Gleichungen werden durch Addition von Gleichung 10 und 6 1n aw aus Gleichung 11 bestimmt, um 1n Kp zu erhalten, und durch Verwendung der folgenden ausgewählten Löslichkeitsdaten aus Tabelle 1:
m: 2.620, 2.016, 1.333, 0.953 und 0.535.
n: 2.581, 4.460, 6.780, 8.397 und 10.063.
Die resultierenden Berechnungen ergeben die folgenden Werte der Koeffizienten in den Gleichungen 10 und 11:
Q = +23.27027,
S = -22.47064,
U = +4,29102,
V = -9,76081,
und W = +4,60246.
Die aus den vorangegangenen Gleichungen berechneten Ergebnisse für γ12, a12, aw und Kp sind in Tabelle 3 aufgeführt. Die Werte von γ12 aus Gleichung 9 stimmen mit denen von Harned und Gary bei sehr niedrigen Konzentrationen von HCl und AlCl3 überein.
Der Partialdruck von HCl(g), P32, über einer Lösung kann aus der folgenden Gleichung (4) berechnet werden:
Kp (HCl) = 4.94 x 10 -7 = P32/a²32………………………….(12)
wobei Kp(HCl) die Gleichgewichtskonstante bei 25° C für H+ + Cl- = HCl(g) ist, und a32 die mittlere Ionenaktivität von HCl in Lösung ist. Zu diesem Zweck ist es notwendig, eine Gleichung für a32 zu schreiben, ähnlich der Gleichung 10, unter Verwendung der Parameter in Gleichung 11, wie an anderer Stelle ausführlich dargestellt.
Die Auswirkung der Temperatur auf die Löslichkeit des Salzes ist gering, wie in Tabelle 1 gezeigt. Die Auswirkung auf die ionischen Aktivitäten dürfte daher gering sein, da alle Parameter in Gleichung 11 aus den Löslichkeitsdaten hätten ermittelt werden können, wenn der experimentelle Fehler bei der Aluminiumanalyse kleiner als ±0,01 Gew.-% gewesen wäre. Im allgemeinen ist für einen Temperaturbereich bis etwa 80° C jeder Parameter eine lineare Funktion der Temperatur, und diese Abhängigkeit kann bestimmt werden, wenn die Gleichung 11 bei einer anderen Temperatur bekannt wäre, die mindestens 50° C höher ist als 25° C.
Schätzung der Aktivitäten im System AlCl3-6H2O-HCl-H2O
Die Werte der Aktivitäten, des Aktivitätskoeffizienten und des Löslichkeitsprodukts, die im vorliegenden Bericht nach der von Kusik und Meissner entwickelten Methode geschätzt wurden, sind in Tabelle 3 aufgeführt. Der Aktivitätskoeffizient γ12 für AlCl3 ist etwa doppelt so hoch wie der geschätzte Wert für die ausgewählten HCl-haltigen Lösungen. Die Aktivität von Wasser, aw, stimmt dagegen gut mit den geschätzten Werten überein, außer für m = 2,620. Es ist offensichtlich, dass die Berechnungen wesentlich zuverlässiger gewesen wären, wenn der Dampfdruck des Wassers, aw, gemessen worden wäre, denn aw geht als aw in Kp ein, so dass kleine Fehler bei aw große Fehler bei γ12 und Kp verursachen. Zu diesem Zweck wird eine begrenzte Anzahl von Dampfdruckmessungen empfohlen, um die Genauigkeit der vorliegenden Berechnungen und der Schätzmethoden zu testen.
Die Temperaturabhängigkeit der in Tabelle 3 aufgeführten thermodynamischen Eigenschaften kann wie von Kusik und Meissner beschrieben geschätzt werden. Es ist jedoch wahrscheinlich, dass die Schätzung einen höheren Grad der Temperaturabhängigkeit ergibt, als die schwache Temperaturabhängigkeit der Löslichkeit angibt. Es konnte kein Versuch unternommen werden, die Auswirkung der Temperatur nach der Methode des Bureaus zu berechnen, weil (1) a12 bei niedrigen Konzentrationen von AlCl3 bei verschiedenen Temperaturen nicht bekannt ist, (2) die Löslichkeit von AlCl3 nicht mit einer Genauigkeit von annähernd 0,01 pct in Al+++ bestimmt werden konnte und (3) der Konzentrationsbereich von HCl bei 65° und 85° C zu klein ist, um eine ausreichende Anzahl von sehr unterschiedlichen Löslichkeitsdaten für AlCl3 auszuwählen, um die Parameter in den Gleichungen 10 und 11 genau zu bestimmen.
AlCl3-FeCl3-KCl-NaCl-HCl-H2O System
Vorläufige Daten zur Löslichkeit von AlCl3, FeCl3 , KCl und NaCl in wässrigen Lösungen, die 24 bis 31 Gew.-% HCl bei 25° C enthalten, wurden gewonnen, um die Verunreinigung von AlCl3-6H2O zu beurteilen, das aus nicht-bauxitischen Erzen extrahiert werden kann. Zu diesem Zweck wurden 2 Liter einer Lösung mit bekannten Mengen an Salzen zubereitet, 90 ml dieser Lösung wurden für jeden Durchlauf in einen Kolben gegeben und dann wurde eine bekannte Menge gasförmiges HCl zugegeben, um 24 bis 31 Gew.-Prozent gelöstes HCl zu erhalten. In diesem Bereich von HCl in Lösung wurden farblose anisotrope Kristalle von AlCl3-6H2O, helle anisotrope Kristalle von FeCl3-2KCl-H2O und kubische isotrope transparente Kristalle von KCl und NaCl ausgefällt und durch mikroskopische Untersuchung identifiziert. Das Verfahren und die Analysen für die Aluminiumionen- und Chloridionenkonzentrationen waren die gleichen wie für das System AlCl3-6H2O-HCl-H2O, das weiter oben in diesem Bericht vorgestellt wurde. Zusätzlich wurde die Eisen(III)-Ionenkonzentration durch Standard-K2Cr2O7-Titration, die Natrium-Ionenkonzentration durch Atomabsorptionsverfahren und die Kalium-Ionenkonzentration durch Subtraktion der Natrium-Ionenkonzentration von einer Bestimmung der kombinierten Kalium-Ionen- und Natrium-Ionenkonzentration nach Trennung durch Ionenaustausch bestimmt. Die Ergebnisse sind in Tabelle 4 aufgeführt und in Abbildung 3 eingezeichnet. Ähnliche Ergebnisse von Miles sind ebenfalls in Abbildung 3 eingezeichnet, um zu zeigen, dass die Übereinstimmung ausgezeichnet ist. Veröffentlichte Daten für verwandte, einfachere Systeme, die weniger Komponenten enthalten, wurden von Linke zusammengestellt.
Bei den Verdampfungs- oder HCl-Gasdurchdringungs-Kristallisationsverfahren zur Herstellung von reinem Aluminiumchloridhexahydrat wird die Verunreinigung durch andere Metallchloride zu einem Problem, wenn sich die Verunreinigungswerte in den Auslaugungslösungen erhöhen. Abbildung 3 zeigt die Konzentrationen, bei denen Verunreinigungen wie NaCl, KCl und FeCl2-2KCl-H2O ebenfalls als getrennte Phasen aus der Lösung kristallisieren und somit eine Verunreinigung der AlCl3-6H2O-Kristalle verursachen. Bei weniger als 2,4 Gew.-Teile FeCl3 in Gegenwart von 1,6 Gew.-Teile KCl bei 25 °C muss die HCl-Konzentration beispielsweise weniger als 28 Gew.-Teile betragen, um eine Verunreinigung von AlCl3-6H2O durch das Doppelsalz FeCl3-2KCl-H2O zu vermeiden. Abbildung 3 ist auch nützlich, um den Niederschlag durch fraktionierte Rekristallisation wieder aufzulösen und das Aluminiumsalz zu reinigen. Darüber hinaus können einige der Salze der Übergangselemente, wie FeCl3, durch partielle Elektrolyse minimiert werden, um eine ausreichende Menge an Eisen vor der Ansäuerung mit HCl herauszuplatzen.
Eine thermodynamische Behandlung des Systems mit dem üblichen Fehler von ±0,05 Gew.-Prozent in der Chloridionenkonzentration ist nicht durchführbar, insbesondere in Ermangelung von Dampfdruckdaten für H2O(g) und HCl(g). Grobe Schätzungen der Aktivitäten können jedoch mit der Kusik-Meissner-Methode vorgenommen werden. Es wird davon ausgegangen, dass solche Schätzungen nur grobe Werte der Aktivitäten für die hydratisierten und komplexen Salze und für das Wasser liefern können.

Forschungsempfehlungen
Die Messungen der Aktivitäten sind nützlich für die Interpretation der Thermodynamik und Kinetik der Auslaugung, Ausfällung und Reinigung gewünschter Komponenten verschiedener Erze. Es gibt zwei Gründe, warum die Aktivitäten anhand der Messungen des Dampfdrucks von Wasser genau bestimmt werden können: (1) Der Dampfdruck kann mit einem hohen Maß an Präzision mit Hilfe von Differenzdruckaufnehmern gemessen werden, um aw nach Gleichung 7 zu erhalten und dann die Werte der Parameter in Gleichung 11 zu berechnen, so dass alle damit zusammenhängenden Eigenschaften berechnet werden können, wie zuvor ausführlich erörtert (2) Das Löslichkeitsprodukt und die Aktivitäten können beide für mehrwertige Salze, die eine große Anzahl von Wassermolekülen in ihren hydratisierten Kristallen enthalten, genau bestimmt werden. Der zweite Grund ergibt sich aus der Tatsache, dass der Exponent der Wasseraktivität in Gleichung 4 gleich den Wassermolen im hydratisierten Kristall ist.
Aluminiumchlorid in wässrigen Salzsäurelösungen
Eine weitere interessante Versuchsart für das hier behandelte ternäre System ist die Messung des Partialdrucks von HCl(g) über verschiedenen Lösungen, die ausreichend große Mengen an gelöstem HCl enthalten. Das experimentelle Verfahren zu diesem Zweck ist an anderer Stelle beschrieben. Salze der Gruppen IIA, IIIA und Übergangsmetalle sind ausgezeichnete Kandidaten für diese Art von Untersuchungen, da Elektrolyte mit höheren Wertigkeiten als 1:1 in der Regel hydratisierte Salze bilden.
Die Löslichkeit und die Aktivität von Aluminiumchloridhexahydrat, AlCl3-6H2O, in wässrigen Lösungen wurden im Rahmen der Forschungsarbeiten des Bureau of Mines, U.S. Department of the Interior, zur Verbesserung der Mineralaufbereitungstechnologie für die Gewinnung von Aluminiumoxid aus minderwertigen heimischen Ressourcen bestimmt. Die Löslichkeit von AlCl3 in reinem Wasser betrug 31,09 bzw. 31,77 Gew.-Prozent bei 25° bzw. 85° C und sank drastisch auf 10 bzw. 0,1 Gew.-Prozent, wenn 20,3 bzw. 37 Gew.-Prozent Salzsäure (HCl) in Lösung gegeben wurden. Die Gleichgewichtskonstante für die Löslichkeit des Hexahydrats, die Aktivitäten und die Aktivitätskoeffizienten von AlCl3 und H2O wurden berechnet und mit den Ergebnissen der verfügbaren Schätzmethoden verglichen. Es wurde gezeigt, dass die Ergebnisse bei der Auslaugung von nicht-bauxitischen Erzen zur Gewinnung von Aluminiumoxid nützlich sind, da sich die Löslichkeiten der einzelnen Salze bei Zugabe von HCl ändern.
Die gleichzeitigen Löslichkeiten von AlCl3 , FeCl3, KCl und NaCl in Lösungen von HCl-H2O wurden ebenfalls bestimmt und ihre Auswirkungen auf die Reinheit von AlCl3-6H2O, das aus gemischten Salzlösungen kristallisiert wird, werden kurz diskutiert.