Core and Valence Electrons
このように周期表を通して、どんどん大きな原子の電子配置を書き進めていくと、充填した内側の部分殻の配置をコピーし続けるのは面倒になります。 実際には、希ガスの軌道はすべて埋まっているので、化学者は前の行の希ガスの配置を括弧付きの希ガス記号で表すことによって表記を簡略化している。 例えば、ネオン(Z = 10)の1s2 2s2 2p6の電子配置を表すので、Z = 11のナトリウムの電子配置は、1s2 2s2 2p6 3s1である。 は3s1
| 完全電子配置 | Nobel Gas Shorthand | ||
| Neon | Z = 10 | Ne.Ne と表記される。 1s2 2s2 2p6 | Ne: 2s2 2p6 |
| Sodium | Z = 11 |
Na: 1s2 2s2 2p6 3s1 |
Na: 3s1 |
内側の充填軌道にある電子は原子核に近く、より強く結合しているので、化学反応に関与することはほとんどない。 これを内殻電子と呼ぶことにする。 代表的な元素(周期表の1、2、13~18列目)では、電子配置の最大n値より小さいn値を持つ電子がすべて内殻電子となる。 例えば、ナトリウム原子の場合、n値の最大値は3なので、n<3319>3の原子軌道、すなわち1s、2s、2p軌道にある電子が内殻電子となる。 つまり、ナトリウムは10個の内殻電子を持つことになります。 この内殻電子の定義については、後で遷移金属について改めて説明します。
つまり、原子の化学反応は、その最外殻にある電子(n値の最も大きい電子、価電子と呼ばれる)に大きく依存するのです。 このように表記を簡略化することで、価電子の配置をよりわかりやすく見ることができる。 この表記法を用いて、ナトリウムとリチウムの電子配置を比較すると、次のようになります。
| ナトリウム | 1s2 2s2 2p6 3s1 | 3s1 |
| リチウム | 1s2 2s1 | 2s1 |
このことから、ナトリウムとリチウムはともに価電子帯に1個のs電子を持っていることが容易にわかる。
第3期の8つの元素を作り続けると、3sと3p軌道が一度に1つの電子で満たされます。
例題2.2.2
軌道図を描き、それを使ってZ = 15のリンの電子配置を導出します。 その価電子配置は何か。
与えられた原子番号
求められたもの:リンの軌道図と価電子配置
戦略:
- 周期表でリンの前に最も近い希ガスを見つけてください。 6009>
- 図2.1.1を参照して、それらの価電子軌道を表す軌道図を描きます。 フントの法則に従って、エネルギーの低い軌道から順に、利用可能な軌道に価電子を配置する。 6009>
- 内周軌道(最も近い希ガスの電子配置に対応する軌道)は無視して、リンの価電子配置を書きなさい。
解答:
A リンは周期表の3段目にあるので、電子数10個の閉殻を持っていることが分かります。
B 追加の5個の電子は、次に利用可能な軌道に配置されます(図2.1.1によると、3s軌道と3p軌道です:
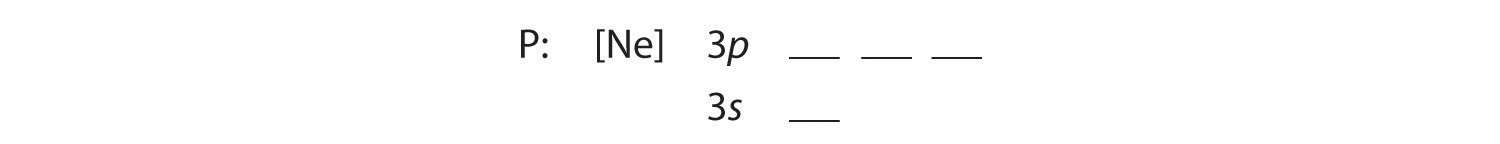
3s軌道は3p軌道よりエネルギーが低いので、まずそれを埋める。
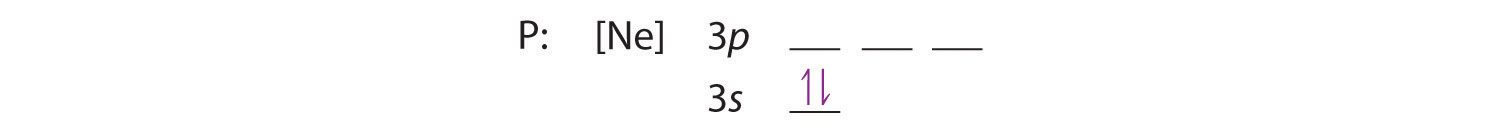
フントの法則では、残りの3個の電子は縮退した3p軌道を別々に占めますが、スピンは揃えたままです:
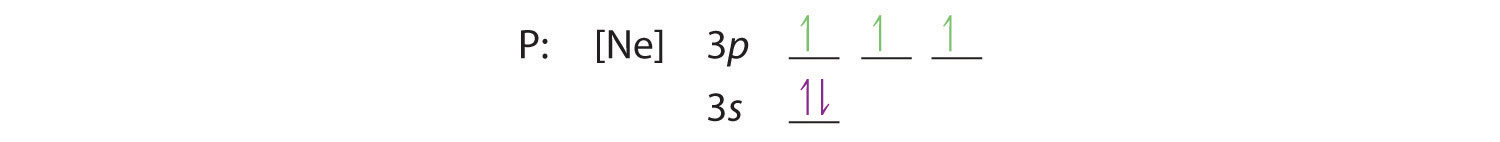
電子配置は3s2 3p3です。
C 内部軌道を無視して価電子配置を求めますが、これはリンの場合、閉殻を無視することを意味します。 3867>
Exercise 2.2.2
軌道図を描き、それを使って塩素(Z=17)の電子配置を導出する。 その価電子配置はどうなっているか、
答えなさい。 3s2 3p5
価電子配置です。 3s23p5
軌道を埋める一般的な順序は図2.2.1に描かれている通りです。 各nの値に対応するサブシェルは左から右へ連続した横線に書かれており、各行は周期表の行を表している。 軌道を埋める順番は、右上から左下へ走る斜めの線で示される。 したがって、4s軌道は遮蔽効果や透過効果により3d軌道より先に充填される。 その結果、第4期を開始するカリウムの電子配置は4s1、カルシウムの電子配置は4s2となる。 次の10元素である遷移金属では、5つの3d軌道が満たされ、その後に3つの4p軌道が続きます。 この列の最後のメンバーは、希ガスのクリプトン(Z = 36)、Krであることに注意してください。 4s2 3d10 4p6で、4s, 3d, 4p軌道が満たされている。 周期表の5行目は、5s, 4d, 5p軌道が順に埋まっていることを除けば、基本的に4行目と同じである。
周期表の6行目は、6s軌道と5d軌道の間に14個の電子を保持できる4f軌道が入るので、前の2行とは違ってきます。 このように価電子帯に4f軌道を持つ元素がランタノイドである。 最終的に6p軌道が埋まると、次の(そして最後に知られている)希ガスであるラドン(Z = 86)、Rn:6s2 4f14 5d10 6p6に到達することになります。 最後の列では、7s軌道と6d軌道の間に5f軌道が埋まっており、14個のアクチノイド元素が存在することになる。
Example 2.2.3
水銀(Z = 80)の電子配置を、内側の軌道をすべて示して書きましょう。
与えられた:原子番号
求められた:完全な電子配置
戦略:
図2.2.1の軌道図と周期表を参考に、80個すべての電子が配置されるまで軌道を埋めていくこと
解決策:
軌道の中の電子を図2.2の順序に従って配置し、軌道の中の電子がすべて揃ったところで、水銀の電子配置を確認する。1を参考に、周期表を使って配置する。 3867>
| 1s2 | 列 1 | 2 electrons |
| 2s22p6 | 列を得ることができました。 2 | 8 electrons |
| 3s23p6 | row 3 | 8 electrons |
| 4s23d104p6がある。 | 列4 | 18個の電子 |
| 5s24d105p6 | 列5 | 18個の電子 |
| 1〜5行目 | 54 electrons |
最初の5行を埋めた後。 80 – 54 = 26個の電子を収容する必要があります。 図2.2.2によると、6s軌道(2電子)、4f軌道(14電子)、5d軌道(10電子)を埋める必要がある。 その結果、水銀の電子配置:
Hg: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10
Hg.Hg: 6s2 4f14 5d10
5d副殻が満たされ、6s2 4f14 5d10価の殻配置で、合計80個の電子を持つ。 (電子の総数が原子番号と等しいことを常に確認する必要があります。)
Exercise 2.2.3
114番元素は自然界では十分に安定していませんが、1999年にロシアとアメリカの科学者のチームによって114番元素の同位体が原子炉で初めて2つ作られました。 114番元素の完全な電子配置を書きなさい
Answer: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p2
元素の電子配置は、図2・2・3に軌道が満たされる順に示されています。 いくつかの場合、基底状態の電子配置は図2.2.1で予測されるものと異なっている。 これらの異常のいくつかは、3d軌道が充填されるにつれて発生する。 例えば、クロムの基底状態の電子配置は、予測された4s2 3d4ではなく、4s1 3d5であることが確認された。 同様に、銅の電子配置は、s2 3d9ではなく、4s1 3d10であることが確認されている。 これは、サブシェルが半分埋まった状態(ns1, np3, nd5, nf7)または埋まった状態(ns2, np6, nd10, nf14)であるため、安定性が増しているためと考えられる。 高エネルギー準位間の差は小さいので、この安定性が加わることで、電子をある軌道から別の軌道に移動させるのに十分である。 重い元素では、他のより複雑な効果も重要で、図 2.2.3 に示すような異常が発生することがある。 例えば、セリウムの電子配置は6s2 4f1 5d1であるが、これは単純な言葉では合理化できない。
注
付加的な安定性は、半埋め込みまたは埋め込みの部分殻と関連している。