原子は電子を獲得したり失ったりして、電離と呼ばれる過程でイオンを形成します(このようにしてできた化合物をイオン性化合物と呼びます)。 イオン化合物が水に溶けるとき、そのイオンは解離と呼ばれるプロセスで互いに分離します。 水や他の多くの共有結合化合物の興味深い特徴の1つは、それらもイオンに解離することができるということです。
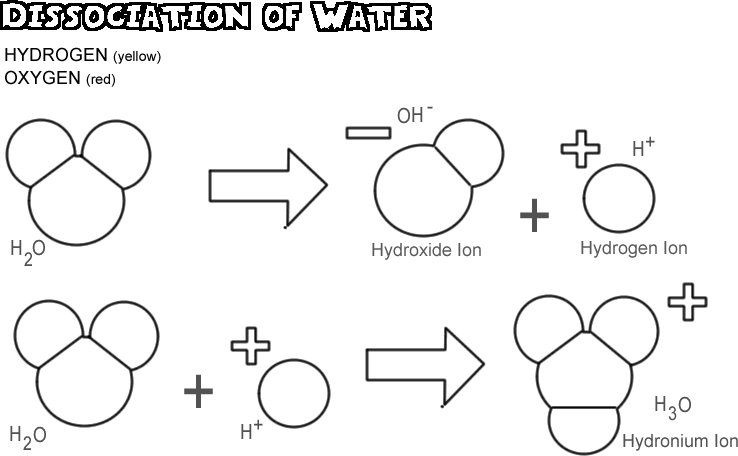
水の解離
水が解離すると、水素原子の1つが酸素原子とともに電子を残して水素イオンとなり、酸素原子と他の水素原子は水酸化物イオンとなる。 水素イオンは陽子の正電荷を中和する電子を持たないので、1単位分の正電荷を持ち、H+と表記される。 水酸化物イオンは残された電子を保持しているため、1ユニット分の負の電荷を持ち、OH-と記号化される。 水素イオン(プロトン)は、それ自体では長くは流れないが、イオン化していない2番目の水分子の酸素原子と結合してヒドロニウムイオン(H3O +)を形成する
どの水のサンプルでも、一度に解離する分子は非常に少なく、実際には5億5000万分の1ほどしかない。
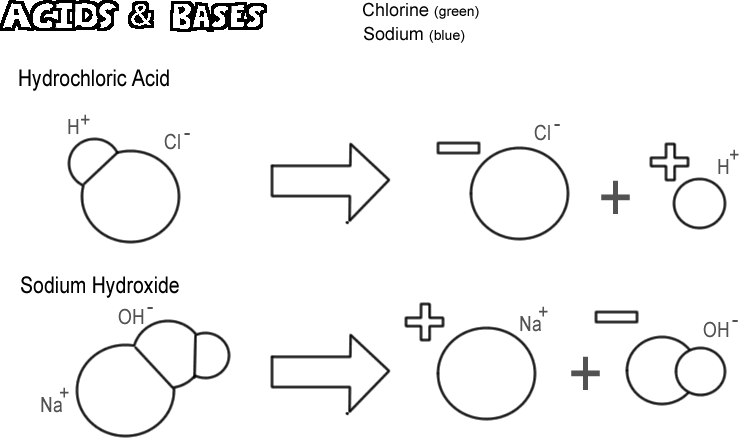
塩酸
ある種の分子(イオン性、共有結合性)は、水酸化物イオンを出さずに水素イオンを出すような解離を起こします。 このような物質は酸と呼ばれます。 水素イオンはほとんどの場合1個のプロトンなので、化学者の定義では酸は “プロトン供与体 “である。 非常に多くのプロトン(水素イオン)が「供与」されると、肌を焼いたり、金属を溶かしたりするような非常に大きな影響を与えることがあります。 図にある酸は塩酸です。 純粋な塩酸は気体ですが、水に簡単に溶けて、水素イオンと塩化物イオンの溶液になります。 ほぼ全量が水中で解離するので、強酸と呼ばれる。 完全に解離しない酸を弱酸という。
水酸化ナトリウム
酸の反対語は塩基で、アルカリとも呼ばれる。 典型的な強塩基は水酸化ナトリウムで、灰汁の主成分である。 水酸化ナトリウムは解離してナトリウムイオンと水酸化物イオンを生成する。 塩基は “プロトン受容体 “と定義される。 最も一般的な塩基は解離すると水酸化物イオンを生成し、プロトンを受け入れるのは水酸化物イオンである。 強い塩基は、酸よりもずっとひどい火傷を肌に負わせることがあります。
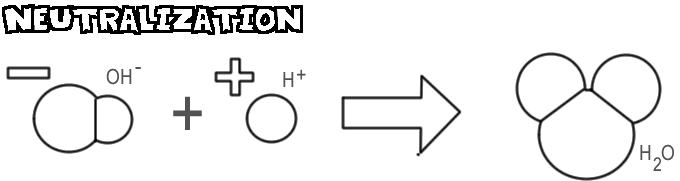
中和
塩基と酸を混ぜると、塩基の水酸化物イオンが酸の水素イオンと結合し、水になります。 この過程を中和といいます。
Questions:
1. 原子が電子を得たり失ったりするとどうなるのでしょうか。