水の性質
私たちの地球を特別なものにしているものの1つに、液体の水が存在することが挙げられます。 水はすべての生命にとって基本であり、これがなければすべての生物は死んでしまいます。
水は地球の表面の約70%を占め、私たちの体の65~75%を構成しています(血液の82%は水です)。 色も味も匂いもない退屈な水に見えるかもしれませんが、生命維持に必要な驚くべき性質を持っています。
(私たちが水を必要とし、水の中で生活する海洋動物がいるからこそ、石油流出が大きなダメージを与えるのです)
水の化学組成はH2O-2個の水素原子と1個の酸素原子です。 原子が結合して水分子を形成する方法と、分子が互いに作用する方法によって、水の特性は特別なものとなります。
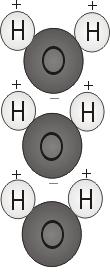
水の極性
2つの水素原子が酸素と結合すると、ミッキーマウスの耳のように分子の頂点にくっつきます。 この分子構造により、水分子は極性、つまり他の原子を引き寄せる偏った電荷を持つようになります。
2つの水素原子がある分子の端は、正に帯電しています。 もう一方の酸素のある端は負に帯電している。 ちょうど磁石のように、北極と南極が引き合うように(「反対は引き合う」)、水分子のプラス端は他の分子のマイナス端とつながるのである
これは私たちにとってどういうことだろうか。 水の極性により、他の極性物質を非常に容易に溶かすことができる。 極性のある物質を水の中に入れると、その分子のプラス端が水の分子のマイナス端に引き寄せられ、逆にマイナス端が水の分子のプラス端に引き寄せられます。 この引力により、新しい物質の分子は水の分子と均一に混合される。
水は他のどの液体よりも多くの物質を溶かす-最も強い酸でさえも! このため、水はしばしば「万能溶媒」と呼ばれる。 水の溶解力は、地球上の生命にとって非常に重要である。 水はどこへ行くにも、溶けた化学物質やミネラル、生き物を支えるための栄養素を運んでいきます。
極性があるので、水の分子は互いに強く引き合い、それが高い表面張力を与えています。 水の表面にある分子は「くっつき」、水の上に一種の「皮膚」を形成し、非常に軽い物体を支えるのに十分な強度を持ちます。 水上を歩く昆虫は、この表面張力を利用しています。
表面張力は、水が薄い層に広がるのではなく、滴下して塊になることを可能にします。
3つの物質状態
水は4つの元素の1つであり、地球上で通常見られる温度で固体、液体、気体の3つの物質状態のすべてに存在できる唯一の自然物質である。
他の多くの物質が状態を変えるには、過熱または冷却しなければならない。
水の気体状態は、水蒸気として大気中に絶えず存在している。 液体状態は川や湖、海などどこにでもある。
水の固体状態である氷は独特である。 ほとんどの液体は冷やされると収縮するが、これは分子の動きが遅く、互いに引き合う力に抵抗するエネルギーが少ないためである。 それが固まって固体になると、密に詰まった結晶を形成し、元の液体よりもはるかに密度が高くなる。 分子が並んで、液体の水よりも密度が低い、非常に「開いた」結晶構造を形成するのです。
これが、氷が浮く理由です。 そして、それは良いことなのだ!
Three Other Properties of Water
水は高い比熱を持っている。 つまり、空気と違って、水は温度を変えずに多くの熱を吸収することができるのです。 暑い日に泳ぐと爽快な気分になるのはこのためです。
また、水は空気より熱を奪うのが遅いです。 その結果、夏の湖や海の水は通常、季節の初めが最も冷たく、季節の終わり(太陽エネルギーを何日も吸収した後)が最も温かい。
水の沸点(海抜212°Fまたは100℃)は、標高によって影響される。 一般に、標高が高いほど水の沸点は低くなります。 ネパールのエベレスト山(29,012フィート)では、水は156度で沸騰します。
水の科学プロジェクト:
- 水循環
- 水車
- 過冷却水
- 水槽