非ボーキサイトからアルミナを抽出するための処理技術を改善するための研究プログラムが実施されました。 このプログラムの成功は、国内の供給源から高品位のアルミナを十分に生産するために必要な技術を提供し、アルミニウム生産に関する国家の経済的および戦略的なニーズを満たすものであった。 低品位鉱石からアルミナを回収する塩酸プロセスは、研究プログラムで研究されているプロセスの 1 つです。
このプロセスの 1 つのフェーズでは、溶液中のアルミニウム イオンの溶解度に対する塩化物イオン濃度の効果を利用しています。 25℃において、純水中のAlCl3の溶解度は約31重量%であり、塩酸(HCl)濃度の増加とともに減少し、HCl濃度が37pctまで増加すると0.1pctとなる。 この挙動は、多くの研究、プロセス、特許の対象になっている。 したがって、非ボーキサイト鉱を塩酸で浸出し、その液体をデカントしてろ過し、気体の塩酸を加えてAlCl3-6H2Oを沈殿させることが可能である。 残りの酸溶液は、追加の鉱石の浸出に使用でき、沈殿した AlCl3-6H2O は焼成して Al2O3 を得ることができる。 このプロセスに関する広範な議論と評価は、Peters, Johnson, and Kirbyによって提示されている。 このプロセスの完全な分析、解釈、改良に必要なイオン活性や溶解度などの熱力学的データは乏しく、既存の溶解度データは狭い温度範囲に限定されています。 そこで,本調査の目的は,(1) AlCl3 の溶解度を,25°~85°C の温度範囲,HCl 濃度 0.0~37.0 の範囲で決定することである。(2) 各種電解質を含む溶液中のAlCl3およびH2Oの活量とAlCl3-6H2Oの溶解平衡定数を計算すること。 100mlのフラスコAには電解質と過剰の塩を入れた溶液がある。 6mmODパイレックス管にフリットしたガラスフィルターBを、テフロン製ストップコックDとEに取り付けた外管に接合し、上部はCでネオプレン製0リング付きナイロン製圧縮継手を介してAに取り付けてある。 6mmODポリエチレンチューブF-Lは、AをDで加圧し、Eを開くと、Bでろ過した溶液のサンプルを第2フラスコKに送り込む。 Jの継手はCと同様で、フラスコはバーGに固定され、Hを揺動軸としてA、Kのフラスコを交互に上下に揺動させる機構に取り付けられている。 溶解度は温度の関数としては非常に弱いので、これ以上の温度制御は必要ない。
実験方法
25度、45度、65度、85度での溶解度の測定は、分析用の試薬を使って相平衡の条件下で行われた。 フラスコAには適量のAlCl3・6H2O、37pct塩酸溶液および蒸留水を入れ、少量の塩結晶(以下、塩とは塩化アルミニウム六水和物を指す)を過剰に含む約90mlの溶液を調製し、フラスコBには適量のAlCl3・6H2O、37pct塩酸溶液、および蒸留水を入れた。 原料の量は、既存の三元系AlCl3-6H2O-HCl-H2Oの溶解度データから推定した。 フラスコAで溶液を生成し、装置を組み立てた後、水位Nまで水に浸し、サーモスタットを所望の温度に設定した。 2〜3日の運転期間中、フラスコの連続的な機械的攪拌が行われた。 特に塩がHClと複合固形塩を形成しうる場合、
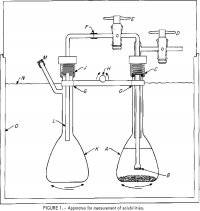
平衡を保証するために定期的に活発な手動攪拌も使用された。 平衡化期間の終わりに、フラスコは固体粒子の沈降を確実にするために1時間直立状態で動かさないようにされた。 Bの液面は通常Aの液面より低く、Kに移された溶液の量を決定する。Kの溶液の重量は、フラスコを組み立てる前と溶液を入れた後、分解して重量を測定することによって決定された。 試料を希釈し、気相中の蒸気を溶解させるために、Lを通して既知量の蒸留水をフラスコ内に注入した。 純水中のHClの分圧は、8m(文中の数字の後のmはmolalを表す)を超える濃度では25℃で1torrを超えるので、8m以下の濃度ではサンプリング中にHClの損失が発生するかどうか疑問である。 このため、4m未満のHClを含む25℃での運転のいくつかは、単一の栓付きフラスコで行われ、平衡化後、溶液の一部はサンプリングのために慎重にデカントされ、濾過された。 全塩化物イオン濃度はAg+を用いた電位差滴定により測定しました。 Al+++濃度は、まず過剰のエチレンジアミン四酢酸(EDTA)と錯形成し、次にpH3.8で過剰EDTAをCu++で逆滴定することにより求めた。
AlCl3量はAl+++分析値から算出した。
この計算方法は、HCl濃度がゼロであることが分かっている分析、すなわち純水中の電解質がAlCl3のみの場合以外のすべての分析に用いられた。
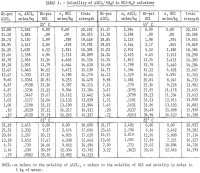
HClを添加しない実験では、全Cl-分析とAl+++分析によるCl-の差は±0.2 wt-pct Cl-であったが、AlCl3濃度は2つの分析のうちより正確な塩化物イオン分析から単に計算された。 これは、Clの分析がAl+++の分析よりかなり正確であることが知られているので、平均して、Al++の分析には+0.05 wt-pctの誤差があったことを示す。 HClを含む溶液では、Al+++含有量の±0.05 %の誤差がHCl含有量の±0.20 pctとして反映された。これは、全Cl含有量は非常に正確であるが、添加したHClによって寄与したCl、したがってHClのモラリティは、前述のように差によって計算されるためである。 表1に示した85℃のデータの最大HCl濃度は約30wt-pctである。 これ以上の濃度では系内の平衡圧力が過大になるため、この濃度で測定を中止した。 また,65°Cと85°Cでは,25°Cと45°Cよりも測定回数が少なかったことにも注目すべきであろう。 図2より、アルミニウム塩の溶解度は、塩酸濃度の増加とともに急激に減少することがわかる。 したがって、非ボーキサイト鉱石をHCl溶液で浸出し、HClを添加してアルミニウム抽出のための純粋な塩を沈殿させることは実現可能なプロセスであり、このようなプロセスはいくつかの特許の対象になっている。
他のデータとの比較
25℃での純塩の水への溶解度はPalitzchのデータ、EhretとFrereのデータと正確に一致していることが分かった。 Malquoriの結果は10%ほど高い。
塩の溶解度に対する水中での塩酸の影響はSeidelとFisherによって0°Cで,Malquoriによって25°Cで調査されている。 前者の0℃における結果は0℃に外挿した表1のデータと非常によく一致しているが,後者の25℃における結果は多少ばらつきがあり,低濃度のHClではおよそ3ペット程度不一致であった。
Thermodynamic Treatment
Solubility Product and Activities in AlCl3-6H2O-H2O System
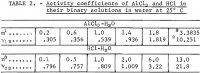
AlCl3 のイオン活性係数Y12はMasonによって1.8mまで測定されており、再計算した値はRobinsonとStokesによって与えられています。 1.8mから飽和値3.3835mまでの活量係数は5倍以上増加すると考えられるので、飽和値を用いて、以前の報告で詳しく述べた方法(1m=1kgの溶媒に1モル)により計算した。 この方法について、適切な新規適用を含めて、本報告書では簡単にまとめている。 AlCl3の平均イオン活量a12はモル数mで次の冪級数で表される。

水の活量awに対応する式はギブス-デュヘムの関係を適用して得られ、結果は
![]()
なおC、D等の係数が同じmについての指数が は式1より式2の方が1大きく、式2のmの係数はGokcenが論じたDebye-Huckel理論に由来する。
塩の溶解反応は
AlCl3-6H2O (S) = Al+++ + 3Cl- + 6H2O (l),……………….である。(3)
ここで(s)は固体、(l)は液体を意味する。
対応する平衡定数は
![]()
ここで分母の固体の活性は溶液中に他の電解質が加えられても組成は変わらないので単一としてとらえることができる。 1n Kpのa12を式1から直接、awを式2から0.108093を掛けて1n awの係数を6に等しくした後に代入している。 Kpは組成に依存しないので、
![]()
式1、2から必要な代入を行い、次に平均値m=3.を代入すると明らかである。3835を表1の最初の2本から代入すると、式1の6つの未知の係数を解くための1つの式が得られ、残りの5つの式は、表2のAlCl3の平均イオン活量係数y12の5つの実験値をそれぞれ
![]()
に代入して、その結果を式1に代入して得ることができる。 こうして得られた6つの連立方程式をコンピュータで解く。 その結果、
C = -57.5723,
D = +142.0288,
E = -202.5581,
F = +161.1919,
G = -67.7831,
and H = +11,6880.
これらの値を式1、2、4に代入するとY12、Aw、Kpの値が求まる。 その結果を表3の “Bureau results: “の見出しに記載した。 ここで、水の活量は式2から、溶液上の水の蒸気圧Pは
aw = P/P°,……(7)
ここでP°は同じ温度での純水の蒸気圧であることから計算できることに注意する必要がある。 なお、飽和溶液の水の蒸気圧はaw=0.509なので、純水の蒸気圧の半分強となる。
注-この表でmはAlCl3のモル数、nはHClのモル数、モル数は水1kg中のモル数である。
Estimation of Activities in AlCl3-6H2O-H2O system
AlCl3-6H2O-H2O systemにおける活性を求めるために、既存の2つの信頼できる推定方法を用いて、既存の直接実験データを超えてm=1.8における活性を求めることができる。 最初の方法はKusikとMeissnerによって記述されたもので、3.3835mでγ12=9.94の推定値を与えた。この推定値は今回の調査で得られた値である10.251とほぼ一致する。 また、水の活量awの推定値は0.47であり、これも本研究で得られた0.509とほぼ一致した。 これらの値から計算される平衡定数Kpは、a12の4乗とawの6乗を掛けてKpを求めることを考えると、6.8×10 5から遠くない。
Bromleyによる第2の推定法ではγ12が10.42となり、先の方法で得られた値より近い値となった。 水の活量係数はブロムリー法で推定したa12の値を用いてGibbs-Duhem方程式を積分することにより、筆者らが求めた。 その結果、aw = 0.540となった。 両者の平均は0.505であり、Bureauの値0.509と非常によく一致する。 しかし、Bromley法にはKusik-Meissner法に含まれるawを簡便に決定する方法は含まれていない。
推定値と溶解度データからの値の一致は、どの組成の電解質でもここに示すように必ずしも良好ではない。 例えば、1mのAlCl3でも、γ12の二つの推定値は互いに13%しか違わない。
Solubility product and activities in AlCl3-6H2O-HCl-H2O system
HCl濃度の増加による塩の溶解度の影響は主に塩素イオン濃度の増加によるもので、HClの濃度が高いほど溶解度は高くなる。 この場合の個々のイオンの活性a1、a2による平衡定数は
![]()
ここで、個々のイオン活性γ1(Al+++の場合)、γ2(Cl-)からγ12を定義するとγ12=γ1γ2、nはHClのモル数である。 Kpの値は式4と同じであるが、式8の右辺は式4と異なっている。 なお、nが大きくなると、γ12とawが大きく減少しない限り、Al+++の濃度であるmは減少するはずなので、塩が析出する、いわゆるsalt out効果である。 HClのデータは広い濃度範囲で正確に分かっているので、いくらでも変数の多い方程式をとることができる。 以下の式は、HClの活性係数γ32のデータを正確に表したもので、添え字の3はH+、2はCl-を表す:
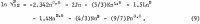
この目的のためにHaase、Naas、Thutnmから選んだデータは表2の3行目と4行目に掲載されています。 これらのデータから計算した係数の値は、
J = -1.88416,
K = +2.24342,
L = -1.98545,
M = +1.00091,
N = -0.25934,
and P = +0.02634 といったものだ。
AlCl3の活性とH2Oの活性の式には、これらの係数のほかに、hとkを整数としたときの交積(m h/2)(n k/2)の係数が含まれており、これらの式は次のとおりである。
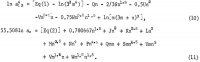
これらの式中の5つの追加係数は、式10と式11からの6つの1n awを加えて1n Kpを求め、表1からの以下の選択した溶解度データ:
m:2.620, 2.016, 1.333, 0.953, 0.535.
n: 2.581, 4.460, 6.780, 8.397, 10,063.
計算の結果、方程式10と11の係数は次の値を得た:
Q = +23,27027,
S = -22.47064,
U = +4.29102,
V = -9.76081,
and W = +4,60246.
前記式から計算したγ12、a12、awおよびKpの結果を表3に示す。
溶液中のHCl(g)の分圧P32は、次の式(4)から計算できる:
Kp(HCl)= 4.94 x 10 -7 = P32/a²32……(12)
ここで、Kp(HCl)はH+ + Cl- = HCl(g)の25℃における平衡定数、a32は溶液中のHClの平均イオン活性を表します。 このためには、別のところで詳しく示したように、式11のパラメータを用いて、式10と同様のa32の式を書く必要がある。
表1に示すように、塩の溶解度に対する温度の影響は小さい。 アルミニウム分析の実験誤差が±0.01wt-pctより小さければ、式11のパラメータはすべて溶解度のデータから求めることができたので、イオン活性への影響は小さいと予想される。 一般に約80℃までの温度範囲では、各パラメータは温度の一次関数であり、この依存性は25℃より少なくとも50℃高い別の温度で式11が分かれば決定できる。
AlCl3-6H2O-HCl-H2O 系における活性の推定
Kusik と Meissner が考案した方法により本報告で推定した活性、活性係数および溶解度積の数値を表 3に示す。 AlCl3の活量係数γ12は、HClを含む選択溶液の推定値の約2倍である。 しかし、水の活量awは、m=2.620を除いて推定値とよく一致した。 なぜなら、水の蒸気圧 aw は Kp に aw として入り、aw のわずかな誤差が γ12 と Kp に大きな誤差を与えるからである。
表3に示した熱力学的性質の温度依存性は、KusikとMeissnerの記述にしたがって推定することができる。 しかし、この推定では溶解度の弱い温度依存性で示される温度依存性よりも高い温度依存性が得られると思われる。 (1) AlCl3の低濃度におけるa12が様々な温度で知られていない、(2) AlCl3の溶解度がAl+++で0.01 pctに近い精度で決定できない、(3) 65°および85°CにおけるHClの濃度範囲が、式10および11のパラメータを正確に決定するためにAlCl3の広く異なる溶解度データを十分に多く選択するには小さすぎる、という理由で局の方法によって温度の影響を算出する試みは行われなかった。
AlCl3-FeCl3-KCl-NaCl-HCl-H2O System
AlCl3, FeCl3 , KCl, NaClの25℃、24〜31 wt-pct HCl含有水溶液に対する溶解度の予備データを得て、非ボーキサイト鉱から抽出できる AlCl3-6H2O への汚染度を評価した。 このため,既知の量の塩を含む水溶液を2リットル調製し,各運転ごとにこの水溶液90mlをフラスコに入れ,その後,既知の量のガス状HClを溶解HClが24から31wt-pctとなるように入れた。 この範囲のHCl溶液では、AlCl3・6H2Oの無色異方性結晶、FeCl3・2KCl・H2Oの明るい異方性結晶、KClとNaClの立方体等方性透明結晶が析出し、顕微鏡観察で確認された。 アルミニウムイオンと塩化物イオン濃度の測定手順と分析は、この報告で先に紹介したAlCl3-6H2O-HCl-H2O系で用いたものと同じであった。 また、鉄イオン濃度は標準K2Cr2O7滴定により、ナトリウムイオン濃度は原子吸光法により、カリウムイオン濃度はイオン交換による分離後のカリウムイオンとナトリウムイオンの合計濃度からナトリウムイオン濃度を差し引くことにより決定された。 その結果を表4に示し、図3にプロットした。 Milesによる同様の結果も図3にプロットされ、優れた一致を示している。
純粋な塩化アルミニウム六水和物を製造するための蒸発法または塩酸ガススパージング晶析法では、浸出溶液中の不純物レベルが上昇すると、他の金属塩化物による汚染が問題となる。 図3は、NaCl、KCl、FeCl2-2KCl-H2Oなどの不純物も別相として溶液から結晶化し、AlCl3-6H2O結晶を汚染する濃度を示したもので、NaCl、KCl、FeCl2-2KCl-H2Oなどの不純物は結晶化しにくい。 例えば、25℃で1.6wt-pctのKClの存在下で2.4wt-pct以下のFeCl3では、複塩であるFeCl3-2KCl-H2OによるAlCl3-6H2Oの汚染を避けるためにHCl濃度は28wt-pct以下でなければならない。 また、図3は、アルミニウム塩を精製するための析出物分別再結晶の再溶解にも有効である。 さらに、FeCl3のような遷移元素塩の一部は、HClで酸性化する前に部分的に電解して十分な量の鉄をプレートアウトすることで最小化できる。
H2O(g)およびHCl(g)の蒸気圧データがない場合、塩素イオン濃度の通常の誤差±0.05 wt-pct で系の熱力学的処理を実行不可能である。 しかし、Kusik-Meissner法により大まかな活性を見積もることは可能である。

研究対象分野
活性の測定は、各種鉱石中の所望成分の溶出・沈殿・精製の熱力学・動力学を解釈する上で有用であり、また、そのような熱力学・動力学に基づく活性測定は、鉱石中の所望の成分の溶出、沈殿、精製を行う上で有用である。 水の蒸気圧の測定値から活性度を正確に求めることができる理由は2つある。 (1)水の蒸気圧を差圧計で高精度に測定し、式7でawを求め、式11のパラメータ値を計算することにより、先に詳しく述べたようにすべての関連特性を計算できる。 (2)水和結晶中に多数の水分子を含む多価塩では溶解度積も活性も正確に求めることができる。 第二の理由は、式4の水の活量の指数が水和結晶中の水のモル数に等しいことから生じる。
塩酸水溶液中の塩化アルミニウム
ここで論じた三元系に関するもう一つの興味深いタイプの実験は、十分に多量の塩酸が溶解している種々の溶液上の塩酸(g)の分圧を測定するものである。 この目的のための実験手順は別のところに記載されている。
米国内務省鉱山局の低品位国内資源からのアルミナ回収のための鉱物処理技術改良研究の一環として、塩化アルミニウム六水和物、AlCl3-6H2Oの水溶液中での溶解度と活性を測定した。 純水に対するAlCl3の溶解度は、25℃および85℃においてそれぞれ31.09および31.77 wt-pctであり、溶液中にそれぞれ20.3および37 wt-pctの塩酸(HCl)を添加すると10および0.1 wt-pctに急激に減少することが判明した。 AlCl3およびH2Oの六水和物の溶解度、活性、および活性係数の平衡定数を計算し、利用可能な推算方法による結果と比較した。 この結果は、HClの添加により成分塩の溶解度が変化し、アルミナ抽出のための非ボーキサイト鉱石の浸出に有用であることを示した。
HCl-H2O 溶液中の AlCl3 , FeCl3 , KCl , NaCl の同時溶解度も求め、混合塩溶液から結晶化した AlCl3-6H2O の純度への影響についても簡単に論じた。