INTRODUCTION
右室流出路(RVOT)に由来する早発性心室収縮(PVC)は通常構造心疾患がない患者で出現します。 孤立性または絶え間ないPVC、または頻脈(特発性心室頻拍の80%まで)の形で現れることがある。 主な原因メカニズムは誘発性活動であるが、リエントリーまたは異常自動性メカニズムも想定されている。
患者は通常、運動、ストレス、または刺激物の使用に関連した症状を呈する。
β遮断薬やベラパミルは、このタイプのPVCを制御する上で、通常、限られた効果しか示さない。 ラジオ波焼灼術は有効であるが、このタイプのPVCは限定的で予測不可能な誘発性を持つという事実が妨げとなっている。 この論文では、Ensite Array NCMS (St. Jude Medical, St. Paul, Minnesota, United States)を用いたRVOT PVCアブレーションについて説明する。 このシステムは、7.5mlのバルーンと64個の微小電極を備えた多電極アレイカテーテル(MAC)を使用して、頻拍の位置を特定するものである。 MACは1回の拍動から同時に3000以上の仮想単極性電図を提供し、関心領域から3次元画像で表示する。
方法 患者の特徴
2006年1月から2009年12月の間に、構造心疾患を持たないが症状の絶えないRVOT PVC患者4名にNCMSによるアブレーションが施行された。 患者の平均年齢は43±6歳で,50%が男性であった。
全員が症候性の高い頻繁なPVC(平均30 763±4710 PVC/日)によりQOLが不良であった。 全員、少なくとも2種類の抗不整脈薬が無効で、そのうち1種類は常にβブロッカーであった。 アブレーションは2名の患者において従来型のシステムで試みたが、成功しなかった。
すべての患者において、手術当日の期外収縮活動は乏しかった。 電気生理学的検査
4mmアブレーションカテーテル(Livewire TC, St. Jude Medical)を右心室(RV)に留置した。 イソプロテレノールの注入や心室ペーシングを行ってもactivation mappingを行うのに十分なPVCを達成できない場合は、MACを導入した。
MACは0.035″ガイドワイヤー上で透視しながら進め、バルーンは肺動脈弁から2~3cmのRVOTに留置した。 この時点でヘパリンによる抗凝固療法が開始された。 その後、RVOTと肺動脈弁の状況に注意を払いながら、RVの解剖学的構造を再構築した(図1)。 1323>
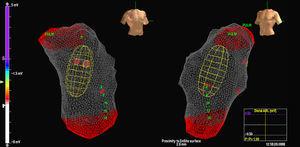
図1.肺動脈瘤の距離。 右室流出路の多電極アレイカテーテルの画像。
その後、患者が提示したPVC形態ごとに3回の期外収縮拍を解析し、オフラインで等ポテンシャルマップと等クローンマップを取得した。 3085>アイソポテンシャルマップは、最大電圧振幅の領域を用いて活性化を動的に表し、波面の移動の様子を示している。 最も早い活性化ポイントは、QRS発症に関して最も早い活性化を示すポイントとして定義され、単極性エレクトログラム上で急速な負の偏向を伴うQS形態を示す。 また、等ポテンシャルマップは、心筋の他の部分に波が広がる前の波面の開始点を同定するものである。 アイソクローンマップは従来の心内膜表面の活性化時間のマップであり、仮想のユニポーラ信号を用いる。
アブレーションのターゲットは、最も早い活性化の領域と活性化フロントの開始点の両方であった。 高周波はこれらの部位に時折適用され、温度制御は50W、温度は55℃以下、時間は60秒に制限された。 3085>すべての処置は同じ電気生理学者によって行われ,NCMSを操作するエンジニアを指揮した。<1323>結果<3085>3人の患者は単一のPVC形態であり,1人の患者は2つの形態であった。 発生部位は3例が中隔,2例がRVOTの自由壁であった。 すべての症例において、最も正確に起始点を特定できたのは等ポテンシャル図(図2)であり、等クローン図(図3)はあまり意味がなかった(<1323><7838><7838><841><863><863> <863><3085>図2. 右室流出路から発生した2種類の心室性期外収縮を有する患者の等電位マップ。 各出口はEX(1、2)の文字で表している。 最も早い活性化点はEX1で、仮想一極のQSの像(下)と共に示す。
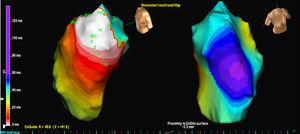
図3. 図1で解析したものと同じ心室性期外収縮のEX1出口のアイソクロン・マップ。 白は最も早い活性化、紫は最も遅い活性化を示す。
また、すべての症例で、PVCが機械的に引き起こされたものではなく、臨床的PVCの形態と一致することを確認した。
発生部位を特定した後、1焦点あたり平均3回の高周波照射を行い、最も早い活性化点と活性化フロントの開始点の両方を焼灼することに成功した。 平均印加時間は113±15秒であった。
平均透視時間は31±11分(21-46)、総手技時間は136±38分であったが、学習曲線に沿って減少し、最初の手技では190分、4回目では100分となった。 平均30±16ヶ月後、患者は薬物治療なしで無症状を維持し、1年後のフォローアップ訪問時のホルターモニターでは、PVCの平均数は159±113/日であった
考察
他の著者はRVOT PVCを切除するためのNCMSの有用性を示しているが2、3 その使用は普及していない4 我々の経験では、最初のケースから優れた結果が得られていた。 RVOT心室頻拍のアブレーションでは通常80%以上の成功率が報告されているが5、我々は孤立性PVCしかマッピングできなかったにもかかわらず、より高い成功率を達成した。 急性期エンドポイントはPVCの消失であったが、手技中のPVC発生頻度が低かったため、その限界はあった。
我々の患者における不整脈は局所的な起源を持ち、これは他の著者による観察と一致する。
アブレーションは最も早い活性化のポイントに限られ、これが高い成功率に寄与したと思われる。 他の同じPVCをマッピングして位置を確認することが望ましいが、起始部位を変更することはなかった。
このシステムの限界の1つは、心内膜ではなく、心外膜や別の付属室に位置する場合でも、探索した室の心内膜に最も早い活性化点を位置づけることである。 このような場合、心内膜の最早点がrSを示すので、仮想単極解析は起源がRVの心内膜にないことを示すのに役立つ<1323><3085>さらに、MACは機械的PVCを生じ、RVOTに位置するため、臨床PVCと混同されることがある。 鑑別のため、臨床的PVCとの心電図上の対応関係を解析し、PVCの発生点がバルーンに接触していないことを確認した。 我々のシリーズでは,NCMSは孤立した誘発困難なRVOT PVCを除去する効果的で安全な手段であることが証明され,関連する手技の複雑さを軽減するのに役立った。
謝辞Joaquín Panduro氏による原稿の重要なレビューに感謝します
Received 21 January 2011
Accepted 1 May 2011
Received 21 January 2011
Accepted 1 May 2011