- 1 機能
- 2 ヒト乳酸脱水素酵素
- 2.1 構造
- 2.2 触媒
- 2.3 動態
- 2.3.4 制御
- 3 乳酸脱水素酵素の立体構造
機能
L-lactate dehydrogenase (L-LDH) はピルビン酸およびNADH+をL-乳酸およびNAD+に相互変換する触媒である.
H-乳酸デヒドロゲナーゼ(H-LDH)は、D-乳酸とフェリチトクロムcからピルビン酸とフェロチトクロムcへの相互変換を触媒する。 体内の様々な部位に存在し、それぞれの部位で異なるサブユニットが固有のコンフォメーションを持っています。 LDHは嫌気性呼吸における重要な酵素である。 嫌気性呼吸とは、酸素がない状態での呼吸のことです。 この経路は、主に2つの点で解糖に重要である。 第一は、もしピルビン酸が解糖を蓄積することになれば、ATPの生成が遅くなるということである。 第二は、嫌気性呼吸によりNADHからNAD+が再生されることである。 NAD+は、解糖においてグリセルアルデヒド-3-リン酸デヒドロゲナーゼがグリセルアルデヒド-3-リン酸を酸化し、NADHを生成する際に必要とされるものである。 乳酸脱水素酵素は、嫌気性でNADHをNAD+に変換する役割を担っている。Cryptosporidium parvum由来の乳酸脱水素酵素(4nd4)において。ヒト乳酸脱水素酵素
構造
は、MとH(Muscle and Heart)という二つのサブユニットの組み合わせで、サブユニットの四つの構造に形成される四級タンパク質である。 人体に見られる様々な組み合わせがある。
- (4H) Heart
- (3H1M) Reticuloendothelial
- (2H2M) Lungs
- (1H3M) Kidne
- (4M) Muscle and Liver
ここで示したLDHの構成はαヘリックス40%、βシート23%であったが、αヘリックスが減少し、βシートは減少した。 SCOPのデータでは、この形態の乳酸脱水素酵素はβ-α-βの混合型に分類され、主に平行なβシートで構成されている。
- Human Lactate Dehydrogenase
Jasper Lactate Final
- Rossmann foldも参照されたい。
触媒反応
研究により、LDHの反応機構は秩序ある順序に従っていることが示されている。
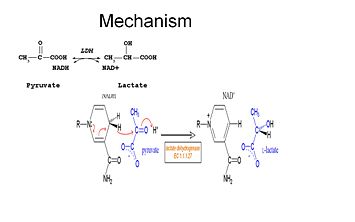
乳酸が酸化するためには、まずNADHが酵素に結合し、続いて乳酸に結合しなければなりません。 . NADHが酵素に結合すると、次に乳酸が結合できる(基質のオキサメートを示す;-CH3基が-NH2に置き換わってオキサメートが形成される)。 乳酸は、ニコチンアミド環といくつかのLDH残基の間で酵素に結合する。 最後にピルビン酸は酵素から解離し、NAD+が続く。
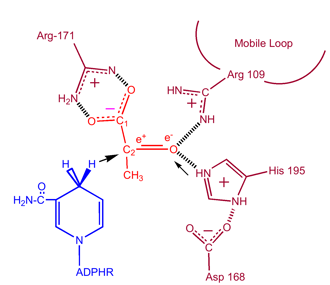
キネティックス
シュウ酸およびオキサミン酸(乳酸およびピルビン酸の構造類似体)による乳酸脱水素酵素のキネティックス研究は、上記のメカニズムを実証している。 この反応では、NAD+とNADHの解離速度が律速段階となる。 ピルビン酸の乳酸への変換とそれに続くNAD+の再生は非常に好ましい。
制御
メカニズムは平衡の一つであるので、乳酸脱水素酵素に特別な制御はないようで、代わりに嫌気性修復の活性化とピルビン酸とNADH、または乳酸とNAD+の存在に依存している。
乳酸脱水素酵素の立体構造
Lactate dehydrogenase 3D structures
