一般名:リドカイン塩酸塩
剤形:内用液
Rxのみ
口腔と咽頭粘膜用局所麻酔剤です。
市販後、リドカイン粘性2%を用法・用量に忠実に投与しなかった場合に、3歳未満の患者における痙攣、心肺停止、死亡例が報告されています。 歯痛の場合、リドカイン粘性2%は一般的に使用しないでください。 その他の症状については、3歳未満の患者への使用は、より安全な代替品がない場合、または試みたが失敗した場合に限定する必要があります。
リドカイン粘性2%の使用による重篤な有害事象のリスクを減らすために、介護者に処方された用量と投与回数を厳密に守り、処方ボトルを子供の手の届かないところに安全に保管するよう指導してください。
DESCRIPTION
Lidocaine Viscous 2%(Lidocaine Hydrochloride Oral Topical Solution USP)は局所麻酔剤を含み、局部に投与されるものです。 Lidocaine Viscous 2% (Lidocaine Hydrochloride Oral Topical Solution USP) は、化学的には acetamide, 2-(diethylamino)-N-(2,6-dimethylphenyl)-,monohydrochloride と呼ばれ、次の構造式を有するリドカイン塩酸塩を含んでいます:
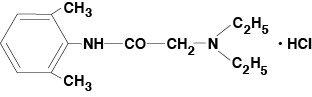
リドカインの分子式は C14H22N2O です。 分子量は234.34です。
溶液の組成:
1mLあたり20mg(2%)のリドカイン塩酸塩USPと次の不活性成分を含みます:カルボキシメチルセルロースナトリウム、香料、メチルパラベン、プロピルパラベン、精製水、サッカリンナトリウム。
リドカイン外用液-臨床薬理
作用機序
リドカインはインパルスの開始と伝導に必要なイオンフラックスを阻害して神経膜を安定化し、それによって局所麻酔作用を発揮する。
血行動態
過度の血中濃度により心拍出量、全末梢抵抗および平均動脈圧に変化が起こることがあります。 これらの変化は、心血管系のさまざまな構成要素に対する局所麻酔薬の直接的な抑圧作用に起因するものと思われる。
薬物動態と代謝
リドカインは粘膜への局所投与により吸収され、その速度と範囲は投与された濃度および総量、特定の適用部位、および曝露時間に左右される。 一般に、局所麻酔薬の吸収速度は、気管内投与後に最も速く起こる。 リドカインは消化管からもよく吸収されるが、肝臓で生体内変換されるため、無傷の薬物はほとんど循環に現れない。 リドカインの血漿結合は薬物濃度に依存し、結合率は濃度の上昇とともに減少する。 1mLあたり1~4mcgの遊離基の濃度では、リドカインの60~80%がタンパク質と結合しています。
リドカインは血液脳関門および胎盤関門を通過し、おそらく受動拡散によって通過する。
リドカインは肝臓で急速に代謝され、代謝物および未変化体は腎臓から排泄される。 生体内変換には、酸化的N-脱アルキル化、環状水酸化、アミド結合の切断、および抱合などがある。 N-脱アルキル化により、モノエチルグリシネキシルイミドおよびグリシネキシルイミドが生成される。 これらの代謝物の薬理・毒性作用は、リドカインと類似しているが、リドカインより作用が弱くなる。 投与されたリドカインの約90%は様々な代謝物の形で排泄され、未変化体は10%未満です。 尿中の主な代謝物は4-ヒドロキシ-2、6-ジメチルアニリンの抱合体である。
静脈内ボーラス注射後のリドカインの排泄半減期は通常1.5~2時間である。 リドカインの代謝速度が速いため、肝機能に影響を与えるあらゆる状態がリドカインの動態を変化させる可能性があります。 半減期は、肝機能障害のある患者では2倍以上延長されることがあります。 腎機能障害はリドカインの動態に影響を与えませんが、代謝物の蓄積を増加させることがあります。
アシドーシス、中枢神経刺激剤および抑制剤の使用などの要因は、明白な全身性効果をもたらすために必要なリドカインの中枢神経レベルに影響を及ぼします。 客観的な有害事象は、静脈血漿濃度が1mLあたり6mcg遊離塩基を超えると、次第に明らかになる。
リドカイン局所内用液の適応と使用
リドカインは、口と咽頭の炎症または粘膜の局所麻酔のために示されます。
禁忌
リドカインは、アミド系の局所麻酔薬、または溶液の他の成分に対して過敏症の既知の病歴を持つ患者には禁忌とされています。
警告
過度の投与、または投与間の短いインターバルは、高い血漿レベルおよび重大な副作用をもたらす可能性があります。 患者には、この添付文書に記載されている推奨用量および投与ガイドラインを厳密に遵守するよう指導してください。 重篤な有害反応の管理には、人工呼吸器、オキシジェン、その他の人工呼吸薬の使用が必要な場合があります。
リドカインは、適用部位の粘膜に外傷がある場合は、そのような状況では全身に急速に吸収される可能性があるので、細心の注意を払って使用する必要があります。
乳幼児における生命を脅かす事象および致死的事象
市販後、リドカインビスカス2%の使用において、用量・投与法の勧告を厳密に守って投与しなかった場合、3歳未満の患者における痙攣、心肺停止、死亡の事例が報告されています。 歯痛の場合、リドカイン粘性2%は一般的に使用しないでください。 その他の症状については、3歳未満の患者への使用は、より安全な代替手段がない場合、または試みたが失敗した場合に限定する必要があります。 すべての患者がメトヘモグロビン血症のリスクにあるが、グルコース-6-リン酸脱水素酵素欠損症、先天性または特発性のメトヘモグロビン血症、心臓または肺の障害、6ヵ月未満の乳児、酸化剤またはその代謝物への同時暴露の患者は、この症状の臨床症状を発現しやすい。
メトヘモグロビン血症の徴候は、曝露後すぐに起こることもあれば、数時間遅れて起こることもあり、チアノーゼ色の皮膚変色および/または血液の異常な色調によって特徴づけられる。 メトヘモグロビン値は上昇し続ける可能性があります。したがって、発作、昏睡、不整脈、死亡など、より深刻な中枢神経系および心血管系の副作用を回避するために、早急に治療が必要です。 リドカイン粘性2%およびその他の酸化剤を中止してください。 徴候および症状の重症度により、患者は酸素療法、水分補給などの支持療法に反応する場合があります。
使用上の注意
患者への情報
保護者の方は以下のことに注意してください:
– 3歳未満の患者には、規定量を正確に測定し、規定以上の回数を投与しないよう特に注意しなければならない。 – 正確さを期すため、測定器を使用して慎重に正しい量を測定することをお勧めします。 – 本製品は、定められた適応症にのみ使用すること。 – 誤飲のリスクを減らすために、製品の容器はしっかりと閉め、使用後は直ちにすべての子供の手の届かないところに十分に保管すること。 – 患者が全身毒性(嗜眠、浅い呼吸、痙攣等)の兆候を示した場合は、直ちに救急医療を受けさせ、製品の追加投与は行わないこと。 – 未使用の製品は、子供やペットが触れる可能性のない方法で廃棄してください。
局所麻酔剤を口腔内又は咽喉に使用する場合、局所麻酔の生成により嚥下が阻害され、誤嚥の危険性が高まることをすべての患者が認識する必要がある。 このため,口腔内または咽喉部への局所麻酔薬の使用後60分間は,食物を摂取してはならない。
舌や頬粘膜のしびれは、咬傷の危険性を高めることがある。
局所麻酔薬の使用は、メトヘモグロビン血症(速やかに治療しなければならない重篤な状態)を引き起こす可能性があることを患者に伝えてください。 患者または介護者が次の徴候または症状を経験した場合、直ちに医師の診察を受けるよう助言してください:青白い、灰色、または青い色の皮膚(チアノーゼ);頭痛;速い心拍;息切れ;ふらつき;または疲労。
一般
リドカインの安全性と効果は、適正量、正しい技術、十分な予防措置、緊急時の対応によります(警告および有害反応の項を参照)。 高い血漿濃度および重篤な副作用を避けるため、効果的な麻酔をもたらす最低量を使用する必要があります。 リドカインの反復投与は、薬物および/またはその代謝物の緩やかな蓄積のため、反復投与ごとに血中濃度の著しい上昇を引き起こす可能性があります。 耐性は、患者の状態によって異なります。 衰弱した、高齢の患者、急性疾患の患者、および小児は、年齢、体重、および身体状況に見合った量を減量して投与する必要があります。
リドカインは、既知の薬物過敏症患者には注意して使用されるべきです。 パラアミノ安息香酸誘導体(プロカイン、テトラカイン、ベンゾカインなど)に対するアレルギー患者は、リドカインに対する交差感受性を示しません。
薬物相互作用
局所麻酔薬を投与された患者は、他の局所麻酔薬を含む可能性のある以下の薬剤に同時に曝露されると、メトヘモグロビン血症を発症するリスクが高まる:
メトヘモグロビン血症と関連する薬剤の例。
|
Class |
例 |
||||
|
Nitrates/Nitrites |
nitroglycerin.NI |
Nitroglycerine.Nitrate |
|||
|
局所麻酔薬 |
ベンゾカイン、リドカイン。 ブピバカイン、メピバカイン、テトラカイン、プリロカイン、プロカイン、アルチカイン、ロピバカイン |
||||
|
抗悪性腫瘍剤 |
シクロホスファミド。 フルタミド、ラスブリカーゼ、イホスファミド、ヒドロキシウレア |
||||
|
抗生物質 |
ダプソン。 スルホンアミド、ニトロフラントイン、パラアミノサリチル酸 |
||||
|
抗マラリア薬 |
クロロキン。 プリマキシン |
||||
|
抗けいれん薬 |
|||||
|
その他の薬剤 |
アセタミノーフェン, メトクロプラミド、スルファサラジン、キニーネ |
発がん性、変異原性、生殖能力への影響
発がん性、変異原性、生殖能力への影響について動物におけるリドカインの研究は行われていない。
妊娠
催奇形性
妊娠カテゴリーB:ヒト用量の6.6倍までの用量でラットの生殖研究が行われ、リドカインによる胎児への有害性の証拠は明らかにされていません。 しかし、妊娠中の女性における適切でよく管理された研究はありません。 動物繁殖研究は必ずしもヒトの反応を予測するものではないため、本剤は明らかに必要な場合にのみ妊娠中に使用されるべきである。
授乳婦
本剤がヒト乳汁中に排泄されるかどうかは不明である。 多くの薬剤が母乳中に排泄されるため、リドカインを授乳婦に投与する場合は注意すること。
小児用
小児への投与は、年齢、体重、身体状況に応じて減量すること。
副作用
リドカイン投与後の副作用は、他のアミド系局所麻酔薬で観察されるものと同様の性質を持っています。 これらの有害事象は一般的に用量に関連しており、過剰投与または急速な吸収による高い血漿レベル、あるいは患者側の過敏性、特異性、耐性の低下から生じる可能性があります。 重篤な有害事象は、一般的に全身性のものです。
中枢神経系
中枢神経系の症状は興奮性または抑制性で、ふらつき、神経質、不安、多幸感、混乱、めまい、眠気、耳鳴り、目のかすみや複視、嘔吐、熱感、冷感または麻痺、ひきつけ、震え、けいれん、意識不明、呼吸抑制および停止が特徴である場合があります。 興奮性の発現は非常に短いか、または全く発現しないこともあり、その場合、毒性の最初の発現は、意識喪失および呼吸停止に合併する眠気である。
リドカイン投与後の眠気は、通常、本剤の血中濃度が高いことの初期徴候であり、急速な吸収の結果として起こることがある。
心血管系
心血管系の症状は通常抑圧的で、徐脈、低血圧、心血管系虚脱が特徴で、心停止に至ることもある
アレルギー
アレルギー反応は、皮膚病変、じんましん、浮腫またはアナフィラクトイド反応によって特徴づけられる。 アレルギー反応は、局所麻酔剤、本剤に配合されているメチルパラベンおよび/またはプロピルパラベンに対する過敏症の結果として生じることがあります。 リドカインに対する感受性の結果としてアレルギー反応が起こることは極めてまれであり、もし起こったとしても通常の方法で対処する必要があります。
過量投与
局所麻酔薬による急性緊急事態は、一般に局所麻酔薬の治療使用中に遭遇する高い血漿濃度に関連している。 (副作用、警告、注意を参照)
局所麻酔薬の緊急事態の管理
最初に考慮すべきは予防で、局所麻酔薬の投与ごとに、心血管および呼吸器のバイタルサインと患者の意識状態を慎重かつ常に監視することが最も効果的です
痙攣の管理における最初のステップは、気道確保と酸素による補助または制御換気に直ちに注意を払うことです。 訓練を受けた職員がすぐに利用できる状況では、換気を維持し、マスクによる即時気道陽圧を可能にする送達システムによって酸素を供給すべきである。 これらの換気措置を行った直後に、循環の妥当性を評価する。痙攣の治療に使用する薬物を静脈内投与した場合、循環が抑制されることがあることを念頭に置く。 十分な呼吸補助を行ってもけいれんが続く場合、循環動態が許せば、超短時間作用型バルビツール酸塩(チオペンタール、チアミラールなど)またはベンゾジアゼピン(ジアゼパムなど)を少量ずつ静脈内投与することができる。 臨床医は、局所麻酔薬を使用する前に、これらの抗痙攣薬についてよく理解しておく必要がある。 循環器系抑制の支持療法には、静脈内輸液の投与と、適切な場合には、臨床状況に応じて血管拡張薬(例えば、エフェドリン)の投与が必要である。
直ちに治療しない場合、けいれんおよび循環器系抑制はともに、低酸素、アシドーシス、徐脈、不整脈および心停止を引き起こす可能性がある。
リドカインの急性過剰摂取の治療において、透析は無視できるほどの価値しかない。
非絶食雌ラットにおけるリドカインの経口LD50は459(346~773)mg/kg(塩として)、絶食雌ラットでは214(159~324)mg/kg(塩として)であった。
用法・用量
成人
健康な成人に対するリドカインの最大推奨単回投与量は、リドカインの投与量が4.を超えないようにする必要がある。5mg/kgまたは2mg/lb体重を超えず、いかなる場合も合計300mgを超えない。
口や咽頭の粘膜の刺激や炎症の対症療法には、通常成人では15mLを原液で投与する。 口腔内に使用する場合は、溶液を口腔内で振り回した後、吐き出させる。 咽頭への使用は、原液をうがいをし、飲み込んでもよい。 本剤の投与間隔は3時間以内とし、24時間以内に8回を超えて投与しないこと。 また、患者の年齢、体重、身体状況に応じて投与量を調節すること(「注意事項」参照)。
小児
不適切な投与による過剰摂取の例があるため、すべての小児患者において正しい投与量を確保するよう注意しなければならない。
どの薬剤の最大量も年齢と体重によって異なるため推奨が困難である。 除脂肪体重が正常で、体の発育が正常な3歳以上の小児では、最大投与量はその小児の体重または年齢によって決定されます。 例えば:体重50ポンドの5歳の子供の場合、リドカインの用量は75~100mg(リドカイン3.7~5mL)を超えてはならない。
乳児および3歳未満の子供の場合、溶液を正確に計量し、1.2mL以上は綿棒の先ですぐそばに塗らないようにしなければなりません。 次の投与は3時間以上あけてから行い、12時間以内に4回まで投与できる。
HOW SUPPIED
リドカインビスカス2%(リドカイン塩酸塩経口外用液USP)
2%経口外用液は無色透明、粘性の溶液として提供される。
NDC 0054-0548-44: スクイズボトル 20 mL
NDC 0054-3500-49: スクイズボトル 100 mL
20°~25°C (68°~77°F) で保存してください。
USP/NFに定義されているように、子供用耐熱容器で分注します。
SHAKE WELL BEFORE USE.DISTR.BY.DISTR:
Distr.by: West-Ward
Pharmaceuticals Corp.・・・・・・・・・・・・。
Eatontown, NJ 07724
Revised October 2018
パッケージ/ラベル表示パネル
NDC 0054-3500-49 Lidocaine Viscous (Lidocaine Hydrochloride Oral Topical Solution USP) 100mL

Package/Label Display Panel
NDC 0054-0548-44 リドカインビスカス(塩酸リドカイン内用液USP)15mL

| リドカインビスカス 塩酸リドカイン内用液 |
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
| Lidocaine VisCouS lidocaine hydrochloride 溶液 |
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
ラベラー – (順不同 西日本製薬(株) (080189610)
| 設立 | |||
| 氏名 | 住所 | ID/FEI | 業務 |
| West-Ward Columbus Inc. | 058839929 | MANUFACTURE(0054-3500, 0054-0548) | |
Medical Disclaimer