Se llevó a cabo un programa de investigación para mejorar la tecnología de procesamiento para la extracción de alúmina a partir de materiales no bauxíticos. El éxito de este programa había proporcionado la tecnología necesaria para producir un suministro adecuado de alúmina de alto grado a partir de fuentes nacionales, satisfaciendo así las necesidades económicas y estratégicas nacionales relativas a la producción de aluminio. El proceso de ácido clorhídrico para la recuperación de alúmina a partir de minerales de baja calidad es uno de los procesos que se investigan en el programa de investigación.
Una fase de este proceso utiliza el efecto de la concentración de iones cloruro en la solubilidad del ion aluminio en la solución. A 25° C, la solubilidad del AlCl3 en agua pura es de aproximadamente 31 pct en peso, y disminuye con el aumento de la concentración de ácido clorhídrico (HCl), llegando a ser de 0,1 pct cuando la concentración de HCl se incrementa a 37 pct. Este comportamiento ha sido objeto de numerosas investigaciones, procesos y patentes. Así, es posible lixiviar un mineral no bauxítico con HCl, decantar y filtrar el licor y añadir HCl gaseoso para precipitar AlCl3-6H2O. La solución ácida restante puede utilizarse para la lixiviación de otros minerales y el AlCl3-6H2O precipitado puede calcinarse para obtener Al2O3 . Peters, Johnson y Kirby presentan una amplia discusión y evaluación de este proceso. Los datos termodinámicos, como las actividades iónicas y las solubilidades, necesarios para el análisis completo, la interpretación y la mejora de este proceso son escasos, y los datos de solubilidad existentes se limitan a un estrecho rango de temperatura. Por lo tanto, los objetivos de esta investigación fueron (1) determinar la solubilidad del AlCl3, en un rango de temperatura de 25° a 85° C con una concentración de HCl de 0,0 a 372 pct; (2) calcular las actividades de AlCl3 y de H2O en soluciones que contienen varios electrolitos , y la constante de equilibrio para la disolución de AlCl3-6H2O; y (3) sugerir áreas de investigación para generar datos útiles.
- Aparato
- Procedimiento experimental
- Análisis
- Resultados
- Comparación con otros datos
- Tratamiento termodinámico
- Producto de solubilidad y actividades en el sistema AlCl3-6H2O-H2O
- Estimación de las actividades en el sistema AlCl3-6H2O-H2O
- Producto de solubilidad y actividades en el sistema AlCl3-6H2O-HCl-H2O
- Estimación de las actividades en el sistema AlCl3-6H2O-HCl-H2O
- Sistema AlCl3-FeCl3-KCl-NaCl-H2O
- Áreas recomendadas para la investigación
- Cloruro de aluminio en soluciones acuosas de ácido clorhídrico
Aparato
El aparato utilizado para las mediciones de las solubilidades se muestra en la figura 1. Un matraz de 100 ml, A, contiene una solución de electrolitos y algún exceso de sal. Un filtro de vidrio fritado, B, fundido en un tubo Pyrex de 6-mm-OD está unido a un tubo exterior unido a dos llaves de paso de teflón, D y E. El conjunto superior está unido a A en C por un accesorio de compresión de nylon roscado con un anillo 0 de neopreno. Un tubo de polietileno de 6 mm de diámetro, F-L, suministra una muestra de solución filtrada en B al segundo matraz, K, cuando A se presuriza a través de la llave de paso D y E se abre. La conexión en J es similar a la de C. Los matraces están sujetos a una barra, G, que está unida a un mecanismo de oscilación, con H como eje de oscilación para agitar los matraces, A y K, alternativamente hacia arriba y hacia abajo. Un termostato cubierto, 0, se controla con una precisión de ±0,2° C. No es necesario un control más estricto de la temperatura, ya que la solubilidad es una función muy débil de la temperatura.
Procedimiento experimental
Las mediciones de las solubilidades a 25°, 45°, 65° y 85° C se realizaron en condiciones de equilibrio de fases con materiales analíticos de grado reactivo. Se colocaron cantidades apropiadas de AlCl3-6H2O, solución de HCl al 37% y agua destilada en el matraz A para formar aproximadamente 90 ml de solución con una pequeña cantidad de cristales de sal en exceso (en adelante «sal» se refiere al cloruro de aluminio hexahidratado). Las cantidades de materiales se estimaron a partir de los datos de solubilidad existentes sobre el sistema ternario AlCl3-6H2O-HCl-H2O. Una vez formada la solución en el matraz A y montado el aparato, se sumergió en el agua hasta el nivel N y se ajustó el termostato a la temperatura deseada. Se utilizó una agitación mecánica continua de los matraces durante cada corrida de 2 a 3 días. Periódicamente, también se utilizó una agitación manual vigorosa para asegurar el
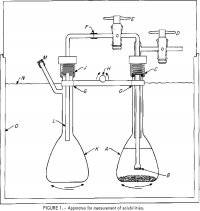
equilibrio, particularmente si la sal podía formar una sal sólida compleja con el HCl. Al final del período de equilibrio, se dejó que los matraces permanecieran inmóviles en posición vertical durante 1 hora para asegurar la sedimentación de las partículas sólidas. A continuación, se abrieron las llaves de paso D y E para transferir aproximadamente la mitad de la solución al matraz de muestreo, K. El nivel de B por debajo del líquido en A determinó normalmente la cantidad de solución transferida a K. El peso de la solución en K se determinó pesando el matraz antes de montarlo y después de admitir la solución y desmontarlo. Se inyectó una cantidad conocida de agua destilada en el matraz a través de L para diluir la muestra y disolver cualquier vapor en la fase gaseosa. La presión parcial de HCl en agua pura supera 1 torr a 25° C a molalidades superiores a 8 m (m después de un número en una frase denota molal); por tanto, a concentraciones inferiores a 8 m es dudoso que pueda producirse alguna pérdida de HCl durante el muestreo. Por esta razón, algunas de las corridas a 25° C, que contenían menos de 4 m de HCl, se hicieron con un solo frasco con tapón y, después del equilibrio, una porción de la solución se decantó cuidadosamente y se filtró para el muestreo.
Análisis
Las soluciones se analizaron después de las diluciones apropiadas para las concentraciones totales de iones cloruro y de iones aluminio. La concentración total de iones cloruro se determinó por valoración potenciométrica con Ag+. La concentración de Al+++ se determinó formando primero un complejo con un exceso de ácido etilendiamino-tetraacético (EDTA) y luego titulando por retroceso el exceso de EDTA con Cu++ a un pH de 3,8.
El contenido de AlCl3 se calculó a partir del análisis de Al+++. La sustracción del ion cloruro en la cantidad calculada de AlCl3 de la concentración total de iones cloruro permitió calcular la concentración de HCl en las soluciones saturadas.
Este método de cálculo se utilizó para todos los análisis, excepto aquellos en los que se sabía que la concentración de HCl era nula, es decir, cuando el AlCl3 era el único electrolito en el agua pura. Para estos análisis, la concentración de AlCl3 se calculó simplemente a partir del análisis de iones cloruro, que era el más exacto de los dos análisis, aunque los análisis de Al+++ y Cl- se completaron igualmente para estas muestras.
La diferencia en el análisis de Cl- calculado a partir del análisis de Cl- total y de Cl- a partir del análisis de Al+++ para los experimentos sin HCl añadido fue de ±0,2 wt-pct Cl-. Esto indica que, por término medio, el análisis de Al++ estaba sujeto a un error de +0,05 wt-pct, ya que se sabía que el análisis de Cl era considerablemente más preciso que el de Al+++. En las soluciones que contenían HCl, un error de ±0,05 por ciento en el contenido de Al+++ se reflejaba como ±0,20 pct en el contenido de HCl; esto se debía a que, si bien el contenido total de Cl era muy preciso, el Cl aportado por el HCl añadido y, por tanto, la molalidad de HCl, se calculaba por diferencia como se ha mencionado anteriormente.
Resultados
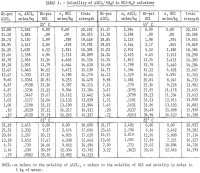
Los resultados se resumen en la tabla 1 y se muestran en la figura 2. La concentración máxima de HCl para los datos indicados en la tabla 1 para 85° C es de aproximadamente 30 % en peso. Las mediciones se detuvieron a esta concentración debido a las excesivas presiones de equilibrio en el sistema a concentraciones más altas. También hay que tener en cuenta que se realizaron menos determinaciones a 65° y 85° C que a 25° y 45° C. Se realizaron réplicas a las dos temperaturas más bajas para dar una indicación de la repetibilidad satisfactoria de los resultados. La figura 2 muestra que la solubilidad de la sal de aluminio disminuye drásticamente con el aumento de la concentración de HCl. Por lo tanto, la lixiviación de minerales no bauxíticos con solución de HCl y la precipitación de la sal pura para la extracción de aluminio mediante la adición de HCl es un proceso factible; dicho proceso ha sido objeto de varias patentes. Los resultados muestran que la solubilidad no cambia mucho con la temperatura, y para un aumento de temperatura de 60° C (25° a 85° C), la solubilidad de la sal pura sola en el agua aumenta sólo 2,2 pct en relación con la solubilidad a 25° C.
Comparación con otros datos
Se encontró que la solubilidad de la sal pura en el agua a 25° C concuerda exactamente con los datos de Palitzch y con Ehret y Frere. Los resultados dados por Malquori son aproximadamente 10 pct más altos. La solubilidad obtenida por Tanaka es aproximadamente 3,3 puntos porcentuales más alta que en la presente investigación a 45° y 65° C.
El efecto del HCl en el agua sobre la solubilidad de la sal ha sido investigado por Seidel y Fisher a 0° C y por Malquori a 25° C. Los resultados de los primeros investigadores a 0° C concuerdan muy estrechamente con los datos de la tabla 1, extrapolados a 0° C, mientras que los de este último investigador a 25° C se dispersan un poco y discrepan aproximadamente en 3 pet a bajas concentraciones de HCl; sin embargo, la concordancia en el rango de 5 a 30 wt-pct de HCl está dentro de 1 pct.
Tratamiento termodinámico
Producto de solubilidad y actividades en el sistema AlCl3-6H2O-H2O
El coeficiente de actividad iónica Y12 de AlCl3 en agua ha sido medido hasta 1,8 m por Mason, y los valores recalculados son dados por Robinson y Stokes. Dado que se espera que el coeficiente de actividad desde 1,8 m hasta el valor de saturación de 3,3835 m aumente más de cinco veces, el valor de saturación se utiliza para el cálculo por el método descrito en detalle en un informe anterior (1 m = 1 mol en 1 kg de disolvente). El método, con su correspondiente aplicación novedosa, se resume brevemente en este informe. La actividad iónica media del AlCl3, designada como a12, se expresa mediante la siguiente serie de potencias en términos de molalidad m:

La ecuación correspondiente para la actividad del agua aw, se obtiene mediante la aplicación de la relación Gibbs-Duhem; el resultado es
![]()
Nótese que los exponentes de m con los mismos coeficientes de C, D, etc., son 1 más altos en la ecuación 2 que en la ecuación 1, y el coeficiente de m en la ecuación 2 se origina en la teoría de Debye-Huckel como se discute por Gokcen.
La reacción para la disolución de la sal es
AlCl3-6H2O (S) = Al+++ + 3Cl- + 6H2O (l),………………………….(3)
donde (s) significa sólido y (l) líquido.
La constante de equilibrio correspondiente es
![]()
donde el denominador, la actividad del sólido, se toma como la unidad ya que su composición no cambia cuando se añaden otros electrolitos en solución. Sustituimos a12 en 1n Kp directamente desde la ecuación 1 y por aw desde la ecuación 2 después de multiplicar la ecuación 2 por 0,108093 para que el coeficiente de 1n aw sea igual a 6. Como Kp es independiente de la composición, es evidente que
![]()
Después de las sustituciones necesarias de las ecuaciones 1 y 2 y de la sustitución del valor medio m3835 de las dos primeras ejecuciones de la tabla 1, se obtiene una ecuación para resolver los seis coeficientes desconocidos de la ecuación 1, y las cinco ecuaciones restantes se obtienen sustituyendo cada uno de los cinco valores experimentales del coeficiente medio de actividad iónica de AlCl3 , y12 en la tabla 2, en
![]()
y luego sustituyendo cada resultado en la ecuación 1. A continuación, se resuelven por ordenador seis ecuaciones simultáneas obtenidas de este modo. Los resultados son los siguientes:
C = -57,5723,
D = +142,0288,
E = -202,5581,
F = +161,1919,
G = -67,7831,
y H = +11,6880.
La sustitución de estos valores en las ecuaciones 1, 2 y 4 arroja los valores de Y12, aw y Kp. Los resultados se recogen en la tabla 3 bajo el epígrafe «Resultados de la mesa:» Cabe señalar que la actividad del agua puede calcularse ahora a partir de la ecuación 2, y la presión de vapor del agua sobre la solución, P, a partir de
aw = P/P°,……………………………….(7)
donde P° es la presión de vapor del agua pura a la misma temperatura. Nótese que la presión de vapor del agua sobre la solución saturada es un poco más de la mitad de la del agua pura, ya que aw = 0,509. Los resultados anteriores constituyen el primer conjunto de datos sobre las actividades basadas en la solubilidad de la sal.
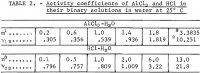
Nota.-En esta tabla, m se refiere a la molalidad de AlCl3, n se refiere a la molalidad de HCl, y la molalidad es moles en 1 kg de agua.
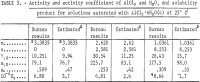
Nota.-En esta tabla, m se refiere a la molalidad de AlCl3, n se refiere a la molalidad de HCl, y la molalidad es moles en 1 kg de agua.
Estimación de las actividades en el sistema AlCl3-6H2O-H2O
Para obtener las actividades en el sistema AlCl3-6H2O-H2O más allá de los datos experimentales directos existentes a m = 1,8 se utilizan dos métodos de estimación fiables. El primer método, descrito por Kusik y Meissner, da un valor estimado de γ12 = 9,94 a 3,3835 m. Este valor estimado está muy de acuerdo con 10,251, el valor obtenido en la presente investigación. El correspondiente valor estimado de la actividad del agua, aw, es de 0,47, de nuevo en estrecha concordancia con el valor de 0,509 encontrado en la presente investigación. La constante de equilibrio Kp calculada a partir de estos valores no está lejos de 6,8 x 10 5, considerando el hecho de que la cuarta potencia de a12 y la sexta potencia de aw se multiplican para obtener Kp.
El segundo método de estimación debido a Bromley arroja 10,42 para γ12, un valor más cercano al obtenido por el método anterior. El coeficiente de actividad del agua ha sido obtenido por los presentes autores, mediante la integración de la ecuación de Gibbs-Duhem en la que se han utilizado los valores de a12 estimados por el método de Bromley. El resultado es aw = 0,540. La media de ambos métodos es de 0,505, lo que concuerda muy bien con el valor de 0,509 de la Oficina. El método de Bromley, sin embargo, no contiene un método conveniente para la determinación de aw incluido en el método de Kusik-Meissner.
La concordancia de los valores estimados con los valores de los datos de solubilidad no es siempre tan buena como se muestra aquí para cada electrolito en cada composición. Por ejemplo, incluso para AlCl3 a 1 m, las dos estimaciones de γ12 difieren sólo en un 13 por ciento entre sí.
Producto de solubilidad y actividades en el sistema AlCl3-6H2O-HCl-H2O
El efecto del aumento de la concentración de HCl en la solubilidad de la sal se debe en gran medida al aumento de la concentración de los iones cloruro. La constante de equilibrio en este caso con las actividades a1 y a2 de los iones individuales es
![]()
donde γ12 = γ1γ2 por definición de γ12 a partir de las actividades iónicas individuales γ1 (para Al+++) y γ2 (para Cl-), y n es la molalidad del HCl. El valor de Kp es el mismo que el de la ecuación 4, pero el lado derecho de la ecuación 8 es diferente al de la ecuación 4. Puede observarse que a medida que n aumenta, m, la concentración de Al+++, debe disminuir, siempre que γ12 y aw no disminuyan mucho; por lo tanto, la sal precipita, lo que se conoce como efecto de salación.
El cálculo de las actividades en la solución ternaria requiere una ecuación similar a la ecuación 1 para el HCl. Dado que los datos para el HCl se conocen con precisión en un amplio rango de concentración, es posible tomar una ecuación con tantas variables como se desee. La siguiente ecuación ofrece una representación exacta de los datos del coeficiente de actividad del HCl, γ32 donde el subíndice 3 es para el H+ y el 2 para el Cl-:
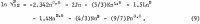
Los datos seleccionados para este fin de Haase, Naas y Thutnm se encuentran en la tercera y cuarta filas de la tabla 2. Los valores de los coeficientes calculados a partir de estos datos son los siguientes:
J = -1,88416,
K = +2,24342,
L = -1,98545,
M = +1,00091,
N = -0,25934,
y P = +0,02634.
Las ecuaciones para las actividades de AlCl3 y de H2O contienen estos coeficientes así como los coeficientes de los productos cruzados (m h/2)(n k/2), donde h y k son números enteros, y estas ecuaciones son las siguientes:
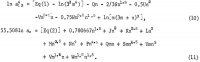
Los cinco coeficientes adicionales de estas ecuaciones se determinan sumando la ecuación 10 y 6 1n aw de la ecuación 11 para obtener 1n Kp y utilizando los siguientes datos de solubilidad seleccionados de la tabla 1:
m: 2.620, 2,016, 1,333, 0,953 y 0,535.
n: 2,581, 4,460, 6,780, 8,397 y 10,063.
Los cálculos resultantes dan los siguientes valores de los coeficientes de las ecuaciones 10 y 11:
Q = +23,27027,
S = -22.47064,
U = +4,29102,
V = -9,76081,
y W = +4,60246.
Los resultados de γ12, a12, aw y Kp calculados a partir de las ecuaciones anteriores se enumeran en la tabla 3. Los valores de γ12 de la ecuación 9 están de acuerdo con los de Harned y Gary a concentraciones muy bajas de HCl y AlCl3.
La presión parcial de HCl(g), P32, sobre una solución puede calcularse a partir de la siguiente ecuación (4):
Kp (HCl) = 4.94 x 10 -7 = P32/a²32………………………….(12)
donde Kp(HCl) es la constante de equilibrio a 25° C para H+ + Cl- = HCl(g), y a32 es la actividad iónica media del HCl en solución. Para ello, es necesario escribir una ecuación para a32, similar a la ecuación 10, utilizando los parámetros de la ecuación 11, como se muestra en detalle en otra parte.
El efecto de la temperatura sobre la solubilidad de la sal es pequeño, como se muestra en la tabla 1. Por lo tanto, se espera que el efecto sobre las actividades iónicas sea pequeño, ya que todos los parámetros de la ecuación 11 podrían haberse obtenido a partir de los datos de solubilidad si el error experimental fuera inferior a ±0,01 wt-pct para el análisis del aluminio. En general, para un rango de temperatura hasta aproximadamente 80° C, cada parámetro es una función lineal de la temperatura, y esta dependencia puede determinarse si la ecuación 11 se conociera a otra temperatura al menos 50° C superior a 25° C.
Estimación de las actividades en el sistema AlCl3-6H2O-HCl-H2O
Los valores de las actividades, el coeficiente de actividad y el producto de solubilidad estimados en la presente memoria según el método ideado por Kusik y Meissner, se enumeran en la tabla 3. El coeficiente de actividad γ12 para el AlCl3 es aproximadamente el doble del valor estimado para las soluciones seleccionadas que contienen HCl. La actividad del agua, aw, sin embargo, concuerda bien con los valores estimados excepto para m = 2,620. Es evidente que los cálculos habrían sido considerablemente más fiables si se midiera la presión de vapor del agua, aw, porque aw entra en Kp como aw, de modo que pequeños errores en aw causan grandes errores en γ12 y Kp . Para ello, se recomienda realizar un número limitado de mediciones de la presión de vapor para comprobar la exactitud de los cálculos actuales y de los métodos de estimación.
La dependencia de la temperatura de las propiedades termodinámicas enumeradas en la tabla 3 puede estimarse como describen Kusik y Meissner. Sin embargo, es probable que la estimación arroje un mayor grado de dependencia de la temperatura que el indicado por la débil dependencia de la temperatura de la solubilidad. No se ha podido intentar calcular el efecto de la temperatura por el método de la Oficina porque (1) no se conoce el a12 a bajas concentraciones de AlCl3 a varias temperaturas, (2) no se ha podido determinar la solubilidad de AlCl3 con una precisión cercana al 0,01 pct en Al+++, y (3) el rango de concentración de HCl a 65° y 85° C es demasiado pequeño para seleccionar un número suficiente de datos de solubilidad muy diferentes para AlCl3 para determinar con precisión los parámetros de las ecuaciones 10 y 11.
Sistema AlCl3-FeCl3-KCl-NaCl-H2O
Se obtuvieron datos preliminares sobre las solubilidades de AlCl3, FeCl3 , KCl y NaCl en soluciones acuosas que contenían de 24 a 31 wt-pct de HCl a 25° C para evaluar la contaminación de AlCl3-6H2O extraíble de minerales no bauxíticos. Para ello, se prepararon 2 litros de una solución que contenía cantidades conocidas de sales, se colocaron 90 ml de esta solución en un matraz para cada ejecución y, a continuación, se admitió una cantidad conocida de HCl gaseoso para alcanzar de 24 a 31 wt-pct de HCl disuelto. En este rango de HCl en solución, se precipitaron cristales anisotrópicos incoloros de AlCl3-6H2O, cristales anisotrópicos brillantes de FeCl3-2KCl-H2O, y cristales cúbicos isotrópicos transparentes de KCl y NaCl, que se identificaron mediante examen microscópico. El procedimiento y los análisis para las concentraciones de iones aluminio y iones cloruro fueron los mismos que los utilizados para el sistema AlCl3-6H2O-HCl-H2O presentado anteriormente en este informe. Además, la concentración de iones férricos se determinó mediante una valoración estándar de K2Cr2O7, la concentración de iones de sodio se determinó mediante técnicas de absorción atómica, y la concentración de iones de potasio se determinó mediante la sustracción de la concentración de iones de sodio de una determinación de las concentraciones combinadas de iones de potasio más iones de sodio después de la separación por intercambio iónico. Los resultados se enumeran en la tabla 4 y se representan en la figura 3. En la figura 3 también se representan resultados similares de Miles para mostrar que la concordancia es excelente. Linke ha recopilado datos publicados sobre sistemas más sencillos que contienen menos componentes.
En los procesos de cristalización por evaporación o por aspersión de gas HCl para producir hexahidrato de cloruro de aluminio puro, la contaminación por otros cloruros metálicos se convierte en un problema a medida que los niveles de impurezas se acumulan en las soluciones de lixiviación. La figura 3 muestra los niveles de concentración en los que impurezas como el NaCl, el KCl y el FeCl2-2KCl-H2O también cristalizarán de la solución como fases separadas distintas, causando así la contaminación de los cristales de AlCl3-6H2O. Por ejemplo, con menos de 2,4 % en peso de FeCl3 en presencia de 1,6 % en peso de KCl a 25° C, la concentración de HCl debe ser inferior al 28 % en peso para evitar la contaminación de AlCl3-6H2O por la sal doble, FeCl3-2KCl-H2O. La figura 3 también es útil para redisolver el precipitado por recristalización fraccionada para purificar la sal de aluminio. Además, algunas de las sales de los elementos de transición, como el FeCl3, pueden minimizarse mediante electrólisis parcial para eliminar una cantidad suficiente de hierro antes de la acidificación con HCl.
Un tratamiento termodinámico del sistema con el error habitual de ±0,05 wt-pct en la concentración de iones cloruro no es factible, particularmente en ausencia de datos de presión de vapor para H2O(g) y HCl(g). Sin embargo, se pueden hacer estimaciones aproximadas de las actividades mediante el método de Kusik-Meissner. Se prevé que tales estimaciones podrían dar sólo valores aproximados de las actividades para las sales hidratadas y complejas y para el agua.

Áreas recomendadas para la investigación
Las mediciones de las actividades son útiles para interpretar la termodinámica y la cinética de la lixiviación, la precipitación y la purificación de los componentes deseados de varios minerales. Hay dos razones por las que las actividades pueden determinarse con precisión a partir de las mediciones de la presión de vapor del agua: (1) La presión de vapor puede medirse con un alto grado de precisión mediante transductores de presión diferencial para obtener aw mediante la ecuación 7 y, a continuación, calcular los valores de los parámetros en la ecuación 11, de modo que todas las propiedades relacionadas puedan calcularse como se ha discutido anteriormente en detalle (2) Tanto el producto de solubilidad como las actividades pueden determinarse con precisión para las sales multivalentes que contienen un gran número de moléculas de agua en sus cristales hidratados. La segunda razón surge del hecho de que el exponente de la actividad del agua en la ecuación 4 es igual a los moles de agua en el cristal hidratado.
Cloruro de aluminio en soluciones acuosas de ácido clorhídrico
Otro tipo de experimento interesante para el sistema ternario discutido aquí es la medición de la presión parcial de HCl(g) sobre varias soluciones que contienen cantidades suficientemente grandes de HCl disuelto. El procedimiento experimental para este fin se describe en otro lugar. Las sales de los grupos IIA, IIIA y de los metales de transición son excelentes candidatos para este tipo de investigaciones, ya que los electrolitos con valencias superiores a 1:1 suelen formar sales hidratadas.
La solubilidad y la actividad del cloruro de aluminio hexahidratado, AlCl3-6H2O, en soluciones acuosas se determinaron como parte de la investigación de la Oficina de Minas, del Departamento del Interior de los Estados Unidos, para mejorar la tecnología de procesamiento de minerales para la recuperación de alúmina a partir de recursos nacionales de baja calidad. Se descubrió que la solubilidad del AlCl3 en agua pura era de 31,09 y 31,77 wt-pct a 25° y 85° C, respectivamente, y que disminuía drásticamente a 10 y 0,1 wt-pct cuando se añadían a la solución las cantidades respectivas de ácido clorhídrico (HCl) de 20,3 y 37 wt-pct. Se calcularon la constante de equilibrio para la solubilidad del hexahidrato, las actividades y los coeficientes de actividad del AlCl3 y del H2O y se compararon con los resultados de los métodos de estimación disponibles. Se demostró que los resultados son útiles en la lixiviación de minerales no bauxíticos para la extracción de alúmina mediante el cambio de las solubilidades de las sales componentes al añadir HCl.
También se determinaron las solubilidades simultáneas de AlCl3 , FeCl3, KCl y NaCl en soluciones de HCl-H2O y se discuten brevemente sus efectos sobre la pureza del AlCl3-6H2O cristalizado a partir de soluciones salinas mixtas.