Página de Biorealmología Microbiana sobre el género Rhodospirillum rubrum
Clasificación
Taxa de orden superior
Reino: Bacteria
Phylum: Proteobacteria
Clase: Alphaproteobacteria
Orden: Rhodospirillales
Familia: Rhodospirillaceae
Género: Rhodospirillum
Especie
Rhodospirillum rubrum
Descripción e importancia
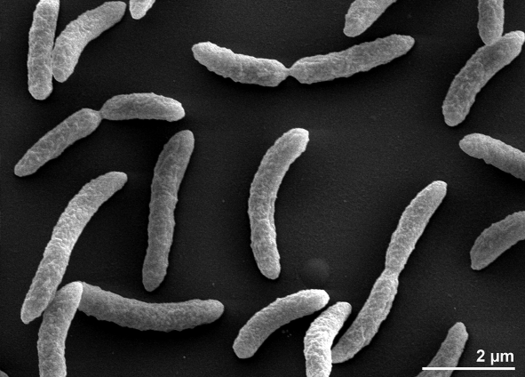
Rhodospirillum rubrum es una bacteria Gram negativa, mesófila. Su temperatura óptima de crecimiento es de 25-30 grados Celsius. Tiene envolturas externas de varias capas, que contienen principalmente grasas insaturadas, pero algunas saturadas en su pared celular. R. rubrum es una espirila, lo que significa que tiene forma de espiral. Tiene flagelos polares y, por tanto, es móvil. Su longitud es 3-10 um, con una anchura de 0.8-1.0 um.
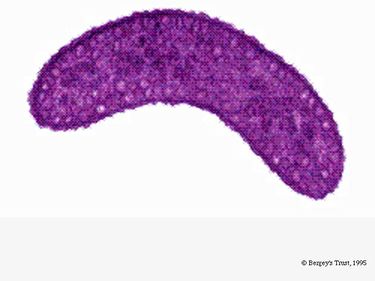
R. rubrum es un anaerobio facultativo. Dependiendo de la presencia de oxígeno, puede experimentar la fermentación alcohólica o la respiración aeróbica. También es capaz de realizar la fotosíntesis y contiene carotenoides y baterioclorofila en sus partículas cromatóforas. Estas moléculas ayudan a absorber la luz y convertirla en energía y también le dan su distintivo color rojo púrpura en condiciones anaeróbicas. R. rubrum es incoloro en condiciones aeróbicas.
Aunque la fotosíntesis es activa en condiciones aeróbicas, generalmente se suprime en presencia de O2. El azufre es un subproducto principal de la fotosíntesis, no el O2. R. rubrum puede crecer de forma heterótrofa o autótrofa cuando es fotosintética. A diferencia de muchas plantas, R. rubrum no contiene clorofila a (espectro de absorción 430-662 nm). Sin embargo, sí contiene clorofila b (espectro de absorción 660-680 nm) y bacterioclorofilas (800-925 nm). Esto le permite utilizar más energía del espectro electromagnético. R. rubrum también oxida el monóxido de carbono (CO) con gas hidrógeno como producto final de la vía, y puede utilizar el sulfuro a bajas concentraciones como donante de electrones en la reducción del dióxido de carbono. Además, es una bacteria fijadora de nitrógeno; utiliza la nitrogenasa para convertir el gas nitrógeno atmosférico en amoníaco (Munk et al, 2011).
Hay varias aplicaciones de R. rubrum en el campo de la biotecnología. Es un sistema modelo de conversión de luz en energía química y por sus vías de fijación de nitrógeno. También es objeto de estudios de resistencia a la radiación. También puede utilizarse de varias maneras para el consumo. Las proteobacterias pueden ser una fuente de alimento para animales y de abono agrícola. Otro papel importante en la investigación es la producción de vitaminas. También se está investigando su producción de plástico biológico a partir de precursores del poli-hidroxi-butírico. R. rubrum también puede ser un contribuyente en los combustibles biológicos de hidrógeno, principalmente a través de su evolución de la enzima nitrogenasa.
Estructura del genoma
La secuenciación del genoma está terminada. Consiste en un cromosoma circular con 4.352.825 pares de bases, el 65% de las cuales son pares de guanina-cistosina. También hay un plásmido con 53.732 pares de bases con un 60% de guanina-citosina. En total, hay 3.850 genes codificadores de proteínas y 83 genes de ARN. De estos genes, el 6,9% están relacionados con la transcripción; el 4,6% con la traducción, la estructura de los ribosomas y la biosíntesis; el 4,0% con la replicación, la recombinación y la reparación; el 7,9% con los mecanismos de transducción de señales; el 5,9% con la biogénesis de la pared celular y las membranas; el 6,6% con la producción y la conversión de energía; el 5,0% con el transporte y el metabolismo de los carbohidratos; el 99% transporte y metabolismo de aminoácidos; 4,7% transporte y metabolismo de coenzimas; 3,7% transporte y metabolismo de lípidos; y 6,5% transporte y metabolismo de iones inorgánicos(Munk et al, 2011).
Ecología
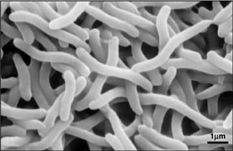
Debido al hecho de que Rhodospirillum rubrum puede crecer tanto de forma aeróbica como anaeróbica, es capaz de habitar una amplia variedad de condiciones. R. rubrum se encuentra en muchos entornos acuáticos naturales como estanques, lagos, arroyos y aguas estancadas (Reslewic et. al, 2005). R. rubrum también se encuentra a menudo en el barro y las aguas residuales (Brock et al, 2000). Los estudios han demostrado que R. rubrum puede realizar grandes cambios en su composición química para adaptarse a diferentes entornos (Cohen-Bazire y Kunisawa, 1963). R. rubrum prefiere crecer en hábitats con un pH de 6,8-7,2 (Bergey y Holt, 1994). Los estudios también han demostrado que R. rubrum tiene una temperatura óptima de crecimiento de 22-35 grados Celsius (Weaver, 1971).
Estructura celular y metabolismo
R. rubrum es un organismo versátil que puede obtener energía a través de una variedad de mecanismos. Los mecanismos de respiración y fotosíntesis existen conjuntamente y su actividad depende de la presencia de luz y energía. R. rubrum puede crecer en ambientes quimio-tropicales oscuros con la presencia de oxígeno o puede crecer en un ambiente fototropical sin oxígeno.
La fotosíntesis en R. rubrum comienza con la donación de un hidrógeno de un sustrato orgánico a un sustrato oxidante. La bacterioclorofila y los cartenoides, los pigmentos fotorreactivos que se encuentran en la membrana celular, están unidos a los cromatóforos (Schachman, Pardee y Stanier, 1952). Los cromatóforos son discos aplanados que contienen fosfolípidos de colina, cardio lipina y diglicéridos de galactosilo (Benson, Wintermans y Wiser, 1959; Benson 1961). Además, los cromatóforos contienen una cadena completa de transporte de electrones que incluye varios citocromos, flavina y nucleótidos de piridina (Newton y Newton, 1957; Hulcher y Conti, 1960; Kamen, 1961). La membrana celular también contiene maquinaria para la síntesis de ATP, incluyendo una ATP sintetasa.
En presencia de oxígeno, R. rubrum es capaz de respirar aeróbicamente utilizando una cadena de transporte de electrones tradicional con NAD+/NADH como portador primario de electrones (Keister y Minton, 1969). Entre las proteínas transportadoras de electrones está el citocromo C428 (Chance y Smith, 1955). La respiración aeróbica, sin embargo, es inhibida por la fotosíntesis (Oelze y Weaver, 1971).
R. rubrum es también capaz de la respiración anaeróbica. Sus aceptores de electrones terminales no oxigenados pueden incluir dimetilsulfóxido y óxido de trimetilamina. La presencia de estos aceptores de electrones hace posible que sustratos como el succinato, el malato y el acetato apoyen el crecimiento de R. rubrum. Estos aceptores, sin embargo, sólo son aproximadamente 33-41% tan eficientes como el oxígeno en términos de conservación de energía (Schultz y Weaver, 1982).
Además, R. rubrum tiene la capacidad única de oxidar el monóxido de carbono utilizando la monóxido de carbono deshidrogenasa. Esta vía de oxidación termina con la reducción e hidrógeno y la producción de gas hidrógeno.
Sin un aceptor de electrones terminal, R. rubrum completa la fermentación ácida mixta. Los principales productos de la fermentación del piruvato son acetato, formiato, dióxido de carbono e hidrógeno. En presencia del ion bicarbonato, la fructosa puede ser fermentada. Los productos finales de esta vía son los mismos que para el piruvato pero con la adición de succinato y propionato (Schultz y Weaver 1982).
Además de tener la capacidad de fijar dióxido de carbono (Schon y Biedermann, 1972), una propiedad anabólica identificativa de R. rubrum es su capacidad de fijar nitrógeno. En condiciones de oscuridad con presencia de fructosa, R. rubrum utiliza la nitrogenasa para fijar el nitrógeno gaseoso en amonio. Contiene nitrogenasas tanto de Fe-Mo como de sólo Fe.
Patología
No se ha descubierto que Rhodospirillum rubrum infecte a los seres humanos o a los animales.
Investigación actual
Resistencia a la radiación
Rhodospirillum rubrum ha proporcionado recientemente información sobre la resistencia a la radiación. Felice Mastroleo et al, en Insight into the radiotolerance of the life support bacterium Rhodospirillum rubrum S1H by means of phenotypic and transcriptomic methods (2010), han caracterizado la tolerancia a la radiación de R. rubrum.
Al someter a la bacteria a dosis subletales de rayos gamma Cobalt-60, un tipo de radiación ionizante, se caracterizaron en el organismo los genes marcadores de R. rubrum específicos a la radiación ionizante. Estos genes aumentaron su expresión a medida que transcurría el «tiempo de recuperación» tras un determinado tratamiento de radiación gamma. El análisis de la expresión de los genes de R. rubrum después de la radiación gamma crea el potencial para una mayor investigación microbiológica que puede conducir a avances en la resistencia a la radiación aplicada en el futuro.
Plásticos biodegradables
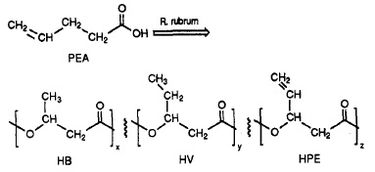
Se ha descubierto que R. rubrum produce una clase de plásticos biodegradables, los poli beta-hidroxialcanoatos (PHA). Las aplicaciones de esta investigación pueden resolver muchos problemas causados por los plásticos sintéticos no degradables que han impactado negativamente en el medio ambiente. Un experimento de investigación realizado por Herbert. W. Ulmer et al. relató la producción de PHAs que contienen unidades de 3HV por parte de Rhodospriillum rubrum (1993). Ulmer utilizó ácido 4-pentenoico (PEA) como medio de crecimiento para R. rubrum. Cuando la bacteria se puso en «condiciones de producción de PHA», se sintetizaron PHAs que contenían 3 subunidades repetitivas (nota: R = grupo sustituyente): HB (R = metilo), HV (R = etilo), HPE (R = vinilo) (Ver Figura 1).
La síntesis de plásticos funcionales y biodegradables por parte de bacterias tiene el potencial de reducir la contaminación global y el gasto de combustible de las fábricas de plástico. R. rubrum puede utilizarse como herramienta microbiológica para producir biopolímeros respetuosos con el medio ambiente.
Energía renovable
La creciente preocupación por la contaminación ambiental derivada de la quema de combustibles fósiles ha llevado a un aumento de la investigación sobre Rhodospirillum rubrum. El uso de R. rubrum como fuente de hidrógeno para ser utilizado en combustibles renovables de hidrógeno aborda varios problemas creados por el consumo de combustibles fósiles. El hidrógeno se oxida a agua como producto de la combustión, a diferencia de los combustibles fósiles que crean contaminantes como CO, CO2, SOx y NOx. R. rubrum puede producir hidrógeno utilizando la siguiente «reacción de cambio de gas a agua» (Najafpour et al, 2004):
CO + H2O → H2 + CO2
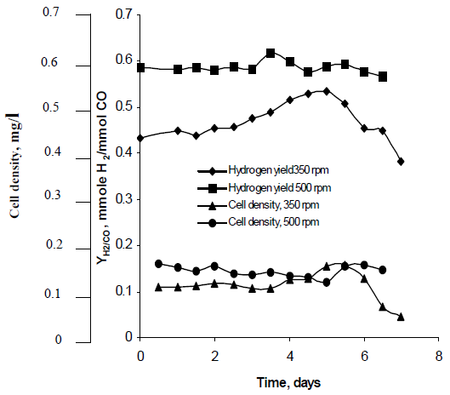
El método de investigación de Najafpour observó cómo la agitación, creada por conjuntos de impulsores de turbina ajustados a tasas de 350 rpm así como de 500 rpm, afectaba a las tasas de producción de hidrógeno de R. rubrum. Su investigación descubrió que el combustible de hidrógeno tiene el potencial de frenar el calentamiento global y proporcionar una solución tecnológica ecológica para la producción y el consumo de combustible. Su estudio reveló que «una mayor tasa de agitación produjo un mayor hidrógeno, así como una mayor densidad celular» de R. rubrum (véase la figura 2).
En otro estudio microbiológico, realizado por Matthew Ross Melnicki, se descubrió que R. rubrum proporciona el potencial de la energía renovable, como el combustible de hidrógeno, a través de la síntesis de hidrógeno. Sus vías biológicas pueden producir niveles de hidrógeno a altas tasas cuando se co-cultiva con Chlamydomonas reinhardtii, una especie de alga con la que R. rubrum puede crecer armoniosamente. Melnicki propuso un enfoque de co-cultivo no convencional para la síntesis de hidrógeno que produjo niveles mejorados de síntesis de hidrógeno que no se pueden lograr si el co-cultivo está desacoplado. C. reinhardtii se vio favorecida con intensidades de luz más altas, mientras que R. ruburm fue más productiva con intensidades de luz más bajas, lo que pone de manifiesto las ventajas de su cocultivo.
Utilizando una técnica de alimentación por lotes para cultivar R. rubrum, se descubrió que los cultivos inoculados producían hidrógeno durante su fase de crecimiento exponencial, y la síntesis de hidrógeno seguía floreciendo continuamente durante 70 horas. Cuando el crecimiento cesaba, Melnicki añadía succinato, que actúa como donante de electrones en la vía metabólica, y la evolución del hidrógeno se reanudaba aunque la bacteria ya no crecía. Sin embargo, es importante señalar que con la adición continua de succinato se encontraron tasas de evolución de hidrógeno reducidas. Una vez que se añadió medio de crecimiento adicional, las tasas de producción de hidrógeno aumentaron de nuevo.
Melnicki también afirmó que «aunque el crecimiento no es necesario para la producción de hidrógeno, este trabajo establece la necesidad del crecimiento celular para mantener las tasas máximas, lo que sugiere la idoneidad industrial de una estrategia de cultivo semicontinuo» (Melnicki, 2009).
Factor de enfriamiento
La secuencia del genoma de Rhodospirillum rubrum es sólo la segunda del género Rhodospirillum que se ha publicado, después de R. centenum (Munk et al, 2011).

Un aspecto interesante de Rhodospirillum rubrum es su capacidad de cambiar de color en diferentes condiciones. Es un fototrofo anoxígeno, pero no produce el oxígeno extracelular. En su lugar, produce azufre elemental durante la recolección de luz. Esto se debe a que R. rubrum carece del complejo 2 de captación de luz (Munk et al, 2011). La bacteria utiliza la bacterioclorofila, lo que le permite absorber longitudes de onda de luz que las plantas no utilizan. La bacterioclorofila absorbe longitudes de onda de 800-925 nm.
En condiciones aeróbicas, la actividad fotosintética de R. rubrum está genéticamente suprimida, y la bacteria se vuelve incolora. Sin embargo, en condiciones anaeróbicas, la fotosíntesis se activa y la bacteria adquiere un marcado color rojo púrpura (véase la imagen 5). Esto se debe a la actividad de los cromatóforos, que se encuentran en la membrana (Munk et al, 2011). Los cromatóforos contienen los pigmentos bacterioclorofílicos de la bacteria, y sufren cambios de absorción durante la activación de la fotosíntesis.
Benson, A. «Chloroplast lipid metabolism». En Simposio no. VI. V Congreso internacional de Bioquímica. 1961. Oxford: Pergamon Press. (En prensa.)
Benson, A., Wintermans, J. y Wiser, R. «Chloroplast lipids as carbohydrate reservoirs». Plant Physiology. 1959. Volume 34. p. 815.
Bergey, D. y Holt, J. Bergey’s manual of determinative bacteriology. Novena edición. Baltimore. Lippincott Williams and Wilkins. 1994. p. 359.
Brock, T.D., M.T. Madigan, J.M. Martinko, y J Parker. Biología de los microorganismos. 9th Edition. Upper Saddle River: Prentice Hall, 2000. p. 459.
Chance, B. y Smith, L. «Pigmentos respiratorios de Rhodospirillum rubrum». Nature. Volumen 174. p. 803-806.
Cohen-Bazire, G. y Kunisawa, R. «The Fine Structure of Rhodospirillum Rubrum .» Journal of Cell Biology. 1963. Volumen 16. p. 401-419.
Hulcher, M. y Conti, S. «Cytochronies in chlorophyll-containing particles of Chromatium and Chlorobium thiosuphatophilum.» Biochemistry and Biophysics Research Communications. 1960. Volume 3. p. 497.
Kamen, M. «The Haem Proteins of Photosynthetic Tissues». En Simposio no. VI. V Congreso internacional de Bioquímica. 1961. Oxford: pergamon Press. (En prensa.)
Keister, D. y Minton, N. «Energy-linked reactions in photosynthetic bacteria. 3. Estudios adicionales sobre la reducción de nicotinamida-adenina dinucleótido ligada a la energía por los cromatóforos de Rhodospirillum rubrum». Biochemistry. 1969. Volume 8. p. 167-173.
Mastroleo, F., Monsieurs, P., y Leys, N. «Insight into the radiotolerance of the life support bacterium Rhodospirillum rubrum S1H by means of phenotypic and transcriptomic methods». Asamblea científica de COSPAR. 2010. p. 4.
Melnicki, M. R. «Modes of hydrogen production in the photosynthetic bacterium, Rhodosphirillum rubrum». Universidad de California, Berkeley. 2009.
Munk, C., Copeland, A., Lucas, C., Lapidus, A., et al. «Complete genome sequence of Rhodospirillum rubrum type strain (S1T)». Normas en ciencias genómicas. 2011. Volume 4. pp. 293-302.
Najafpour, G., Ismail, K., Younesi, H., Mohamed, A. R., y Kamaruddin, A. H. «Hydrogen as clean fuel via continuous fermentation by anaerobic photosynthetic bacteria, Rhodospirillum rubrum». African Journal of Biotechnology. 2004. Volume 3. pp. 503-507.
Newton, J. y Newton, G. «Composition of the photoactive subcellular particles from Chromatium». The Archives of Biochemistry and Biophysics. 1957. Volumen 71. p. 250.
Oelze, J. y Weaver, P. «The adjustment of photosynthetically grown cells of Rhodospirillum rubrum to aerobic light conditions.» Los Archivos de Microbiología. 1982. Volumen 79. p. 108-121.
Reslewic, S., Shigou, Z., Lugar, M., Zhang, Y., Briska A., Goldstein, S., Churas, C., Runnheim, R., Forrest, D., Lim, A., Lapidus, A., Han, C., Roberts, G., y Schwartz, D. «Whole-Genome Shotgun Optical Mapping of Rhodospirillum rubrum .» Microbiología Aplicada y Ambiental. 2005. Volumen 71. p. 5511-5522.
Schachman, H., Pardee, A., y Stanier, R. «Estudios sobre la organización macromolecular de las células microbianas». The Archives of Biochemistry and Biophysics. 1952. Volumen 38. p. 245-260.
Schön, G. y Biedermann, M. «Synthesis of volatile acids by fermentation of pyruvate and fructose in anaerobic dark cultures of Rhodospirillum rubrum.» Archiv fur Mikrobiologie.1972. Volumen 85. p. 77-90.
Schultz, J. y Weaver, P. «Fermentación y respiración anaeróbica por Rhodospirillum rubrum y Rhodopseudomonas capsulate.» The Journal of Bacteriology. 1982. Volume 149. p. 181-190.
Ulmer, H., Gross, R., Posada, M., Weisbach, P., Fuller, R. C., y Lenz, R. «Bacterial production of poly(.beta.-hydroxyalkanoates) containing unsaturated repeating units by Rhodospirillum rubrum». Macromolecules. 1994. Volumen 27. p. 1675-1679.
Weaver, P. «Temperature-Sensitive Mutations of the Photosynthetic Apparatus of Rhodospirillum rubrum». Actas de la Academia Nacional de Ciencias de los Estados Unidos de América. 1971. Volume 68. p. 136-138.
Editado por estudiantes de la Dra. Iris Keren: Allison Almeida, Matthew Cozzolino, Trung Nguyen y Jessica Wong.
NEUF2011