J Cancer 2020; 11(6):1341-1350. doi:10.7150/jca.40817
Documento de investigación
Amy C. Moreno1, Yan Heather Lin2, Isabelle Bedrosian3, Yu Shen2, Gildy V. Babiera3, Simona F. Shaitelman1 ![]()
1. Departamento de Oncología Radioterápica, Centro Oncológico MD Anderson de la Universidad de Texas, Houston, TX.
2. Departamento de Bioestadística, Centro Oncológico MD Anderson de la Universidad de Texas, Houston, TX.
3. Departamento de Oncología Quirúrgica, Centro Oncológico MD Anderson de la Universidad de Texas, Houston, TX.
Moreno AC, Lin YH, Bedrosian I, Shen Y, Babiera GV, Shaitelman SF. Resultados tras el tratamiento del cáncer de mama metaplásico frente a otros subtipos. J Cancer 2020; 11(6):1341-1350. doi:10.7150/jca.40817. Disponible en https://www.jcancer.org/v11p1341.htm
Objetivo: El cáncer de mama (CM) metaplásico es un subtipo histológico poco común pero agresivo de CM. Se buscó identificar los factores asociados a su diagnóstico y comparar el manejo y los resultados del CB metaplásico con los de otros CBs y el carcinoma ductal invasivo triple negativo en particular, dado lo frecuente que es su fenotipo triple negativo.
Pacientes y métodos: Identificamos a las mujeres diagnosticadas de CB invasivo en 2010-2014 en la Base de Datos Nacional de Cáncer, y utilizamos un análisis univariante para comparar las características basales de las pacientes y del tumor según el subtipo de CB. La supervivencia global (SG) se estimó con el método de Kaplan-Meier, y se utilizaron modelos multivariantes de riesgos proporcionales de Cox para identificar predictores independientes de la SG.
Resultados: De 247.355 casos, 2.084 (0,8%) eran CB metaplásicos, 55.998 (23%) CB triple negativos y el 77% otros CB. En comparación con el CB no metaplásico, las mujeres con CB metaplásico tenían más probabilidades de ser mayores en el momento del diagnóstico (mediana de edad, 62 frente a 59 años), tener ≥1 afecciones comórbidas (22% frente a 18%) y ser beneficiarias de Medicare (41% frente a 33%; P<0,001). Los CB metaplásicos tendían a ser de tipo basal (77%), y en relación con los CB triple negativos o de otro tipo, los CB metaplásicos se asociaban con un mayor estado clínico T (cT3-4, 18% frente a 11%, 8%), sin afectación ganglionar clínica (cN0, 86%, 77%, 80%), sin invasión linfovascular (72%, 65%, 62%) y con tumores de alto grado (71%, 77%, 35%) (P<0,001). La mayoría de los CB metaplásicos fueron tratados con mastectomía (58%), disección del ganglio linfático centinela (65%), irradiación de la pared torácica o de la mama (74%) y quimioterapia (75%) como terapia adyuvante (60%). En una mediana de seguimiento de 44,5 meses, las tasas de SG fueron más bajas para el CB metaplásico que para el CB triple negativo u otros CB en todos los estadios clínicos a 5 años (estadio I, 85%, 87%, 91%; II, 73%, 77%, 87%; III, 43%, 53%, 75%) y a 3 años (estadio IV, 15%, 22%, 64%; P<0,001). En el análisis multivariante, el aumento de la edad, el estadio clínico avanzado, la invasión linfovascular, la disección de los ganglios axilares (frente a los centinelas) y la ausencia de radiación o quimioterapia se asociaron con peores resultados en el CB metaplásico. La extensión de la cirugía afectó a la supervivencia del CB triple negativo y de otros CB, pero no a la del CB metaplásico.
Conclusión: Los resultados del CB metaplásico siguen siendo peores que los de otros subtipos de CB a pesar de los tratamientos modernos. La optimización de las opciones de terapia sistémica, que fue un predictor significativo de la supervivencia, debería ser una prioridad en el manejo del CB metaplásico.
Palabras clave: cáncer de mama metaplásico, cáncer de mama triple negativo, resultados del cáncer de mama, radioterapia, quimioterapia.
Introducción
Aunque el cáncer de mama es el diagnóstico de cáncer más común que afecta a las mujeres, con más de 268.000 casos documentados anualmente, el cáncer de mama (CB) metaplásico constituye menos del 1%-2% de todos los casos de cáncer de mama. Clínicamente, el CB metaplásico se manifiesta como una masa mamaria de rápido crecimiento con ecogenicidad compleja (es decir, componentes sólidos y quísticos) en la ecografía y una masa de alta densidad en la mamografía. Desde el punto de vista histológico, el CB metaplásico se compone de una población heterogénea de tumores que pueden clasificarse por la presencia de tipos de células no glandulares o mesenquimales o por una categorización adicional en subtipos dependiendo de la presencia de diversas características como células gigantes osteoclásticas o células fusiformes.
En la presentación, la tasa de afectación clínica de los ganglios linfáticos en el CB metaplásico suele ser baja. Sin embargo, el CB metaplásico se diagnostica con mayor frecuencia en estadios clínicos avanzados debido a que los tumores primarios son de mayor tamaño en comparación con otros CB y se asocia con mayores tasas de quimiorresistencia, metástasis a distancia y peor supervivencia global (SG). El CB metaplásico tiene una prevalencia particularmente alta de estado de receptor triple negativo o la ausencia de amplificación del receptor de estrógeno, del receptor de progesterona y del receptor del factor de crecimiento epidérmico humano 2 (HER2). Al no haber proteínas dirigidas, el CB metaplásico sigue siendo difícil de tratar. Los datos prospectivos son limitados para elegir el mejor tratamiento para el CB metaplásico, dada la rareza del diagnóstico. En su lugar, gran parte del tratamiento estándar actual para el CB metaplásico se ha extrapolado a partir de los resultados de pequeñas series de una sola institución o de informes de casos. Por lo tanto, utilizamos la Base de Datos Nacional del Cáncer (NCDB), que recoge aproximadamente el 70% de todos los casos de cáncer diagnosticados en los Estados Unidos, para evaluar las características, el manejo y los resultados basados en el tratamiento y las características del tumor de las pacientes con CB metaplásico en comparación con aquellas con CB triple negativo y todos los demás subtipos de CB. También se utilizó un análisis multivariante para identificar predictores independientes de la supervivencia de las mujeres con CB metaplásico.
Fuente de datos y selección de cohortes
Un proyecto conjunto establecido en 1989 por la Comisión de Cáncer del Colegio Americano de Cirujanos y la Sociedad Americana del Cáncer, el NCDB ha recogido datos oncológicos de aproximadamente 1.500 centros acreditados en Estados Unidos, con un total de más de 34 millones de registros. La información disponible de los pacientes está desidentificada y, por lo tanto, exenta de la supervisión de la protección humana por parte de la junta de revisión institucional.
Los criterios de selección utilizados para este estudio se describen en la Figura 1. Se incluyeron mujeres de 18 años o más a las que se les diagnosticó cáncer de mama invasivo entre 2010 y 2014. Se excluyeron las pacientes con estado de receptor hormonal (estrógeno y progesterona) desconocido (HR). Otros motivos de exclusión fueron la falta de información sobre la cirugía, la quimioterapia o la estadificación clínica según la 6ª o 7ª edición del American Joint Committee On Cancer (AJCC). A continuación, se estratificó a las pacientes en tres grupos: 1- CB metaplásico (con los códigos histológicos 8575 u 8573), 2- CB triple negativo (CBTN, que incluía sólo las histologías no metaplásicas), y 3- todos los demás tipos de CB. El término «CB no metaplásico» se utilizó para referirse al CB triple negativo y al resto de CB combinados.
Diagrama de CONSORT. BC, cáncer de mama.
 (Haga clic en la imagen para ampliarla.)
(Haga clic en la imagen para ampliarla.)
Variables
La información obtenida y analizada del NCDB incluía la edad del paciente en el momento del diagnóstico, el año de diagnóstico, la raza, el índice de comorbilidad de Charlson/Deyo, el estado del seguro médico, la mediana de los ingresos familiares y el tipo de centro de tratamiento (dicotomizado en académico/investigador frente a no académico). Las características clinicopatológicas incluían la designación clínica T y N (nodal) de la AJCC, el grupo de estadio clínico general de la AJCC, el estado del RH, el estado del receptor HER2, el grado del tumor y la invasión linfovascular (LVSI). Los subtipos moleculares se definieron como HR(+)/HER2(-), HER2(+), triple negativo (receptor de estrógeno(-), receptor de progesterona (-), HER2(-)) o desconocido. Las pacientes con CB metaplásico con estado de receptor triple negativo fueron etiquetadas como CB tn-metaplásico para distinguirlas del CBTN no metaplásico. El tratamiento primario incluía la cirugía (conservación de la mama, mastectomía o ninguna), la radioterapia con o sin inclusión de irradiación ganglionar regional, el uso de quimioterapia (neoadyuvante, adyuvante o ninguna) y la terapia hormonal. El tratamiento quirúrgico de la axila se definió como una disección de los ganglios axilares (ALND), con la extirpación de 10 ganglios linfáticos o más, o una disección del ganglio linfático centinela (SLND), cuando se extirparon <10 ganglios linfáticos.
Análisis estadístico
Se utilizó un análisis univariante para evaluar las posibles asociaciones entre las características demográficas, tumorales y clínicas y el diagnóstico de CB metaplásico, utilizando pruebas de chi-cuadrado para las variables categóricas y la prueba t/análisis de la varianza o sus homólogos de los enfoques no paramétricos (Wilcoxon rank-sum o Kruskal-Wallis) para las variables continuas. La SG se definió desde el momento del diagnóstico hasta el momento de la muerte. El tiempo de SG para los pacientes supervivientes se censuró a la derecha en el momento del último contacto. La distribución de la SG se estimó mediante el método de Kaplan-Meier. Se utilizó la prueba de rango logarítmico para comprobar la diferencia de supervivencia entre grupos. Se realizaron análisis de regresión de los datos de supervivencia basados en el modelo de riesgos proporcionales de Cox sobre la SG. Se obtuvo un modelo multivariante de riesgos proporcionales de Cox incluyendo primero un conjunto inicial de variables predictoras candidatas con un valor P < 0,05 en el análisis univariante. A continuación, se utilizó la eliminación hacia atrás por pasos, con 0,05 para el nivel de significación del chi-cuadrado de Wald para que un efecto se mantuviera en el modelo.
Los análisis de supervivencia se llevaron a cabo dentro de cada uno de los tipos de cáncer por separado.
La ubicación y el tipo de centro no se incluyeron en el proceso de selección del modelo de BC metaplásico porque ninguno de los dos factores fue estadísticamente significativo para este grupo en el ajuste univariante y los datos no estaban totalmente disponibles para los pacientes menores de 40 años. Para explorar si los detalles del tratamiento sistémico y la administración de radiación afectaban a los resultados entre los pacientes con CB metaplásico, realizamos análisis de subconjuntos en esta cohorte para evaluar la posible influencia de la secuencia de la quimioterapia y el alcance de los objetivos de la radiación en la SG. Todas las pruebas fueron de dos colas y la significación estadística se definió como un valor P <0,05. Se utilizó la versión 9.4 de SAS (SAS Institute, Cary, NC) y la versión 8.2 de S-Plus (TIBCO Software Inc, Palo Alto, CA) se utilizaron para realizar los cálculos de todos los análisis.
Características de la cohorte y del tumor
Identificamos a 247.355 mujeres con un diagnóstico de cáncer de mama invasivo en 2010-2014, de las cuales el 0,8% (n=2.084) tenían CB metaplásico, el 23% (n=55.998) CBT y el 77% (n=189.273) tenían otros CB. Las características sociodemográficas, clínicas y patológicas de los tumores de los pacientes, así como las características del tratamiento por tipo de cáncer de mama, se muestran en la Tabla 1. La mediana de edad fue de 63 años (rango 22-90) para las mujeres con CB metaplásico y de 59 años (rango 18-90) para el CBTN y otros CB. Las mujeres con CB metaplásico tenían con mayor frecuencia una puntuación de comorbilidad de ≥1 (22% frente al 18% de CBT frente al 16% de otros CB) y tenían seguro público (50% frente al 42% de CBT frente al 41% de otros CB) (todos P<0,001). El diagnóstico de CB metaplásico o CBTN se asoció más comúnmente con la raza negra que con otros CB (18% vs. 21% vs. 11%, P<0,001).
Se observaron diferencias significativas en el estadio clínico de la enfermedad y en las características del tumor según el tipo de cáncer. El CB metaplásico se diagnosticó a menudo en estadios más avanzados, ya que sólo el 31% de las pacientes con CB metaplásico tenían la enfermedad en estadio clínico I, frente al 46% del CBTN y el 54% de otros CB (P<0,001). Este patrón parecía correlacionarse con mayores tasas de tumores de mayor tamaño en el grupo de CB metaplásico (cT3-4, 18% frente a 11% frente a 8%, respectivamente), pero la presencia de afectación ganglionar clínica era la más baja para el CB metaplásico (cN1-3, 14% frente a 23% frente a 20%, respectivamente) (todos P<0,001). En contraste con el estado ganglionar clínico, las tasas de afectación ganglionar patológica fueron ligeramente inferiores para el CB metaplásico y el CBTN, pero se duplicaron para otros CB (pN1-3, 18% vs. 26% vs. 40%, respectivamente, P<0,001). Con respecto al estado de los receptores, el 77% del grupo de CB metaplásico tenía CB tn-metaplásico, lo que es 3,4 veces mayor que el grupo de CB no metaplásico (23%), de los cuales el HR(+)/HER2(-) era el subtipo molecular más común con un 59% (P<0,001). Además, sólo el 5% de los CB metaplásicos eran HER2(+) en comparación con el 16% de los CB no metaplásicos. Tanto el CB metaplásico como el CBT tenían casi el doble de proporción de tumores de grado 3 en relación con otros CB (71%, 77% y 35%, respectivamente, P<0,001), y el CB metaplásico tenía tasas más bajas de LVSI en relación con el CBT y otros CB (13%, 20% y 24%, respectivamente, P<0,001).
Características de los pacientes y del tratamiento.
| Características | Cosmosis metaplásica, n.º (%) | Cosmosis triplemente negativa, n.º (%) | Otros Cromosomas, n.º (%) | Valor P |
|---|---|---|---|---|
| Edad media, años (rango) | 62 (22-90) | 59 (18-90) | 59 (18-90) | 0.001 |
| Raza | ||||
| Blanco | 1623 (77,9) | 41791 (74,6) | 158406 (83.7) | <0,001 |
| Negro | 368 (17,7) | 11771 (21) | 20722 (10,9) | |
| Otros | 80 (3.8) | 2041 (3,6) | 8507 (4,5) | |
| Desconocido | 13 (0,6) | 395 (0,7) | 1638 (0.9) | |
| Puntuación de comorbilidad | ||||
| 0 | 1635 (78.5) | 45882 (81.9) | 158177 (83.6) | <0.001 |
| 1 | 349 (16.7) | 8107 (14.5) | 25524 (13.5) | |
| >=2 | 100 (4.8) | 2009 (3.6) | 5572 (2.9) | |
| Renta media | ||||
| <30.000 dólares | 251 (12) | 7110 (12.7) | 19154 (10.) | <0.001 |
| $30,000-$34,999 | 332 (15.9) | 9081 (16.2) | 28472 (15) | |
| $35,000-$45,999 | 580 (27.8) | 15084 (26.9) | 48845 (25.8) | |
| $46,000+ | 858 (41.2) | 23050 (41.2) | 86637 (45.8) | |
| Desconocido | 63 (3) | 1673 (3) | 6165 (3.3) | |
| Seguro médico | ||||
| Privado | 975 (46.8) | 30263 (54) | 105839 (55.9) | <0.001 |
| Medicaid | 154 (7,4) | 4716 (8,4) | 13267 (7) | |
| Medicare | 862 (41.4) | 18355 (32,8) | 61535 (32,5) | |
| Otros | 19 (0,9) | 665 (1,2) | 2212 (1.2) | |
| Sin seguro | 43 (2,1) | 1422 (2,5) | 4163 (2,2) | |
| Desconocido | 31 (1.5) | 577 (1) | 2257 (1.2) | |
| Tipo de condado | ||||
| Metropolitano | 1720 (82.5) | 46252 (82,6) | 157058 (83) | 0,152 |
| Urbano | 271 (13) | 7456 (13,3) | 24367 (12.9) | |
| Rural | 43 (2,1) | 951 (1,7) | 3219 (1.7) | |
| Desconocido | 50 (2.4) | 1339 (2.4) | 4629 (2.4) | |
| Tipo de centro | ||||
| Académico | 668 (32.1) | 16117 (28,8) | 52120 (27,5) | <0,001 |
| No académicos | 1318 (63,2) | 35472 (63,3) | 126101 (66.6) | |
| Desconocido | 98 (4.7) | 4409 (7.9) | 11052 (5.8) | |
| Localización del centro | ||||
| Medio Oeste | 614 (29.5) | 14132 (25.2) | 46644 (24.6) | <0.001 |
| Noreste | 410 (19,7) | 10411 (18,6) | 37787 (20) | |
| Sur | 716 (34,4) | 20595 (36.8) | 66519 (35.1) | |
| Oeste | 246 (11.8) | 6451 (11.5) | 27271 (14.4) | |
| Desconocido | 98 (4.7) | 4409 (7.9) | 11052 (5.8) | |
| Estado clínico de la enfermedad | ||||
| I | 639 (30.7) | 25843 (46,1) | 102257 (54) | <0,001 |
| II | 1215 (58,3) | 23912 (42,7) | 70846 (37.4) | |
| III | 201 (9,6) | 5579 (10) | 14283 (7,5) | |
| IV | 29 (1,4) | 664 (1.2) | 1887 (1) | |
| Estado clínico T | ||||
| Columna T0 | 5 (0.2) | 131 (0,2) | 341 (0,2) | <0,001 |
| cT1 | 674 (32,3) | 28452 (50,8) | 113113 (59.8) | |
| cT2 | 1026 (49,2) | 21530 (38,4) | 61145 (32,3) | |
| cT3 | 252 (12.1) | 3702 (6.6) | 10061 (5.3) | |
| cT4 | 127 (6.1) | 2183 (3.9) | 4613 (2.4) | |
| Estado clínico N | ||||
| N0 | 1787 (85.7) | 43357 (77.4) | 150890 (79.7) | <0,001 |
| cN1 | 224 (10,7) | 9659 (17,2) | 30427 (16,1) | |
| cN2 | 51 (2.4) | 1804 (3.2) | 5414 (2.9) | |
| cN3 | 22 (1.1) | 1178 (2.1) | 2542 (1.3) | |
| Estadio patológico | ||||
| 0 | 45 (2.2) | 4314 (7.7) | 5361 (2.8) | <0.001 |
| 1 | 582 (27.9) | 24787 (44.3) | 81680 (43.2) | |
| 2 | 1223 (58.7) | 20790 (37.1) | 72445 (38.3) | |
| 3 | 210 (10.1) | 5675( 10.1) | 28323 (15) | |
| 4 | 24 (1.2) | 432 (0.8) | 1464 (0.8) | |
| Estado T patológico | ||||
| pTis | 7 (0.3) | 432 (0,8) | 1862 (1) | <0,001 |
| pT0 | 42 (2) | 4250 (7.6) | 3972 (2.1) | |
| pT1 | 634 (30.4) | 29055 (51.9) | 106130 (56.1) | |
| pT2 | 1017 (48,8) | 18530 (33,1) | 63484 (33,5) | |
| pT3 | 290 (13.9) | 2540 (4,5) | 10588 (5,6) | |
| pT4 | 93 (4,5) | 1097 (2) | 2892 (1.5) | |
| pTX | 1 (0) | 94 (0.2) | 345 (0.2) | |
| Estado N patológico | ||||
| PN0 | 1705 (81.9) | 41587 (74,3) | 113787 (60,2) | <0,001 |
| pN1 | 284 (13.6) | 9725 (17.4) | 51483 (27.2) | |
| pN2 | 66 (3.2) | 3031 (5.4) | 16111 (8,5) | |
| pN3 | 27 (1,3) | 1607 (2,9) | 7685 (4.1) | |
| Agrupación de receptores | ||||
| RH(+)/HER2(-) | 334 (16) | 0 (0) | 143687 (75.9) | <0.001 |
| Triple negativo | 1604 (77) | 55998 (100) | 0 (0) | |
| HER2(+) | 97 (4.7) | 0 (0) | 38726 (20.5) | |
| Desconocido | 49 (2.4) | 0 (0) | 6860 (3.6) | |
| Grado del tumor | ||||
| 1 | 41 (2) | 988 (1.8) | 32015 (16.9) | <0.001 |
| 2 | 237 (11.4) | 9050 (16.2) | 80590 (42.6) | |
| 3 | 1485 (71.3) | 42930 (76.7) | 65482 (34.6) | |
| 4 | 37 (1.8) | 286 (0.5) | 438 (0.2) | |
| Desconocido | 284 (13,6) | 3030 (5.4) | 11186 (5.9) | |
| LVSI | ||||
| No presente | 1505 (72.2) | 36400 (65) | 118082 (62,4) | <0,001 |
| Presente | 263 (12,6) | 11091 (19,8) | 45681 (24.1) | |
| Desconocido | 316 (15.2) | 8507 (15.1) | 25510 (13.4) | |
| Tipo de cirugía | ||||
| CBS | 876 (42) | 29142 (52) | 92022 (48.6) | <0.001 |
| Mastectomía | 1200 (57,6) | 26561 (47,4) | 95910 (50.7) | |
| Sin cirugía | 8 (0,4) | 295 (0.5) | 1341 (0,7) | |
| Cirugía axilar | ||||
| Sin cirugía | 47 (2.3) | 1034 (1.8) | 4433 (2.3) | <.001 |
| SLND | 1353 (64.9) | 34880 (62.3) | 109718 (58) | |
| ALND | 666 (32) | 19229 (34.3) | 73181 (38.7) | |
| Desconocido | 18 (0.9) | 855 (1.5) | 1941 (1) | |
| Radioterapia | ||||
| Sí | 1087 (52.2) | 33938 (60,6) | 109268 (57,7) | <.001 |
| No | 989 (47,5) | 21860 (39) | 79375 (41.9) | |
| Desconocido | 8 (0,4) | 200 (0,4) | 630 (0.3) | |
| Objetivos de radiación | ||||
| Sólo mama/CW | 803 (73.9) | 24704 (72.8) | 72410 (66.3) | <0.001 |
| Seno/CW + ganglios regionales | 284 (26,1) | 9234 (27,2) | 36858 (33.7) | |
| Quimioterapia | ||||
| Sí | 1571 (75.4) | 44321 (79,1) | 133965 (70,8) | <0,001 |
| No | 499 (23.9) | 11195 (20) | 53062 (28) | |
| Desconocido | 14 (0,7) | 482 (0,9) | 2246 (1.2) | |
| Secuencia de quimioterapia a cirugía | ||||
| Adyuvante | 1241 (59,5) | 31519 (56.3) | 116645 (61,6) | <0,001 |
| Neoadyuvante | 324 (15.5) | 12581 (22,5) | 16717 (8,8) | |
| Ninguno | 519 (24.9) | 11898 (21.2) | 55911 (29.5) | |
| Terapia hormonal | ||||
| Sí | 220 (10.6) | 1178 (2,1) | 103906 (54,9) | <0,001 |
| No | 1798 (86,3) | 53274 (95.1) | 76820 (40,6) | |
| Desconocido | 66 (3,2) | 1546 (2,8) | 8547 (4.5) | |
| Año del diagnóstico | ||||
| 2010 | 309 (14.8) | 9605 (17.2) | 36712 (19.4) | <0.001 |
| 2011 | 393 (18.9) | 11163 (19.9) | 38815 (20.5) | |
| 2012 | 458 (22) | 11205 (20) | 39364 (20.8) | |
| 2013 | 463 (22.2) | 11992 (21.4) | 37764 (20) | |
| 2014 | 461 (22.1) | 12033 (21.5) | 36618 (19,3) |
Abreviaturas: BC, cáncer de mama; ALND, disección de ganglio linfático axilar; BCS, cirugía conservadora de la mama; CW, pared torácica; HER2, receptor del factor de crecimiento epidérmico humano; HR, receptor hormonal; LVSI, invasión linfovascular; SLND, disección del ganglio linfático centinela.
Tratamiento según el tipo de cáncer de mama
La mayoría de las pacientes (99%) se sometieron a cirugía oncológica de la mama, incluida la evaluación quirúrgica de la axila (97%). La mastectomía se utilizó con mayor frecuencia en el grupo de CB metaplásico (58% frente al 47% de CBT frente al 51% de otros CB, P<0,001), al igual que la SLND (65% frente al 62% de CBT frente al 58% de otros CB; P<0,001). La irradiación ganglionar regional se utilizó con más frecuencia como parte del tratamiento para otros CB que para el CB metaplásico y el CMNT (26%, 27% y 34%; P<0,001), respectivamente.
Con respecto a la terapia sistémica, la quimioterapia neoadyuvante se utilizó casi dos veces más para el CB metaplásico y el CMNT que para otros CB (16%, 23%, 9%; P<0,001), y aproximadamente una cuarta parte de todas las mujeres no recibió ninguna quimioterapia. La terapia hormonal se utilizó con menos frecuencia en el caso del CMNT (2%), pero formó parte del paradigma de tratamiento en el 11% de los casos de CB metaplásico y en el 55% de los demás CB.
Análisis de supervivencia
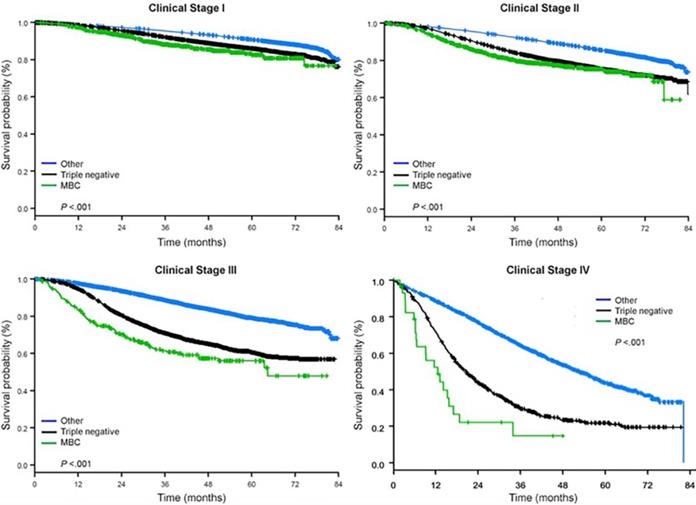
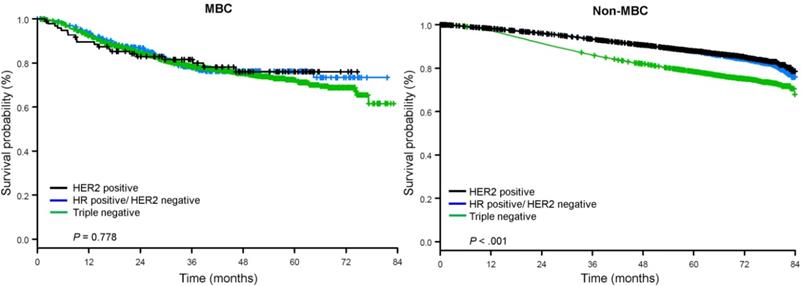
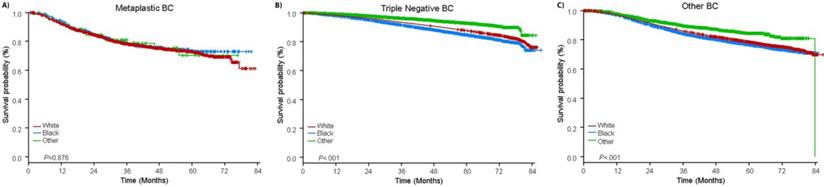
La mediana del tiempo de seguimiento fue de 44,5 meses. Los pacientes con CB metaplásico tuvieron una SG no ajustada significativamente peor, independientemente del estadio clínico (Fig. 2). Las estimaciones de la SG a 5 años para los pacientes con CB metaplásico, CBTN y otros CB en estadio I fueron del 85%, 87% y 91%; las del estadio II fueron del 73%, 77% y 87%; y las del estadio III fueron del 43%, 53% y 75% (P<0,001). Las tasas de SG a 3 años para pacientes con enfermedad metastásica fueron de 2 a 4 veces más altas para los grupos de CMN y otros CB, con un 30% y un 64%, en comparación con el 15% para los CB metaplásicos (P<0,001). También se analizó la supervivencia por subtipo molecular (Fig. 3). Entre los pacientes con CB metaplásico, no se apreciaron diferencias en la SG por subtipo molecular (CB con HR(+)/HER2(-), HER2(+) o tn-metaplásico) (P=0,778). Por el contrario, en el caso del cáncer de mama no metaplásico, el subtipo triple negativo se asoció a una peor SG que los subtipos HER+ y HR(+)/HER2(-) (P<0,001). La raza tampoco parecía estar asociada a la supervivencia entre las pacientes con CB metaplásico (tasas de SG a 5 años del 73% para las blancas frente al 74% para las negras, P=0,876), mientras que la raza estaba asociada a la SG tanto en el CBTN (P<0,001) como en otros grupos de CB (P<0,001; Fig. 4).
Curvas de supervivencia global de los tipos de cáncer de mama por estadio clínico, examinando los cánceres de mama metaplásico, triple negativo y otros. Abreviatura: CMM, cáncer de mama metaplásico.
 (Haga clic en la imagen para ampliarla.)
(Haga clic en la imagen para ampliarla.)
Curvas de supervivencia global de pacientes con cáncer de mama metaplásico y no metaplásico estratificadas por estado del receptor. Abreviaturas: HER2, receptor del factor de crecimiento epidérmico humano 2; HR, receptor hormonal; CMM, cáncer de mama metaplásico.
 (Haga clic en la imagen para ampliarla.)
(Haga clic en la imagen para ampliarla.)
Curvas de supervivencia global de pacientes con cáncer de mama metaplásico, triple negativo y otros estratificados por raza. Abreviaturas: BC, cáncer de mama.
 (Haga clic en la imagen para ampliarla.)
(Haga clic en la imagen para ampliarla.)
Análisis multivariable de los factores asociados a la supervivencia global de las pacientes con BC metaplásico.
| Factores asociados a la supervivencia global en el CB metaplásico | |||
|---|---|---|---|
| Variable (Referencia) | Razón de riesgo (intervalo de confianza del 95%) | Valor P | |
| Edad | Aumento por año | 1.024 (1,015-1,033) | <0,0001 |
| Invasión linfovascular (Ninguna) | Presente | 1,307 (1,017-1,679) | 0.0364 |
| Estado clínico N (cN0) | cN+ | 1,758 (1,328-2,326) | <0.0001 |
| Estado clínico T (cT1) | cT0 | 2.226 (0.301-16.447) | <0,0001 |
| cT2 | 1,454 (1,102-1.918) | ||
| cT3 | 3,029 (2,183-4,204) | ||
| cT4 | 3.145 (2.124-4.657) | ||
| Estado clínico M (cM0) | cM1 | 3.330 (2.020-5.488) | <0,0001 |
| Cirugía axilar (SLND) | ALND | 1.333 (1,065-1,670) | 0,0247 |
| Sin cirugía | 1,538 (0.884-2.675) | ||
| Radiación (No) | Sí | 0,709 (0.572-0,878) | 0,0016 |
| Quimioterapia (No) | Sí | 0,579 (0,446-0,752) | <0,0001 |
Abreviaturas: ALND, disección de los ganglios linfáticos axilares; CB, cáncer de mama; SLND, disección del ganglio linfático centinela.
En el análisis multivariante, el aumento de la edad, la clasificación clínica T más alta, la presencia de enfermedad ganglionar clínica o LVSI y el tratamiento con ALND se correlacionaron con peores resultados para las pacientes con CB metaplásico, CBTN y otros CB (Tabla suplementaria 1). La adición de quimioterapia y radioterapia mejoró de forma independiente la SG, independientemente del tipo de cáncer de mama. Otras características de las pacientes y del tumor asociadas a la supervivencia en el CMNT y otros CB, como la raza, las comorbilidades y el grado del tumor, no se asociaron a los resultados de supervivencia del CB metaplásico en el análisis multivariante.
Dados los resultados relativamente malos entre las pacientes con CB metaplásico, se realizaron análisis de subgrupos en el grupo de CB metaplásico para evaluar si alguna modalidad de tratamiento se asociaba a una mejora de los resultados. Tras ajustar por el estado ganglionar (cN0 frente a N+), el tratamiento con una cirugía axilar más agresiva (ALND frente a SLND) se asoció con peores resultados, un fenómeno que también se observó entre los CBTN y otros CB (Tabla 2). Entre las pacientes que recibieron radioterapia, el tratamiento con irradiación ganglionar regional frente a la radiación sólo en la mama o en la pared torácica no influyó significativamente en los resultados entre las pacientes con CB metaplásico (P=0,077 y 0,200 para N0 y N+ clínico, respectivamente). La recepción de quimioterapia neoadyuvante se asoció con peores resultados que la quimioterapia adyuvante entre las pacientes con CB metaplásico con ganglios clínicos negativos (HR 1,9; IC del 95%: 1,3-2,6; P<0.001), pero no en las pacientes con CB metaplásico con ganglios clínicos positivos (P=0,43).
Discusión
El cáncer de mama metaplásico es una forma rara pero particularmente agresiva de cáncer de mama, especialmente cuando se compara con otros subtipos de tumores de mama. Esta entidad de enfermedad ha estado relativamente poco representada en la literatura. Una búsqueda exhaustiva de Rayson et al. en las publicaciones de 1966 a 1997 arrojó un total de sólo 27 casos. Las grandes bases de datos nacionales, como la NCDB, son ventajosas para el estudio de cánceres raros como el CB metaplásico. Sin embargo, la incidencia del diagnóstico de CB metaplásico en los Estados Unidos según estas bases de datos sigue siendo baja, con menos de 500 casos al año. En nuestro estudio, descubrimos que el CB metaplásico se diagnosticaba con mayor frecuencia como un tumor de gran tamaño con características de riesgo adversas, como un grado de tumor poco diferenciado y un estado de receptor triple negativo. Los pacientes con CB metaplásico tenían una supervivencia significativamente peor, independientemente del estadio en el momento de la presentación, en comparación con el CB triple negativo y otros CB. La recepción de quimioterapia y radioterapia fueron predictores independientes de una mejor SG, pero la secuencia de la quimioterapia pareció afectar a los resultados, en particular para las pacientes con CB metaplásico sin afectación ganglionar clínica, reconociendo que algunas de estas pacientes tenían afectación ganglionar patológica. Sin embargo, nuestros resultados pueden reflejar una posible heterogeneidad en los mecanismos biológicos subyacentes que impulsan las respuestas a los tratamientos en este grupo particular de pacientes con CB y destacan la necesidad de mejorar la estratificación del riesgo y las opciones de terapia sistémica para mejorar los resultados.
Aunque la mayoría de los CB metaplásicos tienen un fenotipo triple negativo, el comportamiento de los CB metaplásicos parece ser único en comparación con otros CBTN. El CBTN tiende a tener un peor pronóstico que otros tipos de CB, y la noción de que el CB metaplásico es más agresivo que el CBTN ha sido corroborada por múltiples investigaciones retrospectivas más pequeñas. Dichos estudios han mostrado patrones similares de diagnóstico en estadios avanzados para el CB metaplásico frente al CBTN, debido a las mayores tasas de enfermedad cT3-4 en lugar de la afectación ganglionar, y en una revisión de una sola institución de 46 casos de CB metaplásico, las pacientes con CB metaplásico tenían un riesgo significativamente mayor de recurrencia local de la enfermedad (30% frente al 15%; P=0,004). Estas características se correlacionaron finalmente con tasas inferiores de supervivencia libre de enfermedad a 5 años (30% frente a 90%; P<0,001) y de SG (65% frente a 87%; P=0,002) para las pacientes con CB metaplásico en relación con el CBTN. Un estudio de Surveillance Epidemiology and End Results de 1.1112 pacientes con CB metaplásico también mostró peores tasas de supervivencia específica al cáncer a los 3 años para el CB metaplásico que para el CBTN (78% frente a 84%). Al examinar el CB tn-metaplásico, Li et al. encontraron una peor supervivencia libre de enfermedad (HR 1,48; IC del 95%: 1,19-1,84; P<0,01) y SG (HR 1,42 ; P<0,01) para el CB tn-metaplásico en comparación con el CBTN. Nuestro estudio, que incluyó uno de los mayores grupos de pacientes con CB metaplásico hasta la fecha (n=2.084), refuerza estos hallazgos y destaca que el estado del receptor no es un predictor independiente de la supervivencia para el CB metaplásico (P=0.Un componente terapéutico fundamental asociado a la mejora de los resultados en todas las pacientes con cáncer de mama metaplásico en nuestro estudio fue el uso de quimioterapia (HR 0,58; IC del 95%: 0,45-0,75; P<0,001). Nuestro informe es el primero, hasta donde sabemos, que informa sobre los resultados en el CB metaplásico en función de la secuencia de quimioterapia. Llamativamente, nuestro subanálisis encontró que para los pacientes con CB metaplásico cN0 en particular, la quimioterapia neoadyuvante se asoció con una peor SG en comparación con la quimioterapia adyuvante (HR 1,88; IC del 95%: 1,34-2,64; P<0,001), mientras que la secuenciación de la quimioterapia no tuvo ningún efecto en el CB metaplásico clínicamente positivo. Una posible explicación de esto puede ser que nuestras pacientes con CB metaplásico tenían un estado clínico T más alto, que en otros informes se ha asociado con tasas más bajas de respuesta patológica completa y resultados de supervivencia posteriores peores. Además, los métodos de estadificación clínica (es decir, el examen físico solo, la incorporación de la ultrasonografía) pueden introducir heterogeneidad en una población clínica N0 al pasar por alto la verdadera carga de enfermedad ganglionar, lo que en sí mismo puede estar asociado a resultados inferiores. En general, se ha informado de que la respuesta del CB metaplásico a la quimioterapia neoadyuvante es tan baja como el 18%, que es mucho más baja que las tasas de respuesta conocidas para el CBTN a los regímenes de quimioterapia basados en antraciclinas y taxanos.
A partir de la peor supervivencia y el desarrollo relativamente rápido de la propagación metastásica a distancia, en comparación con otros subtipos de cáncer de mama observados en nuestro estudio y en otros informes, la necesidad de mejores opciones de terapia sistémica es claramente evidente para el CB metaplásico. Los perfiles transcripcionales han demostrado que este subtipo de cáncer presenta una firma tumorigénica con características similares a las de las células madre, frecuentes aberraciones en la vía PI3K/AKT/mTOR y sobreexpresión del factor de crecimiento endotelial vascular (VEGF). Estas características son similares a las encontradas en los TNBC mesenquimales. Se están realizando esfuerzos prometedores para identificar regímenes terapéuticos sistémicos alternativos para estas pacientes, incluyendo un reciente ensayo de fase I que mostró mejores tasas de respuesta objetiva a la doxorrubicina liposomal, bevacizumab (anticuerpo monoclonal contra el VEGF-A) y everolimus (inhibidor de mTOR) en pacientes con CMT metaplásico con una aberración de la vía PI3K.
Con respecto a los tratamientos locales, la mastectomía se utilizó con mayor frecuencia en nuestro estudio para el CB metaplásico, pero no se asoció con una mayor supervivencia en relación con la cirugía para conservar la mama. Además, no se encontró ningún beneficio de supervivencia con el tratamiento que incorporaba la DGLA frente a la DGSL. La radioterapia, sin embargo, fue un factor predictivo significativo de la supervivencia, ya que las pacientes con CB metaplásico tratadas con radioterapia adyuvante tenían un 30% menos de probabilidades de morir que las que no recibieron radiación. Las limitaciones relevantes de nuestro análisis de la radioterapia incluyen detalles desconocidos sobre la planificación del tratamiento, la modalidad seleccionada, la garantía de calidad o si se utilizaron técnicas como la contención de la respiración inspiradora profunda. Aunque la recaída locorregional no puede examinarse en el NCDB, una serie institucional de 113 pacientes con CB metaplásico (54% que recibieron radioterapia) mostró que la radiación fue el único factor que se correlacionó con la reducción de la recidiva locorregional (riesgo relativo sin radiación 31; IC del 95%: 1,13-9,88; P=0,027).
Nuestros resultados deben interpretarse con cautela dadas las importantes limitaciones que supone no saber qué regímenes de quimioterapia se utilizaron, la duración de los tratamientos o la respuesta a la quimioterapia neoadyuvante, ya que esa información no está disponible en el NCDB. También reconocemos las limitaciones de los factores de riesgo clínico recogidos en el NCDB, sin los cuales puede no ser factible caracterizar completamente las diferencias clínicas que impulsan algunas de las diferencias de resultados que hemos encontrado, como los peores resultados de supervivencia con ALND incluso cuando se controla el estado de los ganglios linfáticos. Aunque el tamaño de nuestra muestra de pacientes con cáncer de mama metaplásico fue pequeño en comparación con los estudios sobre cáncer de mama no metaplásico, paradójicamente también es el mayor estudio existente hasta la fecha en el que se examina esta cuestión, dado el limitado número de pacientes con cáncer de mama metaplásico que aparece en las series institucionales. Se necesitan investigaciones adicionales para comprender la predilección biológica por la diseminación metastásica en el CB metaplásico y validar nuestros hallazgos en conjuntos de datos separados de pacientes con CB metaplásico.
Nuestro estándar de atención actual no es claramente adecuado para esta población de cáncer única, y la obtención de datos aleatorios sobre el CB metaplásico en el futuro requerirá esfuerzos de cooperación debido al pequeño número de pacientes. El NCDB ofrece un punto fuerte digno de mención, que es la capacidad de estudiar los patrones de tratamiento y los resultados asociados a un diagnóstico poco frecuente. Con 2.084 individuos con CB metaplásico en esta cohorte, se trata de una de las mayores investigaciones sobre CB metaplásico notificadas en la era moderna. La supervivencia de estos pacientes es escasa en comparación con la de otros tipos de cáncer de mama, y aunque este hecho probablemente impulsa la incorporación de una terapia agresiva, nuestro estudio sugiere que debería considerarse cuidadosamente un tratamiento local-regional más extenso (por ejemplo, ALND o irradiación de los ganglios regionales) en cada caso. En general, el uso de la terapia sistémica es crucial para el manejo del CB metaplásico independientemente de la carga ganglionar, y el desarrollo de terapias dirigidas eficaces basadas en el análisis del perfil genómico del tumor es prometedor para el futuro.
Material complementario
![]()
Tabla complementaria.
Agradecimientos
Gracias especiales a Christine Wogan por su asistencia editorial.
Financiación
Apoyada en parte por Cancer Center Support (Biostatistics Core) Grant CA016672 del National Cancer Institute, National Institutes of Health, a The University of Texas MD Anderson Cancer Center.
Intereses en competencia
Los autores han declarado que no existen intereses en competencia.
1. Siegel RL, Miller KD, Jemal A. Cancer statistics, 2018. CA Cancer J Clin. 2018;68(1):7-30
2. Yerushalmi R, Hayes MM, Gelmon KA. Carcinoma de mama-tipos raros: revisión de la literatura. Ann Oncol. 2009;20(11):1763-1770
3. Günhan-Bilgen I, Memiş A, Ustün EE, Zekioglu O, Ozdemir N. Metaplastic carcinoma of the breast: clinical, mammographic, and sonographic findings with histopathologic correlation. AJR Am J Roentgenol. 2002;178(6):1421-1425
4. Jung S-Y, Kim HY, Nam B-H. et al. Worse prognosis of metaplastic breast cancer patients than other patients with triple-negative breast cancer. Breast Cancer Res Treat. 2010;120(3):627-637
5. Wargotz ES, Norris HJ. Metaplastic carcinomas of the breast: V. Metaplastic carcinoma with osteoclastic giant cells. Hum Pathol. 1990;21(11):1142-1150
6. Wargotz ES, Norris HJ. Metaplastic carcinomas of the breast. I. Matrix-producing carcinoma. Hum Pathol. 1989;20(7):628-635
7. Wargotz ES, Deos PH, Norris HJ. Metaplastic carcinomas of the breast. II. Spindle cell carcinoma. Hum Pathol. 1989;20(8):732-740
8. Lee H, Jung S-Y, Ro JY. et al. Metaplastic breast cancer: clinicopathological features and its prognosis. J Clin Pathol. 2012;65(5):441-446
9. He X, Ji J, Dong R. et al. Prognosis in different subtypes of metaplastic breast cancer: a population-based analysis. Breast Cancer Res Treat. Octubre. 2018
10. Base de datos nacional sobre el cáncer.
11. Chagpar AB, Scoggins CR, Martin RCG. et al. Factores que determinan la adecuación de la disección de los ganglios axilares en pacientes con cáncer de mama. Breast J. 2007;13(3):233-237
12. Bembenek A, Schlag PM. Disección de los ganglios linfáticos en el cáncer de mama. Langenbeck’s Arch Surg. 2000;385(4):236-245
13. Woolson RF. Woolson RF. Statistical Methods for the Analysis of Biomedical Data. New York, USA: John Wiley & Sons. 1987
14. Kaplan EL, Meier P. Nonparametric Estimation from Incomplete Observations NONPARAMETRIC ESTIMATION FROM INCOMPLETE OBSERVATIONS*. Fuente J Am Stat Assoc. 1958;53(282):457-481
15. Mantel N. Evaluation of survival data and two new rank order statistics arising in its consideration. Cancer Chemother Rep. 1966;50(3):163-170
16. D.R. C. Modelos de regresión y tablas de vida. Tablas de vida de Cox. 1972;2:187-220
17. Rayson D, Adjei AA, Suman VJ, Wold LE, Ingle JN. Metaplastic breast cancer: prognosis and response to systemic therapy. Ann Oncol Off J Eur Soc Med Oncol. 1999;10(4):413-419
18. Bilimoria KY, Stewart AK, Winchester DP, Ko CY. La base de datos nacional sobre el cáncer: una poderosa iniciativa para mejorar la atención del cáncer en los Estados Unidos. Ann Surg Oncol. 2008;15(3):683-690
19. Ong CT, Campbell BM, Thomas SM. et al. Metaplastic Breast Cancer Treatment and Outcomes in 2500 Patients: Un análisis retrospectivo de una base de datos nacional de oncología. Ann Surg Oncol. 2018;25(8):2249-2260
20. Dietze EC, Sistrunk C, Miranda-Carboni G, O’Regan R, Seewaldt VL. Cáncer de mama triple negativo en mujeres afroamericanas: disparidades frente a la biología. Nat Rev Cancer. 2015;15(4):248-254
21. Rakha EA, El-Sayed ME, Green AR, Lee AHS, Robertson JF, Ellis IO. Marcadores de pronóstico en el cáncer de mama triple negativo. Cancer. 2007;109(1):25-32
22. ROJAS K, STUCKEY A. Breast Cancer Epidemiology and Risk Factors. Clin Obstet Gynecol. 2016;59(4):651-672
23. Liao H-Y, Zhang W-W, Sun J-Y, Li F-Y, He Z-Y, Wu S-G. Las características clinicopatológicas y los resultados de supervivencia de los diferentes subtipos histológicos en el cáncer de mama triple negativo. J Cancer. 2018;9(2):296-303
24. El Zein D, Hughes M, Kumar S. et al. El carcinoma metaplásico de mama es más agresivo que el cáncer de mama triple negativo: A Study From a Single Institution and Review of Literature. Clin Breast Cancer. 2017;17(5):382-391
25. Liedtke C, Mazouni C, Hess KR. et al. Respuesta a la terapia neoadyuvante y supervivencia a largo plazo en pacientes con cáncer de mama triple negativo. J Clin Oncol. 2008;26(8):1275-1281
26. Cortazar P, Zhang L, Untch M. et al. Pathological complete response and long-term clinical benefit in breast cancer: the CTNeoBC pooled analysis. Lancet. 2014;384(9938):164-172
27. Fisher B, Brown A, Mamounas E. et al. Efecto de la quimioterapia preoperatoria en la enfermedad local-regional en mujeres con cáncer de mama operable: hallazgos del Proyecto Nacional Quirúrgico Adyuvante de Mama e Intestino B-18. J Clin Oncol. 1997;15(7):2483-2493
28. Chen IC, Lin CH, Huang CS. et al. Lack of efficacy to systemic chemotherapy for treatment of metaplastic carcinoma of the breast in the modern era. Breast Cancer Res Treat. 2011;130(1):345-351
29. Hennessy BT, González-Angulo A-M, Stemke-Hale K. et al. Characterization of a natural occurring breast cancer subset enriched in epithelial-to-mesenchymal transition and stem cell characteristics. Cancer Res. 2009;69(10):4116-4124
30. Prat A, Parker JS, Karginova O. et al. Phenotypic and molecular characterization of the claudin-low intrinsic subtype of breast cancer. Breast Cancer Res. 2010;12(5):R68
31. Yu K-D, Zhu R, Zhan M. et al. Identificación de subgrupos relevantes para el pronóstico en pacientes con cáncer de mama triple negativo quimiorresistente. Clin Cancer Res. 2013;19(10):2723-2733
32. Basho RK, Yam C, Gilcrease M. et al. Comparative Effectiveness of an mTOR-Based Systemic Therapy Regimen in Advanced, Metaplastic and Nonmetaplastic Triple-Negative Breast Cancer. Oncologist. 2018;23(11):1300-1309
33. Basho RK, Gilcrease M, Murthy RK. et al. Targeting the PI3K/AKT/mTOR Pathway for the Treatment of Mesenchymal Triple-Negative Breast Cancer. JAMA Oncol. 2017;3(4):509
34. Bergom C, Currey A, Desai N, Tai A, Strauss JB. Mantenimiento de la respiración en inspiración profunda: técnicas y ventajas para la preservación cardíaca durante la irradiación del cáncer de mama. Front Oncol. 2018;8:87
35. Latty D, Stuart KE, Wang W, Ahern V. Revisión de las técnicas de contención de la respiración en inspiración profunda para el tratamiento del cáncer de mama. J Med Radiat Sci. 2015;62(1):74-81
36. Leyrer CM, Berriochoa CA, Agrawal S. et al. Factores predictivos sobre los resultados en el cáncer de mama metaplásico. Breast Cancer Res Treat. 2017;165(3):499-504
37. Takala S, Heikkilä P, Nevanlinna H, Blomqvist C, Mattson J. Carcinoma metaplásico de mama: Pronóstico y respuesta al tratamiento sistémico en la enfermedad metastásica. Breast J. 2019;25(3):418-424
38. Harper NW, Hodges KB, Stewart RL. et al. Tratamiento adyuvante del cáncer de mama metaplásico triple negativo con paclitaxel semanal y quimioterapia con platino: Retrospective Case Review From a Single Institution. Clin Breast Cancer. May. 2019