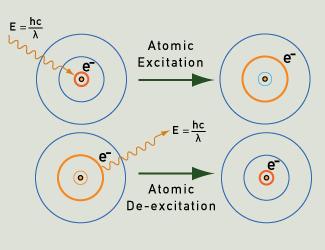
Los fotones de luz se emiten cuando un electrón vuelve a su estado básico después de ser excitado.
Pruebas de llama
Las pruebas de llama son útiles porque las excitaciones de los gases producen un espectro de emisión de líneas características para un elemento. En comparación, la incandescencia produce una banda continua de luz con un pico que depende de la temperatura del objeto caliente.
Cuando los átomos de un gas o vapor son excitados, por ejemplo por calentamiento o por la aplicación de un campo eléctrico, sus electrones son capaces de pasar de su estado básico a niveles de energía más altos. Al volver a su estado básico, siguiendo trayectorias claramente definidas según probabilidades cuánticas, emiten fotones de energía muy específica. Esta energía se corresponde con determinadas longitudes de onda de la luz y, por tanto, produce determinados colores de luz. Cada elemento tiene una «huella dactilar» en términos de su espectro de emisión de líneas, como se ilustra en los siguientes ejemplos.

Espectro de líneas para el hidrógeno.

Espectro de líneas para el helio.

Espectro de línea para el neón.
Debido a que cada elemento tiene un espectro de emisión de línea exactamente definido, los científicos pueden identificarlos por el color de la llama que producen. Por ejemplo, el cobre produce una llama azul, el litio y el estroncio una llama roja, el calcio una llama naranja, el sodio una llama amarilla y el bario una llama verde.

Esta imagen ilustra los colores distintivos producidos por la combustión de elementos particulares.

La llama de un soplete oxiacetilénico arde a más de 3.000ºC, lo suficientemente caliente como para utilizarla en la soldadura submarina.
La llama
El color nos habla de la temperatura de la llama de una vela. El núcleo interno de la llama de una vela es de color azul claro, con una temperatura de unos 1670 K (1400 °C). Es la parte más caliente de la llama. El color del interior de la llama pasa a ser amarillo, naranja y finalmente rojo. Cuanto más se aleje del centro de la llama, más baja será la temperatura. La parte roja está en torno a los 1070 K (800 °C).
Los colores naranja, amarillo y rojo en una llama no están relacionados únicamente con la temperatura del color. Las excitaciones de los gases también desempeñan un papel importante en el color de la llama. Uno de los principales componentes de una llama encendida es el hollín, que tiene una composición compleja y diversa de compuestos de carbono. La variedad de estos compuestos crea una gama prácticamente continua de posibles estados cuánticos a los que se pueden excitar los electrones. El color de la luz emitida depende de la energía emitida por cada electrón que regresa a su estado original.