Propiedades del agua
Una de las cosas que hace especial a nuestro planeta es la presencia de agua líquida. El agua es fundamental para toda la vida; sin ella todo ser vivo moriría.
El agua cubre aproximadamente el 70% de la superficie de la Tierra y constituye el 65-75% de nuestro cuerpo (el 82% de nuestra sangre es agua). Aunque el agua pueda parecer aburrida -sin color, sabor ni olor-, tiene propiedades sorprendentes que la hacen necesaria para mantener la vida.
(Nuestra necesidad de agua y los animales del océano que viven en el agua, es lo que hace que los vertidos de petróleo sean tan perjudiciales.)
La composición química del agua es H2O – dos átomos de hidrógeno y uno de oxígeno. Las propiedades del agua son especiales debido a la forma en que sus átomos se unen para formar una molécula de agua, y a la forma en que las moléculas interactúan entre sí.
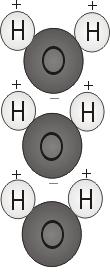
Polaridad del agua
Cuando los dos átomos de hidrógeno se unen al oxígeno, se adhieren a la parte superior de la molécula como las orejas de Mickey Mouse. Esta estructura molecular confiere a la molécula de agua polaridad, o una carga eléctrica asimétrica que atrae a otros átomos.
El extremo de la molécula con los dos átomos de hidrógeno está cargado positivamente. El otro extremo, con el oxígeno, está cargado negativamente. Al igual que en un imán, donde los polos norte se atraen a los polos sur («los opuestos se atraen»), el extremo positivo de la molécula de agua se conectará con el extremo negativo de otras moléculas.
¿Qué significa esto para nosotros? La polaridad del agua le permite disolver fácilmente otras sustancias polares. Cuando se introduce una sustancia polar en el agua, los extremos positivos de sus moléculas son atraídos por los extremos negativos de las moléculas de agua, y viceversa. Las atracciones hacen que las moléculas de la nueva sustancia se mezclen uniformemente con las moléculas de agua.
El agua disuelve más sustancias que cualquier otro líquido, ¡incluso el ácido más fuerte! Por ello, a menudo se le llama el «disolvente universal». El poder de disolución del agua es muy importante para la vida en la Tierra. Dondequiera que vaya el agua, lleva disueltas sustancias químicas, minerales y nutrientes que se utilizan para mantener a los seres vivos.
Debido a su polaridad, las moléculas de agua se atraen fuertemente entre sí, lo que da al agua una alta tensión superficial. Las moléculas de la superficie del agua se «pegan» para formar una especie de «piel» en el agua, lo suficientemente fuerte como para soportar objetos muy ligeros. Los insectos que caminan sobre el agua se aprovechan de esta tensión superficial.
La tensión superficial hace que el agua se agrupe en gotas en lugar de extenderse en una fina capa.
También permite que el agua se mueva a través de las raíces y los tallos de las plantas, los termómetros y los vasos sanguíneos más pequeños del cuerpo. Cuando una molécula asciende, «arrastra» a las demás con ella.
Tres estados de la materia
El agua es uno de los cuatro elementos, y la única sustancia natural que puede existir en los tres estados de la materia -sólido, líquido y gaseoso- a las temperaturas habituales de la Tierra.
Muchas otras sustancias tienen que ser sobrecalentadas o enfriadas para cambiar de estado.
El estado gaseoso del agua está presente continuamente en nuestra atmósfera como vapor de agua. El estado líquido se encuentra en todos los ríos, lagos y océanos.
El estado sólido del agua, el hielo, es único. La mayoría de los líquidos se contraen al enfriarse, porque las moléculas se mueven más lentamente y tienen menos energía para resistir la atracción entre ellas. Cuando se congelan y se convierten en sólidos, forman cristales muy apretados que son mucho más densos que el líquido original.
El agua no actúa así. Cuando se congela, se expande: las moléculas se alinean para formar una estructura cristalina muy «abierta» que es menos densa que el agua líquida.
Por eso el hielo flota. ¡Y es bueno que lo haga! Si el agua actuara como la mayoría de los otros líquidos, los lagos y los ríos se congelarían y toda la vida en ellos moriría.
Tres otras propiedades del agua
El agua tiene un alto calor específico. Es decir, a diferencia del aire, el agua puede absorber mucho calor sin cambiar de temperatura. Por eso nadar resulta tan refrescante en un día caluroso.
El agua también pierde el calor más lentamente que el aire. El resultado es que, en verano, el agua de los lagos y los océanos suele estar más fría al principio de la estación y más caliente al final (después de muchos días de absorber la energía del sol).
El punto de ebullición del agua (212° F o 100°C a nivel del mar) se ve afectado por la altitud. En general, cuanto mayor sea la altitud, menor será el punto de ebullición del agua. Por ejemplo, en Denver, CO (5.280 pies), el agua hierve a 202,4° F. En el Monte Everest en Nepal (29.012 pies), el agua hierve a 156° F.
Proyectos de ciencias del agua:
- El ciclo del agua
- Rueda de agua
- Agua superenfriada
- Depósito de agua
.