- Antecedentes
- Fisiología normal y fisiopatología del potasio
- Potencial de acción de un cardiomiocito no marcapasos
- Potencial de acción de una célula marcapasos cardíaca
- Conducción de la corriente
- Periodo refractario
- Hiperpotasemia, clasificación y causas
- Clasificación
- Causas
- Efectos de la hiperpotasemia
- Efectos metabólicos
- Bomba de sodio-potasio
- Conclusión
Antecedentes
El potasio es un catión blando, de color blanco plateado y muy reactivo, que pertenece a la familia de los metales alcalinos de la tabla periódica. Es el catión más abundante en el cuerpo humano en su conjunto, y el ion más extendido en sus compartimentos intracelulares.
De media, una dieta occidental contiene de 80 a 100 mEq de potasio al día, y en condiciones fisiológicas normales, el 90% se absorbe de forma pasiva, dejando sólo 9,0 mmol para la excreción fecal. Los 3500-4000 mmol que se mantienen almacenados en el cuerpo son desproporcionados con respecto a los niveles de potasio plasmático diurnos, que normalmente se mantienen en el rango de 3,5-5,3 mmol/L a través de un estrecho mecanismo de homeostasis, siendo los niveles más bajos durante la noche y en las primeras horas de la mañana y el nivel máximo más alto en las horas de la tarde.
Una vez absorbido en el torrente sanguíneo, la función del riñón es hacer coincidir la ingesta de potasio con la salida de potasio, lo que requiere varias horas, durante las cuales el «equilibrio interno de potasio», bajo la influencia de la insulina y las catecolaminas, mantiene la homeostasis temporal desplazando el potasio entre los espacios intracelular y extracelular. La estimulación de los receptores alfa impide la entrada de potasio en las células, y la estimulación de los receptores beta la favorece mediante la activación de la bomba ATPasa sodio-potasio.
La bomba ATPasa sodio-potasio es la enzima de mantenimiento de la puerta situada en el sarcolema. Ayuda a salvaguardar el 98% del potasio (aproximadamente 144,0 mmol) retenido en el interior de la célula. Esto asegura la preservación de la diferencia de potencial vital a través de las membranas celulares necesarias para el correcto funcionamiento celular, especialmente las células excitables como las células nerviosas y las células musculares cardíacas.
Fisiología normal y fisiopatología del potasio
Después de su rápida absorción, el potasio ayuda a orquestar sus propios niveles corporales mediante la liberación de insulina y aldosterona. Otros estímulos corporales inherentes que también se han encontrado para controlar los niveles corporales de potasio incluyen los receptores beta-2 adrenérgicos, el PH sanguíneo alcalino y el anabolismo celular.
Liberación de insulina y aldosterona: El potasio ingerido entra rápidamente en la circulación. Al llegar a la circulación portal, estimula al páncreas para que libere insulina. Al mismo tiempo, el potasio circulante que llega a las células yuxtaglomerulares provoca la liberación de renina. La renina, al llegar al hígado, se convierte en angiotensina I. La angiotensina I viaja a los pulmones donde se convierte en angiotensina II. A continuación, la angiotensina II completa su viaje de vuelta a los riñones a través de la sangre circulante para estimular la zona glomerulosa para que segregue aldosterona.
Equilibrio interno de potasio: La insulina liberada postprandialmente actúa principalmente en los músculos esqueléticos, activando dos vías, la vía dependiente de AKT responsable de la inserción del transportador de glucosa GLUT4 y la vía APK que activa la ATPasa sodio-potasio celular para desplazar el potasio al espacio intracelular. A diferencia de la vía dependiente de AKT, la vía APK no se ve afectada por el síndrome metabólico ni por la enfermedad renal crónica (Figura 1).
Excreción: El potasio filtrado por los glomérulos renales se reabsorbe pasivamente en el túbulo proximal y en el asa de Henle en proporción a la cantidad de sodio y agua aportada. Normalmente, sólo un 10% de la carga filtrada llega a la nefrona distal.
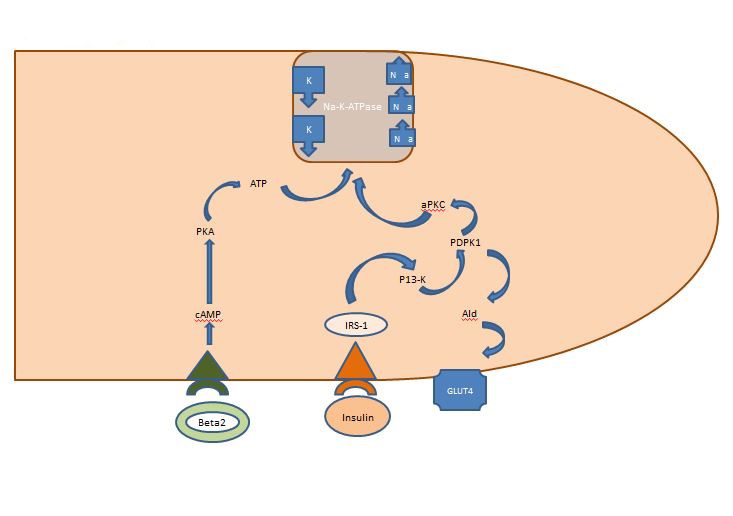
Figura 1. Acción de la insulina en una célula muscular esquelética. La insulina liberada postprandialmente activa dos vías en los músculos esqueléticos, la vía dependiente de AKT responsable de la inserción del transportador de glucosa GLUT4 y la vía APK que activa la ATPasa de sodio y potasio celular para desplazar el potasio al espacio intracelular.
Al principio del túbulo contorneado distal, comienza la secreción de exceso de potasio y aumenta progresivamente a medida que avanza hacia la nefrona distal y hacia el conducto colector. Esto está mediado por la regulación al alza de la ATPasa de hidrógeno-potasio en las células alfa-intercaladas .
La presencia de mayores niveles de potasio en las células peritubulares de los riñones activa el sistema RAAS para liberar aldosterona, que activa la ATPasa sodio-potasio en la membrana basolateral, dando lugar a una disminución del sodio intracelular que conduce al aumento del transporte electrogénico de la captación de potasio hiperpolarizando el voltaje de la membrana y permitiendo su excreción en la orina .
En la hiperpotasemia, la cuota de potasio excretada por el colon puede aumentar hasta un 30%, por ejemplo en casos de insuficiencia renal, donde el potasio es entonces captado activamente por la bomba ATPasa sodio potasio activada en la membrana basolateral de los enterocitos colónicos, para ser excretado por el otro lado, en el lumen colónico a través de los grandes canales apicales de potasio dependientes del calcio de las células.
De lo anterior se desprende que el mecanismo de homeostasis del nivel plasmático de potasio está ordenado principalmente por la interacción de tres transacciones simultáneas: la ingesta de potasio, los desplazamientos intra/extracelulares de potasio y la excreción urinaria de potasio, todo lo cual depende en última instancia de la bomba de sodio-potasio.
Para comprender el mecanismo de peligro inminente de la hiperpotasemia y su gestión, hay que entender la fisiología del potencial de acción y las entrañas de la enzima sodio potasio ATPasa.
La electrofisiología del potencial de acción, es decir el movimiento iónico a través de las membranas celulares, está determinado por la diferencia de dos potenciales, un «potencial químico» en el que los iones se mueven por su gradiente de concentración y un «potencial eléctrico» en el que los iones y las moléculas se repelen las cargas similares, dando lugar al potencial transmembrana (PTM), que se dice que es +ve cuando el movimiento neto de los iones +ve es hacia el exterior de la célula y viceversa.
Potencial de acción de un cardiomiocito no marcapasos
Un potencial de acción tiene cinco fases, que comienzan y terminan en la fase 4. Las bombas que intervienen en este proceso son el intercambiador sodio-calcio del sarcolema, la ATPasa de calcio y, finalmente, la ATPasa de sodio-potasio.
- Fase 4. La fase de reposo: tiene un potencial de reposo de -90 mV como resultado del constante movimiento de salida del potasio a través de los canales rectificadores de entrada. Durante esta fase, tanto los canales de sodio como los de calcio están cerrados.
- Fase 0. La fase de despolarización: el disparo de una célula marcadora o su conducción a través de una célula vecina desencadena el aumento de la TMP por encima de -90 mV. En este punto, los «canales rápidos de sodio» comienzan a abrirse uno a uno, permitiendo que el sodio entre en la célula, elevando la TMP y, una vez que se han abierto suficientes canales rápidos de sodio para alcanzar los -70 mV, se pone en marcha una corriente de sodio ascendente autosostenida, despolarizando rápidamente la TMP a 0 mV durante un intermedio transitorio conocido como el «rebasamiento», momento en el que los canales de sodio rápidos dependientes del tiempo se cierran y los canales de calcio de «larga apertura» se abren para elevar la TMP a -40 mV y permitir una pequeña afluencia constante de calcio por su gradiente de concentración.
- Fase 1. La fase de repolarización temprana: se inicia con la TMP ligeramente positiva y la breve apertura de algunos canales de potasio que dan lugar a su flujo hacia el exterior de la célula, devolviendo la TMP a aproximadamente 0 mV.
- Fase 2. La fase de meseta: aquí las dos contracorrientes se equilibran eléctricamente y dan lugar al mantenimiento del TMP equilibrado justo por debajo de 0 mV. «Los canales de calcio de apertura prolongada siguen abiertos, lo que da lugar a un flujo constante de calcio en la célula. El canal de potasio rectificador retardado permite el paso de potasio al exterior de la célula por su gradiente de concentración.
- Fase 3. La fase de repolarización: durante esta fase, los canales de calcio se inactivan gradualmente y el flujo persistente de potasio hacia el exterior de la célula supera así el flujo de calcio entrante, devolviendo el potasio al espacio intracelular y el sodio y el calcio al exterior de la célula.
Potencial de acción de una célula marcapasos cardíaca
Las células marcapasos cardíacas tienen una automaticidad innata, que permite su despolarización en ciclos rítmicos. El nodo sinoauricular (SAN) tiene el mayor ritmo de despolarización autoiniciado con una frecuencia de 60-90/min, seguido por el nodo auriculoventricular (AVN) con una frecuencia de 40-60/min y luego las fibras de Purkinje y el músculo ventricular con 20-40/min.
Los potenciales de membrana de las células marcapasos son inestables y sus potenciales de acción no tienen fases definidas. Tienen menos canales de potasio rectificadores de entrada y su TMP nunca cae por debajo de -60 mV, lo que elimina el papel de los canales de sodio rápidos que requieren un TMP de -90 mV, lo que resulta en la ausencia de la fase de despolarización rápida.
A la TMP >-60 mV, la corriente «graciosa/marcapasos» se pone en marcha con un flujo espontáneo de iones a través de los canales de sodio lentos, despolarizando la TMP a <-50 mV y luego de vuelta a -60 mV cuando los canales de calcio se cierran.
Conducción de la corriente
Todos los cardiomiocitos están acoplados eléctricamente a través de la unión gap, incluyendo la célula marcapasos. Esto facilita la despolarización generalizada de todas las células vecinas, convirtiendo el corazón en una unidad funcional en la que la célula con la tasa inherente más alta se convierte en el «marcapasos».
Periodo refractario
El periodo refractario más largo durante la meseta larga en la fase 2 debido a los canales de calcio lentos proporciona el tiempo necesario para el vaciado completo de los ventrículos antes de la siguiente contracción. Los períodos refractarios pueden ser absolutos (ARP), efectivos (ERP) o relativos (RRP). En un ARP, la célula es absolutamente inexcitable.
Un ERP dura desde el ARP hasta el segmento corto de la fase 3. Un estímulo en este punto podría despolarizar mínimamente la célula, pero el nivel de despolarización es más débil que la propagación de un potencial de acción a las células vecinas.
La RPR es provocada por un estímulo superior al normal, que conduce a la despolarización de la célula y a la producción de un potencial de acción.
Un «período supranormal» es un estado de hiperexcitabilidad durante el cual un estímulo más débil de lo normal podría provocar una arritmia, lo que hace necesaria la sincronización durante la cardioversión para evitar la fibrilación ventricular (Figura 2).
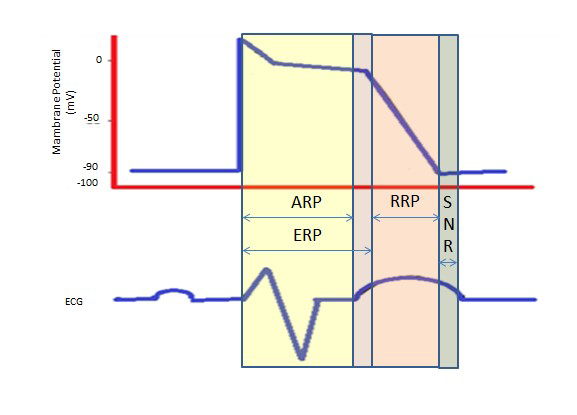
Figura 2. Períodos refractarios. PRA: Período Refractario Absoluto; ERP: Período Refractario Efectivo; RRP: Período Refractario Relativo; SNR: Período Refractario Supranormal
Hiperpotasemia, clasificación y causas
Clasificación
La hiperpotasemia se clasifica como leve cuando los niveles están en el rango de 5,5-6,0 mmol/L, moderada de 6,1-6,9 mmol/L y grave en niveles de 7.0 mmol/L o más, y en cualquier nivel en el que se produzcan cambios en el ECG.
Causas
La hiperpotasemia se produce cuando los mecanismos compensatorios ya no son capaces de hacer frente al desequilibrio, por lo que suele ser multifactorial.
- El aumento de la ingesta de potasio por cualquier vía, por ejemplo, ingesta dietética oral, o administración intravenosa de fluidos que contienen potasio como la penicilina G.
- Retención por los riñones: dado que la excreción de potasio depende de la aldosterona y de la entrega de una cantidad distal suficiente de sodio y agua dentro de las nefronas, condiciones como la insuficiencia renal, la insuficiencia suprarrenal (enfermedad de Addison) , el hipoaldosteronismo hiporeninémico tipo IV, la acidosis tubular renal, especialmente en pacientes con nefropatía diabética, así como cualquier condición que promueva la hipoperfusión, como en la depleción de volumen y la insuficiencia cardíaca congestiva, afectará al intrincado equilibrio del potasio en el organismo y predispondrá a la hiperpotasemia.
- Insuficiencia suprarrenal: debe excluirse en los pacientes hiperpotasémicos, especialmente en presencia de hiponatremia y debilidad muscular. Para detectar la insuficiencia suprarrenal primaria, se realiza una prueba estándar de estimulación con cosintropina en la que se administran 0,25 mg de cosintropina sintética en forma de bolo intravenoso seguido de una medición de cortisol en plasma entre 45 minutos y 1 hora después. Los valores inferiores a 20 mcg/dL son sugestivos de insuficiencia suprarrenal.
- Fármacos que retienen potasio: los fármacos de prescripción que reducen la actividad de la ATPasa de sodio y potasio, como los bloqueadores de los receptores beta-adrenérgicos, y los fármacos que reducen la secreción de aldosterona, como los inhibidores de la ECA y los ARA, los antiinflamatorios no esteroideos y los diuréticos ahorradores de potasio, necesitan un estrecho seguimiento para evitar la hiperpotasemia iatrogénica, especialmente en el grupo de edad geriátrica con su progresiva disminución de la función renal como parte del proceso de envejecimiento.
- Perturbaciones en el desplazamiento transcelular del potasio: esto puede ocurrir con condiciones de acidosis, hiperglucemia, hiperosmolalidad, ejercicio severo, descomposición de tejidos, parálisis periódica hipercalémica y con bloqueadores beta-adrenérgicos. Por cada 0,1 unidades de disminución del PH sanguíneo, el potasio sérico aumenta aproximadamente 0,6 mmol/L (menos si la acidosis está causada por ácidos orgánicos).
- El pseudohipoaldosteronismo es una enfermedad congénita autosómica recesiva en la que los riñones son resistentes a las acciones de la aldosterona.
- Tampoco debe pasarse por alto la seudohipercalemia: como su nombre indica, se produce cuando hay una elevación del potasio sérico en presencia de un potasio plasmático normal. Puede observarse en la sangre hemolizada, el torniquete apretado prolongado durante un procedimiento de toma de muestras de sangre, que provoca la liberación extracelular de potasio, con el cierre repetido del puño durante la flebotomía, la venopunción traumática, con leucocitosis y trombocitosis, y en algunos síndromes genéticos poco comunes como la pseudohiperpotasemia familiar y la esferocitosis hereditaria. Sin embargo, podría ser simplemente el resultado de un simple error de laboratorio.
Efectos de la hiperpotasemia
La hiperpotasemia leve suele ser asintomática, detectada accidentalmente por las pruebas de laboratorio, debido a sus vagos síntomas como malestar, debilidad muscular y parestesia. La hiperpotasemia grave afectará a la función neuromuscular en forma de debilidad y parálisis del músculo esquelético; sin embargo, no es una presentación frecuente ya que la toxicidad cardíaca domina el cuadro y es la presentación preliminar. La toxicidad cardíaca suele presentarse en el ECG de la siguiente manera escalonada, aunque no necesariamente, dependiendo de la etiología:
- A niveles superiores a 5,5 mEq/L, el aumento de la conductancia de los canales de potasio incrementa la corriente lkr, lo que conduce a una repolarización rápida en forma de una onda T con pico en el ECG de superficie. Estas ondas T pueden diferenciarse de las del infarto de miocardio y del ACV por su corta duración, que oscila entre 150-250 mseg.
- A niveles de potasio superiores a 6,5 mEq/L, se produce un estado de despolarización subumbral sostenida que provoca un retraso en la despolarización auricular y ventricular. La disminución de la fase 0 del potencial de acción conduce a un potencial de acción más largo, produciendo un retraso en la conducción intraventricular y atrioventricular. En el ECG de superficie, esto se presentará con un aplanamiento y pérdida de las ondas P y un ensanchamiento de los complejos QRS. Al aumentar el retraso de la conducción intraventricular, el ECG de superficie empieza a mostrar signos de bloqueo de rama izquierda y derecha. Esto puede diferenciarse de la enfermedad de la rama del haz por el hecho de que en la hiperpotasemia el retraso persiste durante todo el complejo QRS, no sólo durante las porciones iniciales o terminales, respectivamente.
- A partir de 10 mEq/L, la conducción sinoauricular ya no se produce y el ritmo de unión acelerado toma el control. Las arritmias ventriculares se desarrollan con la fusión de los complejos QRS ensanchados con las ondas T para formar finalmente el patrón clásico de ondas sinusoidales. Una vez que esto ocurre, la fibrilación ventricular y la asistolia son inminentes y entonces se producirá un paro cardíaco.
- A veces los cambios pueden ser erráticos e impredecibles y el ECG saltará de la normalidad a la asistolia debido a la variabilidad de los factores etiológicos y sus efectos influyentes, por ejemplo, la tasa de cambio de potasio, la concentración de calcio, el pH y la concentración de sodio. Por lo tanto, la hiperpotasemia debe tratarse de forma urgente siempre que los niveles de potasio sean superiores a 6,5 mmol/L, o en presencia de manifestaciones de hiperpotasemia en el ECG, independientemente del nivel de potasio. Otras asociaciones notificadas con la hiperpotasemia aguda incluyen: cuadro de pseudo IM en el registro del ECG, con segmento ST-T masivo como resultado de desórdenes en la repolarización de los miocitos, intervalos PR y QT cortos, taquicardia sinusal, bradicardia sinusal, ritmo idioventricular, bloqueo cardíaco de 1º y 2º grado .
Efectos metabólicos
La hiperpotasemia conduce a una acidosis metabólica hiperclorémica ya que la hiperpotasemia promueve la captación intracelular de potasio a cambio de iones de hidrógeno. Esto crea una alcalosis intracelular, suprimiendo la producción renal de amoníaco en los túbulos proximales, lo que conduce a una disminución de la excreción urinaria de amonio y ácido y a una acidosis tubular renal de tipo IV .
Bomba de sodio-potasio
La ATPasa de sodio-potasio fue descubierta en 1957 por Skou, quien posteriormente recibió una parte del Premio Nobel de Química de 1997 por su descubrimiento.
Skou fue el primero en descubrir la ATPasa de sodio-potasio en el sarcolema de la superficie celular de los músculos cardíacos. Posteriormente se detectó su presencia en todos los organismos eucariotas unicelulares y pluricelulares.
La bomba de sodio-potasio funciona vinculando la hidrólisis de ATP a la exportación celular de tres iones de sodio a cambio de dos iones de potasio contra sus gradientes electroquímicos. Es la diana molecular de los digitálicos y la digoxina, que se utilizan desde el siglo XVIII como extractos de dedalera.
La acción de la bomba de sodio y potasio está regulada por una fosfoproteína fosfolema, cuya desfosforilación conduce a la inhibición de la bomba y cuya fosforilación conduce a un aumento de la actividad de la bomba. Tiene tres sitios de fosforilación, dos de palmitoilación y uno de glutatión, lo que explica la multitud de señales capaces de estimular e inhibir la bomba.
La propia bomba de sodio-potasio es una enzima compuesta por múltiples subunidades con múltiples isoformas. La presencia de las subunidades alfa y beta (principalmente B1 en el corazón) es esencial para su función. Recientemente, se ha identificado una tercera subunidad proteica gamma en los riñones, pero hasta la fecha su función sigue siendo desconocida.
La subunidad alfa es el núcleo catalítico de la enzima de la bomba de sodio-potasio. Tiene aproximadamente 100 kDa y contiene los sitios de unión para el sodio, el potasio, el ATP y los esteroides cardiotónicos como la ouabain. Sólo alfa 1 y alfa 2 muestran una presencia significativa en un miocito cardíaco normal y están vinculados funcionalmente al intercambiador de sodio y calcio (NCX). Se ha informado de que el alfa 3 sustituye al alfa 2 en modelos experimentales de insuficiencia cardíaca.
Los datos de experimentos recientes favorecen la participación de ambas subunidades alfa 1 alfa 2 de la bomba en la regulación del acoplamiento excitación-contracción (E-C). La alfa 1, que se encontró distribuida más uniformemente en el sarcolema, se cree que desempeña más bien un papel de «mantenimiento», controlando tanto la contractilidad como el volumen de sodio intracelular, mientras que la alfa 2, cuya expresión se concentra en los túbulos T junto con otros componentes clave del acoplamiento E-C, se cree que se centra principalmente en la contractilidad.
Los factores conocidos que pueden controlar la bomba de sodio-potasio incluyen: El ATP, el sodio intracelular, las barreras subsarcolemales y los espacios difusos, el potencial de membrana, las vías de señalización intracelular (vías de señalización adrenérgica, proteína quinasa A & C, óxido nítrico, fosfolemia), la regulación directa por pequeñas moléculas (lípidos, esteroides cardiotónicos endógenos), otras proteínas asociadas (caveolas y caveolinas, y anquirina).
Conclusión
La hiperpotasemia es un reto clínico y puede presentarse hasta en un 10% de los pacientes hospitalizados . Su resultado final es potencialmente mortal. Dado que todas las células del organismo se ven afectadas en última instancia por la bomba de sodio y potasio, y que se sabe que los músculos cardíacos isquémicos extruyen su potasio extracelularmente, lo que conduce a una reducción del umbral de arritmia con la posibilidad de que se produzcan arritmias ventriculares que agraven la hipopolarización y reduzcan aún más el umbral, es necesario centrar más estudios en la manipulación de la enzima de sodio y potasio, ya que su control podría alterar favorablemente los resultados de las paradas cardíacas y reescribir las actuales directrices de RCP.