Forma de dosificación: cápsula
Medically reviewed by Drugs.com. Actualizado por última vez el 1 de octubre de 2020.
- Descripción general
- Efectos secundarios
- Dosificación
- Profesional
- Consejos
- Interacciones
- Más
Para reducir el desarrollo de bacterias resistentes a los medicamentos y mantener la eficacia de laresistentes y mantener la eficacia de nitrofurantoína (macrocristales) y otros medicamentos antibacterianos, la nitrofurantoína (macrocristales) debe utilizarse únicamente para tratar o prevenir las infecciones que se ha demostrado o se sospecha firmemente que son causadas por bacterias.
- DESCRIPCIÓN:
- FARMACOLOGÍA CLÍNICA:
- MICROBIOLOGÍA
- Mecanismo de acción
- Interacciones con otros antibióticos
- Desarrollo de resistencia
- INDICACIONES Y USO:
- CONTRAINDICACIONES:
- ADVERTENCIAS:
- Reacciones pulmonares:
- Hepatotoxicidad:
- Neuropatía:
- Anemia hemolítica:
- Diarrea asociada a Clostridium difficile:
- PRECAUCIONES:
- Información para los pacientes:
- Generalidades:
- Interacciones medicamentosas:
- Interacciones entre el medicamento y las pruebas de laboratorio:
- Carcinogénesis, mutagénesis, alteración de la fertilidad:
- Embarazo:
- Embarazo categoría B.
- Parto y alumbramiento:
- Madres lactantes:
- Uso pediátrico:
- Uso geriátrico:
- REACCIONES ADVERSAS:
- Respiratorias:
- Hepáticas:
- Neurológicas:
- Dermatológicas:
- Alérgica:
- Gastrointestinal:
- Hematológicos:
- Varios:
- Eventos adversos de laboratorio:
- Sobredosis
- DOSIS Y ADMINISTRACIÓN:
- Adultos:
- Pacientes pediátricos:
- Cómo se suministra:
- Panel de visualización principal – 50 mg
- Panel de visualización principal – 100 mg
- Preguntas frecuentes
- Más información sobre nitrofurantoína
- Recursos para el consumidor
- Recursos para el profesional
- Guías de tratamiento relacionadas
DESCRIPCIÓN:
Nitrofurantoína, USP (macrocristales) es una sustancia química sintética de tamaño de cristal controlado. Es un compuesto estable, amarillo y cristalino. Nitrofurantoína, USP (macrocristales) es un agente antibacteriano para infecciones específicas del tracto urinario. Se presenta en cápsulas de 25 mg, 50 mg y 100 mg para administración oral.
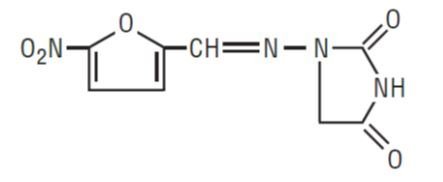
1-AMINO]-2, 4-IMIDAZOLIDINEDIONE
Ingredientes activos: Cada cápsula contiene D&C Amarillo # 10, FD&C Azul # 1, FD&C Azul # 2, FD&C Rojo # 40, gelatina, óxido de hierro negro, lactosa anhidra, estearato de magnesio, almidón de maíz pregelatinizado, lauril sulfato de sodio, talco y dióxido de titanio. Las cápsulas de 50 mg y 100 mg también contienen FD&C Amarillo nº 6.
FARMACOLOGÍA CLÍNICA:
La nitrofurantoína (macrocristales) es una forma cristalina más grande de nitrofurantoína. La absorción de nitrofurantoína (macrocristales) es más lenta y su excreción algo menor en comparación con la nitrofurantoína. Las concentraciones en sangre a dosis terapéuticas suelen ser bajas. Es muy soluble en la orina, a la que puede conferir un color marrón.
Siguiendo un régimen de dosis de 100 mg cuatro veces al día durante 7 días, las recuperaciones medias del fármaco en orina (de 0 a 24 horas) el día 1 y el día 7 fueron del 37.9% y 35,0%.
A diferencia de muchos fármacos, la presencia de alimentos o agentes que retrasan el vaciado gástrico puede aumentar la biodisponibilidad de la nitrofurantoína (macrocristales), presumiblemente al permitir una mejor disolución en los jugos gástricos.
MICROBIOLOGÍA
La nitrofurantoína es un agente antimicrobiano nitrofuránico con actividad frente a ciertas bacterias Gram-positivas y Gram-negativas.
Mecanismo de acción
El mecanismo de la acción antimicrobiana de la nitrofurantoína es inusual entre los antibacterianos. La nitrofurantoína es reducida por las flavoproteínas bacterianas a intermedios reactivos que inactivan o alteran las proteínas ribosomales bacterianas y otras acromoléculas. Como resultado de estas inactivaciones, se inhiben los procesos bioquímicos vitales de la síntesis de proteínas, el metabolismo energético aeróbico, la síntesis de ADN, la síntesis de ARN y la síntesis de la pared celular. La nitrofurantoína es bactericida en la orina a dosis terapéuticas. La naturaleza amplia de este modo de acción puede explicar la falta de resistencia bacteriana adquirida a la nitrofurantoína, ya que las necesarias mutaciones múltiples y simultáneas de las macromoléculas diana serían probablemente letales para las bacterias.
Interacciones con otros antibióticos
Se ha demostrado antagonismo in vitro entre la nitrofurantoína y los antimicrobianos de quinolona. Se desconoce la importancia clínica de este hallazgo.
Desarrollo de resistencia
El desarrollo de resistencia a la nitrofurantoína no ha sido un problema significativo desde su introducción en 1953. No se ha observado resistencia cruzada con antibióticos y sulfonamidas, y la resistencia transferible es, a lo sumo, un fenómeno muy raro.
La nitrofurantoína ha demostrado ser activa frente a la mayoría de las cepas de las siguientes bacterias tanto in vitro como en infecciones clínicas (ver Indicaciones y uso):
Microorganismos aerobios y facultativos Gram-positivos:
Staphylococcus aureus
Enterococos (p. ej. Enterococcus faecalis)
Microorganismos gramnegativos aerobios y facultativos:
Escherichia coli
NOTA: Aunque la nitrofurantoína tiene una excelente actividad contra Enterococcus faecalis, la mayoría de los aislados de Enterococcus faecium no son susceptibles a la nitrofurantoína.
Al menos el 90 por ciento de los siguientes microorganismos presentan una concentración inhibitoria mínima (CIM) in vitro inferior o igual al punto de ruptura de susceptibilidad para nitrofurantoína. Sin embargo, la eficacia de la nitrofurantoína en el tratamiento de infecciones clínicas debidas a estos microorganismos no se ha establecido en ensayos adecuados y bien controlados.
Microorganismos aerobios y facultativos Gram-positivos:
Estafilococos coagulasa-negativos (incluyendo Staphylococcus
epidermidis y Staphylococcus saprophyticus)
Streptococcus agalactiae
Estreptococos del grupo D
Estreptococos del grupo Viridans
Aerobios y facultativos Gram-negativos:
Citrobacter amalonaticus
Citrobacter diversus
Citrobacter freundii
Klebsiella oxytoca
Klebsiella ozaenae
NOTA: Algunas cepas de las especies Enterobacter y Klebsiella son resistentes a la nitrofurantoína.
Pruebas de susceptibilidad:
Para obtener información específica sobre los criterios de interpretación de las pruebas de susceptibilidad y los métodos de prueba asociados y las normas de control de calidad reconocidas por la FDA para este medicamento, consulte: https://www.fda.gov/STIC.
INDICACIONES Y USO:
Las cápsulas de nitrofurantoína (macrocristales) están específicamente indicadas para el tratamiento de las infecciones del tracto urinario cuando son debidas a cepas susceptibles de Escherichia coli, enterococos, Staphylococcus aureus y ciertas cepas susceptibles de las especies Klebsiella y Enterobacter.
La nitrofurantoína no está indicada para el tratamiento de la pielonefritis o los abscesos perinéfricos.
Para reducir el desarrollo de bacterias resistentes a los medicamentos y mantener la eficacia de las cápsulas de nitrofurantoína (macrocristales) y otros medicamentos antibacterianos, las cápsulas de nitrofurantoína (macrocristales) deben utilizarse sólo para tratar o prevenir infecciones que se ha demostrado o se sospecha firmemente que están causadas por bacterias susceptibles. Cuando se disponga de información sobre el cultivo y la susceptibilidad, deberá tenerse en cuenta para seleccionar o modificar el tratamiento antibacteriano. En ausencia de tales datos, la epidemiología local y los patrones de susceptibilidad pueden contribuir a la selección empírica del tratamiento.
Las nitrofurantoínas carecen de la distribución tisular más amplia de otros agentes terapéuticos aprobados para las infecciones del tracto urinario. En consecuencia, muchos pacientes tratados con cápsulas de nitrofurantoína (macrocristales) están predispuestos a la persistencia o reaparición de la bacteriuria. Deben obtenerse muestras de orina para realizar cultivos y pruebas de susceptibilidad antes y después de finalizar el tratamiento. Si se produce la persistencia o reaparición de la bacteriuria tras el tratamiento con nitrofurantoína en cápsulas (macrocristales), deben seleccionarse otros agentes terapéuticos con una distribución tisular más amplia. Al considerar el uso de las cápsulas de nitrofurantoína (macrocristales), deben sopesarse las menores tasas de erradicación frente al mayor potencial de toxicidad sistémica y de desarrollo de resistencia antimicrobiana cuando se utilizan agentes con una distribución tisular más amplia.
CONTRAINDICACIONES:
La anuria, la oliguria o el deterioro significativo de la función renal (aclaramiento de creatinina inferior a 60 mL por minuto o creatinina sérica elevada clínicamente significativa) son contraindicaciones. El tratamiento de este tipo de pacientes conlleva un mayor riesgo de toxicidad debido a la alteración de la excreción del fármaco. Debido a la posibilidad de que se produzca una anemia hemolítica debido a la inmadurez de los sistemas enzimáticos eritrocitarios (inestabilidad del glutatión), el fármaco está contraindicado en pacientes embarazadas a término (de 38 a 42 semanas de gestación), durante el trabajo de parto y el parto, o cuando el inicio del parto es inminente. Por la misma razón, el medicamento está contraindicado en neonatos menores de un mes de edad.
Las cápsulas de nitrofurantoína (macrocristales) están contraindicadas en pacientes con una historia previa de ictericia colestática/disfunción hepática asociada a nitrofurantoína.
Las cápsulas de nitrofurantoína (macrocristales) también están contraindicadas en aquellos pacientes con hipersensibilidad conocida a la nitrofurantoína.
ADVERTENCIAS:
Reacciones pulmonares:
Se han observado reacciones pulmonares agudas, subagudas o crónicas en pacientes tratados con nitrofurantoína. SI SE PRODUCEN ESTAS REACCIONES, SE DEBE INTERRUMPIR LA ADMINISTRACIÓN DE NITROFURANTOÍNA (MACROCRISTALES) Y TOMAR LAS MEDIDAS ADECUADAS. LOS INFORMES HAN CITADO LAS REACCIONES PULMONARES COMO UNA CAUSA CONTRIBUYENTE DE MUERTE.
LAS REACCIONES PULMONARES CRÓNICAS (NEUMONITIS INTERSTICIAL DIFUSA O FIBROSIS PULMONAR, O AMBAS) PUEDEN DESARROLLARSE INSIDIOSAMENTE. ESTAS REACCIONES OCURREN RARAMENTE Y GENERALMENTE EN PACIENTES QUE RECIBEN LA TERAPIA DURANTE SEIS MESES O MÁS. SE JUSTIFICA UN CONTROL ESTRECHO DEL ESTADO PULMONAR DE LOS PACIENTES QUE RECIBEN UNA TERAPIA A LARGO PLAZO Y REQUIERE QUE SE SOPESEN LOS BENEFICIOS DE LA TERAPIA FRENTE A LOS RIESGOS POTENCIALES (VER REACCIONES RESPIRATORIAS).
Hepatotoxicidad:
Las reacciones hepáticas, incluyendo hepatitis, ictericia colestática, hepatitis crónica activa y necrosis hepática, ocurren raramente. Se han notificado casos de muerte. La aparición de la hepatitis crónica activa puede ser insidiosa, y los pacientes deben ser controlados periódicamente para detectar cambios en las pruebas bioquímicas que indiquen una lesión hepática. Si se produce la hepatitis, debe retirarse inmediatamente el medicamento y tomar las medidas adecuadas.
Neuropatía:
Se ha producido neuropatía periférica, que puede llegar a ser grave o irreversible. Se han notificado casos de muerte. Afecciones como la insuficiencia renal (aclaramiento de creatinina inferior a 60 mL por minuto o creatinina sérica elevada clínicamente significativa), la anemia, la diabetes mellitus, el desequilibrio electrolítico, la deficiencia de vitamina B y las enfermedades debilitantes pueden potenciar la aparición de neuropatía periférica. Los pacientes que reciben un tratamiento a largo plazo deben ser controlados periódicamente para detectar cambios en la función renal.
En la experiencia posterior a la comercialización de las formulaciones de nitrofurantoína se han notificado raramente casos de neuritis óptica.
Anemia hemolítica:
Se han inducido casos de anemia hemolítica del tipo de sensibilidad a la primaquina con nitrofurantoína. La hemólisis parece estar relacionada con una deficiencia de glucosa-6-fosfato deshidrogenasa en los glóbulos rojos de los pacientes afectados. Esta deficiencia se encuentra en el 10 por ciento de las personas de raza negra y en un pequeño porcentaje de grupos étnicos de origen mediterráneo y de Oriente Próximo. La hemólisis es una indicación para suspender la nitrofurantoína (macrocristales); la hemólisis cesa cuando se retira el medicamento.
Diarrea asociada a Clostridium difficile:
Se ha notificado diarrea asociada a Clostridium difficile (DACD) con el uso de casi todos los agentes antibacterianos, incluida la nitrofurantoína, y puede variar en gravedad desde una diarrea leve hasta una colitis mortal. El tratamiento con agentes antibacterianos altera la flora normal del colon, lo que conduce a un crecimiento excesivo de C. difficile.
C. difficile produce toxinas A y B que contribuyen al desarrollo de la CDAD. Las cepas de C. difficile que producen hipertoxinas causan una mayor morbilidad y mortalidad, ya que estas infecciones pueden ser refractarias al tratamiento antimicrobiano y pueden requerir una colectomía. La CDAD debe considerarse en todos los pacientes que presentan diarrea tras el uso de antibióticos. Es necesario contar con una historia clínica cuidadosa, ya que se ha informado de que la DAC ocurre más de dos meses después de la administración de agentes antibacterianos. Si se sospecha o se confirma la DAC, puede ser necesario interrumpir el uso de antibióticos no dirigidos contra C. difficile. Debe establecerse un tratamiento adecuado de líquidos y electrolitos, suplementos proteicos, tratamiento antibiótico de C. difficile y evaluación quirúrgica según esté clínicamente indicado.
PRECAUCIONES:
Información para los pacientes:
Se debe aconsejar a los pacientes que tomen nitrofurantoína (macrocristales) con alimentos para aumentar aún más la tolerancia y mejorar la absorción del medicamento. Se debe instruir a los pacientes para que completen el curso completo de la terapia; sin embargo, se les debe aconsejar que se pongan en contacto con su médico si se produce algún síntoma inusual durante la terapia.
Muchos pacientes que no pueden tolerar la nitrofurantoína microcristalina son capaces de tomar nitrofurantoína (macrocristales) sin náuseas.
Se debe aconsejar a los pacientes que no utilicen preparados antiácidos que contengan trisilicato de magnesio mientras toman nitrofurantoína (macrocristales).
Se debe aconsejar a los pacientes que los medicamentos antibacterianos, incluida la nitrofurantoína (macrocristales), sólo deben utilizarse para tratar infecciones bacterianas. No sirven para tratar infecciones víricas (por ejemplo, el resfriado común). Cuando se prescribe nitrofurantoína (macrocristales) para tratar una infección bacteriana, se debe informar a los pacientes de que, aunque es habitual sentirse mejor al principio del tratamiento, la medicación debe tomarse exactamente como se indica. Saltarse dosis o no completar el curso completo de la terapia puede (1) disminuir la eficacia del tratamiento inmediato y (2) aumentar la probabilidad de que las bacterias desarrollen resistencia y no sean tratables con nitrofurantoína (macrocristales) u otros medicamentos antibacterianos en el futuro.
La diarrea es un problema común causado por los antibióticos que generalmente termina cuando se suspende el antibiótico. A veces, después de iniciar el tratamiento con antibióticos, los pacientes pueden presentar heces acuosas y sanguinolentas (con o sin calambres de estómago y fiebre) incluso hasta dos o más meses después de haber tomado la última dosis del antibiótico. Si esto ocurre, los pacientes deben ponerse en contacto con su médico lo antes posible.
Generalidades:
La prescripción de nitrofurantoína (macrocristales) en ausencia de una infección bacteriana probada o fuertemente sospechada o de una indicación profiláctica es poco probable que proporcione beneficios al paciente y aumenta el riesgo de desarrollo de bacterias resistentes al medicamento.
Interacciones medicamentosas:
Los antiácidos que contienen trisilicato de magnesio, cuando se administran concomitantemente con nitrofurantoína, reducen tanto la velocidad como el grado de absorción. El mecanismo de esta interacción es probablemente la adsorción de nitrofurantoína en la superficie del trisilicato de magnesio.
Los fármacos uricosúricos, como el probenecid y la sulfinpirazona, pueden inhibir la secreción tubular renal de nitrofurantoína. El aumento resultante de los niveles séricos de nitrofurantoína puede aumentar la toxicidad, y la disminución de los niveles urinarios podría disminuir su eficacia como antibacteriano del tracto urinario.
Interacciones entre el medicamento y las pruebas de laboratorio:
Como resultado de la presencia de nitrofurantoína, puede producirse una reacción falsa positiva para la glucosa en la orina. Esto se ha observado con las soluciones de Benedict y Fehling pero no con la prueba enzimática de la glucosa.
Carcinogénesis, mutagénesis, alteración de la fertilidad:
La nitrofurantoína no fue carcinógena cuando se administró a ratas Holtzman hembra durante 44,5 semanas o a ratas Sprague-Dawley hembra durante 75 semanas. Dos bioensayos crónicos en roedores utilizando ratas Sprague-Dawley macho y hembra y dos bioensayos crónicos en ratones suizos y en ratones BDF1 no revelaron evidencias de carcinogenicidad.
La nitrofurantoína presentó evidencias de actividad carcinogénica en ratones B6C3F1 hembra, como lo demuestra el aumento de la incidencia de adenomas tubulares, tumores mixtos benignos y tumores de células de la granulosa del ovario. En las ratas macho F344/N, hubo un aumento de la incidencia de neoplasias de células tubulares renales poco comunes, osteosarcomas óseos y neoplasias del tejido subcutáneo. En un estudio que incluía la administración subcutánea de 75 mg/kg de nitrofurantoína a ratones hembra preñados, se observaron adenomas papilares de importancia desconocida en la generación F1.
Se ha demostrado que la nitrofurantoína induce mutaciones puntuales en ciertas cepas de Salmonella typhimurium y mutaciones hacia adelante en células de linfoma de ratón L5178Y. La nitrofurantoína indujo un mayor número de intercambios de cromátidas hermanas y aberraciones cromosómicas en células de ovario de hámster chino, pero no en células humanas en cultivo. Los resultados del ensayo de letalidad recesiva ligada al sexo en Drosophila fueron negativos tras la administración de nitrofurantoína por alimentación o por inyección. La nitrofurantoína no indujo mutaciones hereditarias en los modelos de roedores examinados.
Se desconoce la importancia de los hallazgos de carcinogenicidad y mutagenicidad en relación con el uso terapéutico de la nitrofurantoína en humanos.
La administración de dosis elevadas de nitrofurantoína a ratas provoca una parada espermatogénica temporal; esto es reversible al suspender el fármaco. Dosis de 10 mg/kg/día o superiores en varones humanos sanos pueden, en ciertos casos imprevisibles, producir una parada espermatogénica de leve a moderada con una disminución del recuento de espermatozoides.
Embarazo:
Efectos teratogénicos:
Embarazo categoría B.
Se han realizado varios estudios de reproducción en conejos y ratas a dosis hasta seis veces superiores a la dosis humana y no han revelado ninguna evidencia de alteración de la fertilidad o daño al feto debido a la nitrofurantoína. En un único estudio publicado realizado en ratones con una dosis 68 veces superior a la humana (basada en mg/kg administrados a la madre), se observó un retraso en el crecimiento y una baja incidencia de malformaciones menores y comunes. Sin embargo, con una dosis 25 veces superior a la humana, no se observaron malformaciones fetales; la relevancia de estos resultados para los humanos es incierta. Sin embargo, no existen estudios adecuados y bien controlados en mujeres embarazadas. Debido a que los estudios de reproducción animal no siempre son predictivos de la respuesta humana, este medicamento debe utilizarse durante el embarazo sólo si es claramente necesario.
Efectos no teratogénicos:
En un estudio de carcinogenicidad transplacentaria publicado se ha demostrado que la nitrofurantoína induce adenomas papilares de pulmón en la generación de ratones F1 a dosis 19 veces superiores a la dosis humana en base a mg/kg. Actualmente se desconoce la relación de este hallazgo con la carcinogénesis potencial en humanos. Debido a la incertidumbre con respecto a las implicaciones en humanos de estos datos en animales, este medicamento debe utilizarse durante el embarazo sólo si es claramente necesario.
Parto y alumbramiento:
Véase CONTRAINDICACIONES.
Madres lactantes:
Se ha detectado nitrofurantoína en la leche materna humana en cantidades mínimas. Debido al potencial de reacciones adversas graves de la nitrofurantoína en lactantes menores de un mes, se debe decidir si se interrumpe la lactancia o se suspende el medicamento, teniendo en cuenta la importancia del mismo para la madre (ver CONTRAINDICACIONES).
Uso pediátrico:
Nitrofurantoína (macrocristales) está contraindicada en lactantes menores de un mes (ver CONTRAINDICACIONES).
Uso geriátrico:
Los estudios clínicos de nitrofurantoína (macrocristales) no incluyeron un número suficiente de sujetos de 65 años o más para determinar si responden de forma diferente a los sujetos más jóvenes. Otras experiencias clínicas comunicadas no han identificado diferencias en las respuestas entre los pacientes de edad avanzada y los más jóvenes. Los informes espontáneos sugieren una mayor proporción de reacciones pulmonares, incluso mortales, en los pacientes de edad avanzada; estas diferencias parecen estar relacionadas con la mayor proporción de pacientes de edad avanzada que reciben un tratamiento a largo plazo con nitrofurantoína. Al igual que en los pacientes más jóvenes, las reacciones pulmonares crónicas se observan generalmente en los pacientes que reciben tratamiento durante seis meses o más (ver ADVERTENCIAS). Los informes espontáneos también sugieren una mayor proporción de reacciones hepáticas graves, incluso mortales, en pacientes de edad avanzada (ver ADVERTENCIAS).
En general, la mayor frecuencia de disminución de la función hepática, renal o cardíaca, y de enfermedades concomitantes o de otros tratamientos farmacológicos debe tenerse en cuenta a la hora de prescribir nitrofurantoína (macrocristales). Se sabe que este fármaco se excreta sustancialmente por el riñón, y el riesgo de reacciones tóxicas a este fármaco puede ser mayor en pacientes con deterioro de la función renal. La anuria, la oliguria o el deterioro significativo de la función renal (aclaramiento de creatinina inferior a 60 mL por minuto o elevación clínicamente significativa de la creatinina sérica) son contraindicaciones (ver CONTRAINDICACIONES). Debido a que los pacientes de edad avanzada son más propensos a tener una función renal disminuida, se debe tener cuidado en la selección de la dosis, y puede ser útil monitorizar la función renal.
REACCIONES ADVERSAS:
Respiratorias:
Pueden producirse reacciones crónicas, subagudas o agudas de hipersensibilidad pulmonar.
Las reacciones crónicas pulmonares se producen generalmente en pacientes que han recibido un tratamiento continuado durante seis meses o más. EL MALESTAR, LA DISNEA DE ESFUERZO, LA TOS Y LA ALTERACIÓN DE LA FUNCIÓN PULMONAR SON MANIFESTACIONES COMUNES QUE PUEDEN APARECER DE FORMA INSIDIOSA. LOS HALLAZGOS RADIOLÓGICOS E HISTOLÓGICOS DE NEUMONITIS INTERSTICIAL DIFUSA O FIBROSIS, O AMBOS, SON TAMBIÉN MANIFESTACIONES COMUNES DE LA REACCIÓN PULMONAR CRÓNICA. LA FIEBRE RARA VEZ ES PROMINENTE.
LA GRAVEDAD DE LAS REACCIONES PULMONARES CRÓNICAS Y SU GRADO DE RESOLUCIÓN PARECEN ESTAR RELACIONADOS CON LA DURACIÓN DE LA TERAPIA TRAS LA APARICIÓN DE LOS PRIMEROS SIGNOS CLÍNICOS. LA FUNCIÓN PULMONAR PUEDE VERSE AFECTADA DE FORMA PERMANENTE, INCLUSO TRAS EL CESE DE LA TERAPIA. EL RIESGO ES MAYOR CUANDO LAS REACCIONES PULMONARES CRÓNICAS NO SE RECONOCEN PRECOZMENTE.
En las reacciones pulmonares subagudas, la fiebre y la eosinofilia aparecen con menos frecuencia que en la forma aguda. Tras el cese de la terapia, la recuperación puede requerir varios meses. Si no se reconoce que los síntomas están relacionados con el fármaco y no se interrumpe el tratamiento con nitrofurantoína, los síntomas pueden agravarse.
Las reacciones pulmonares agudas se manifiestan habitualmente con fiebre, escalofríos, tos, dolor torácico, disnea, infiltración pulmonar con consolidación o derrame pleural en la radiografía y eosinofilia. Las reacciones agudas suelen producirse en la primera semana de tratamiento y son reversibles al suspender la terapia. La resolución suele ser drástica (ver ADVERTENCIAS).
Cambios en el electrocardiograma (por ejemplo, Se han notificado cambios en el electrocardiograma (por ejemplo, cambios inespecíficos de la onda ST/T, bloqueo de rama del haz) en asociación con reacciones pulmonares.
Raramente se ha notificado cianosis.
Hepáticas:
Raramente se producen reacciones hepáticas, incluyendo hepatitis, ictericia colestática, hepatitis crónica activa y necrosis hepática (ver ADVERTENCIAS).
Neurológicas:
Se ha producido neuropatía periférica, que puede llegar a ser grave o irreversible. Se han notificado casos mortales. Afecciones como la insuficiencia renal (aclaramiento de creatinina inferior a 60 mL por minuto o creatinina sérica elevada clínicamente significativa), anemia, diabetes mellitus, desequilibrio electrolítico, deficiencia de vitamina B y enfermedades debilitantes pueden aumentar la posibilidad de neuropatía periférica (ver ADVERTENCIAS).
También se han notificado casos de astenia, vértigo, nistagmo, mareo, dolor de cabeza y somnolencia con el uso de nitrofurantoína.
Raramente se han notificado casos de hipertensión intracraneal benigna (pseudotumor cerebri), confusión, depresión, neuritis óptica y reacciones psicóticas. Raramente se han notificado fontanelas abultadas, como signo de hipertensión intracraneal benigna en lactantes.
Dermatológicas:
Raramente se ha notificado dermatitis exfoliativa y eritema multiforme (incluyendo el síndrome de Stevens-Johnson). También se ha notificado alopecia transitoria.
Alérgica:
Se ha notificado un síndrome similar al lupus asociado a reacciones pulmonares a la nitrofurantoína. También se han notificado angioedema; erupciones maculopapulares, eritematosas o eczematosas; prurito; urticaria; anafilaxia; artralgia; mialgia; fiebre medicamentosa; escalofríos; y vasculitis (a veces asociada a reacciones pulmonares). Las reacciones de hipersensibilidad representan los acontecimientos adversos más frecuentes notificados de forma espontánea en la experiencia mundial posterior a la comercialización de las formulaciones de nitrofurantoína.
Gastrointestinal:
Las náuseas, la emesis y la anorexia son las más frecuentes. El dolor abdominal y la diarrea son reacciones gastrointestinales menos frecuentes. Estas reacciones relacionadas con la dosis pueden minimizarse reduciendo la dosis. Se han notificado casos de sialadenitis y pancreatitis. Se han notificado casos esporádicos de colitis pseudomembranosa con el uso de nitrofurantoína. La aparición de síntomas de colitis pseudomembranosa puede ocurrir durante o después del tratamiento antimicrobiano (ver ADVERTENCIAS).
Hematológicos:
Raramente se ha notificado cianosis secundaria a metahemoglobinemia.
Varios:
Al igual que con otros agentes antimicrobianos, las sobreinfecciones causadas por organismos resistentes, por ejemplo, especies de Pseudomonas o especies de Candida, pueden producirse.
Eventos adversos de laboratorio:
Se han notificado los siguientes eventos adversos de laboratorio con el uso de nitrofurantoína: aumento de AST (SGOT), aumento de ALT (SGPT), disminución de la hemoglobina, aumento del fósforo sérico, eosinofilia, anemia por deficiencia de glucosa-6-fosfato deshidrogenasa (ver ADVERTENCIAS), agranulocitosis, leucopenia, granulocitopenia, anemia hemolítica, trombocitopenia, anemia megaloblástica. En la mayoría de los casos, estas anomalías hematológicas se resolvieron tras el cese del tratamiento. Raramente se ha notificado anemia aplásica.
Sobredosis
Los incidentes ocasionales de sobredosis aguda de nitrofurantoína (macrocristales) no han dado lugar a ningún síntoma específico aparte de los vómitos. Se recomienda la inducción de la emesis. No existe un antídoto específico, pero debe mantenerse una elevada ingesta de líquidos para favorecer la excreción urinaria del fármaco. Es dializable.
DOSIS Y ADMINISTRACIÓN:
Las cápsulas de nitrofurantoína (macrocristales) deben administrarse con alimentos para mejorar la absorción del fármaco y, en algunos pacientes, la tolerancia.
Adultos:
De 50 mg a 100 mg cuatro veces al día; el nivel de dosis más bajo se recomienda para las infecciones del tracto urinario no complicadas.
Pacientes pediátricos:
5 a 7 mg/kg de peso corporal por 24 horas, administrados en cuatro dosis divididas (contraindicado en menores de un mes de edad).
La terapia debe continuarse durante una semana o durante al menos 3 días después de obtener la esterilidad de la orina. La continuación de la infección indica la necesidad de reevaluación.
Para la terapia supresora a largo plazo en adultos, puede ser adecuada una reducción de la dosis a 50-100 mg al acostarse. Para la terapia supresora a largo plazo en pacientes pediátricos, pueden ser adecuadas dosis tan bajas como 1 mg/kg por 24 horas, administradas en una dosis única o en dos dosis divididas. VÉASE LA SECCIÓN DE ADVERTENCIAS SOBRE LOS RIESGOS ASOCIADOS A LA TERAPIA DE LARGO PLAZO.
Cómo se suministra:
Las cápsulas de nitrofurantoína USP (macrocristales) se presentan de la siguiente forma:
50 mg de cuerpo blanco opaco y tapón amarillo opaco impreso en tinta negra con «WATSON» en el tapón y «5780» en el cuerpo.
NDC 0115-2023-10 frascos de 100
Cápsula de 100 mg opaca y amarilla con impresión en tinta negra de «WATSON» en el tapón y «5781» en el cuerpo.
NDC 0115-2024-10 frascos de 100
Almacenar a 20° a 25°C (68° a 77°F) .
Fabricado por:
Watson Pharma Private Limited
Verna, Salcette Goa 403722 INDIA
Distribuido por:
Amneal Pharmaceuticals LLC
Bridgewater, NJ 08807
Para notificar SOSPECHAS DE REACCIONES ADVERSAS, póngase en contacto con Amneal Pharmaceuticals en el 1-877-835-5472 o con la FDA en el 1-800-FDA-1088 o en www.fda.gov/medwatch.
Rev. 11-2019-00
Panel de visualización principal – 50 mg

Panel de visualización principal – 100 mg

| NITROFURANTOINA Cápsula de nitrofurantoína |
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
| NITROFURANTOINA cápsula de nitrofurantoína |
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
Etiquetadora – Amneal Pharmaceuticals of New York LLC (123797875)
Preguntas frecuentes
- ¿Qué antibióticos se utilizan para tratar la ITU?
- ¿Qué es la nitrofurantoína de «doble liberación»?
Más información sobre nitrofurantoína
- Efectos secundarios
- Durante el embarazo o la lactancia
- Información sobre la dosis
- Consejos para el paciente
- Fármaco Imágenes
- Interacciones con otros medicamentos
- Comparar alternativas
- Grupo de apoyo
- Precios &Cupones
- En español
- 1538 Reseñas
- Clase de fármacos: anti urinarioinfecciosos
Recursos para el consumidor
- Información para el paciente
- Nitrofurantoína (lectura avanzada)
Recursos para el profesional
- Información para la prescripción Información
- Nitrofurantoína (Consejo profesional del paciente)
- Nitrofurantoína cápsulas (FDA)
- Nitrofurantoína suspensión oral (FDA)
Otras marcas Macrobid, Macrodantin, Furadantin
Guías de tratamiento relacionadas
- Infección del tracto urinario
- Prevención de la infección de la vejiga
- Infección de la vejiga
Aviso médico