Contenidos
- 1 Función
- 2 Lactato deshidrogenasa humana
- 2.1 Estructura
- 2.2 Catálisis
- 2.3 Cinética
- 2.4 Regulación
- 3 Estructuras 3D de la lactato deshidrogenasa
Función
La lactato deshidrogenasa (L-LDH) cataliza la interconversión de piruvato y NADH+ a L-lactato y NAD+.
La H-lactato deshidrogenasa (H-LDH) cataliza la interconversión de D-lactato y ferritocromo c en piruvato y ferrocitocromo c.
La lactato deshidrogenasa (LDH) es una enzima importante en los seres humanos. Se encuentra en diferentes regiones del cuerpo, y cada región tiene una conformación única de diferentes subunidades. La LDH es una enzima clave en la respiración anaeróbica. La respiración anaeróbica se produce en ausencia de oxígeno. Esta vía es importante para la glucólisis de dos maneras principales. La primera es que si el piruvato se acumulara la glucólisis y por tanto la generación de ATP se ralentizaría. La segunda es que la respiración anaeróbica permite la regeneración de NAD+ a partir de NADH. El NAD+ es necesario cuando la gliceraldehído-3-fosfato deshidrogenasa oxida el gliceraldehído-3-fosfato en la glucólisis, lo que genera NADH. La lactato deshidrogenasa es responsable de la conversión anaeróbica de NADH en NAD+. en la Lactato deshidrogenasa de Cryptosporidium parvum (4nd4).
La Lactato Deshidrogenasa humana
Estructura
es una proteína cuaternaria formada por la combinación de dos subunidades, M y H (Músculo y Corazón) en una estructura de cuatro de las subunidades. Las distintas combinaciones que se encuentran en el cuerpo humano son:
- (4H) Corazón
- (3H1M) Reticuloendotelial
- (2H2M) Pulmones
- (1H3M) Riñones
- (4M) Músculo e Hígado
La de LDH como se muestra aquí está compuesta por un 40% de hélices alfa y un 23% de hojas beta. Los datos del SCOP clasifican esta forma de lactato deshidrogenasa como mixta beta-alfa-beta, con hojas beta principalmente paralelas.
Véase también
- Lactato deshidrogenasa humana
- Lactato final de Jasper
- pliegue de Rossmann.
Catálisis
Los estudios han demostrado que el mecanismo de reacción de la LDH sigue una secuencia ordenada.
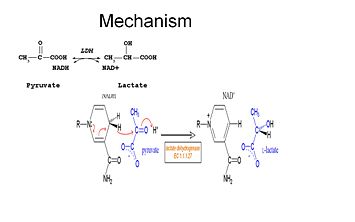
Para que el lactato sea oxidado el NADH debe unirse a la enzima primero seguido del lactato. . Una vez que el NADH se une a la enzima, entonces es posible que el lactato se una (se muestra el oxamato del sustrato; el grupo -CH3 se sustituye por -NH2 para formar oxamato). El lactato se une a la enzima entre el anillo de nicotinamida y varios residuos de la LDH. La transferencia de un ion hidruro ocurre entonces rápidamente en cualquier dirección dando una mezcla de los dos complejos terciarios, enzima-NAD+-lactato y enzima-NADH-piruvato .Finalmente el piruvato se disocia de la enzima seguido del NAD+.
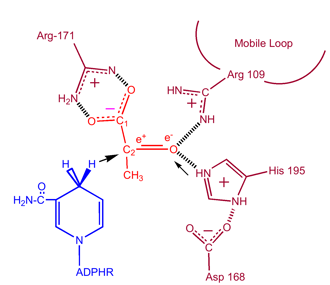
Cinética
Los estudios cinéticos de la lactato deshidrogenasa con oxalato y oxamato (análogos estructurales del lactato y el piruvato) han demostrado el mecanismo indicado anteriormente. El paso que limita la velocidad de esta reacción es la velocidad de disociación de NAD+ y NADH. La conversión de piruvato a lactato con la subsiguiente regeneración de NAD+ es muy favorable.
Regulación
Como el mecanismo es de equilibrio, no parece haber una regulación específicamente diseñada para la lactato deshidrogenasa, sino que depende de la activación de la reparación anaeróbica y de la presencia de piruvato y NADH, o de lactato y NAD+.
Estructuras 3D de la lactato deshidrogenasa
Estructuras 3D de la lactato deshidrogenasa
