- Tabla de Geometrías
- Objetivos de aprendizaje
- PUNTOS CLAVE
- Puntos Clave
- Términos clave
- Modelo VSEPR
- Geometrías moleculares
- Cómo determinar la geometría molecular – YouTube: Este vídeo describe un método para encontrar rápidamente las principales formas geométricas de las moléculas simples.
- Geometrías moleculares
- Objetivos de aprendizaje
- PUNTOS CLAVE
- Puntos clave
- Términos clave
- Método AXE
- Geometrías principales (sin pares solitarios de electrones):
- Trigonal Planar
- Tetraédrica
- Octaédrica
- Interactivo: Geometría de los electrones: Las moléculas asumen diferentes formas debido a los patrones de electrones compartidos y no compartidos. En estos ejemplos todos los electrones que afectan a la forma de las moléculas son compartidos en los enlaces covalentes que mantienen unidos a los átomos para formar las moléculas.
- Pares de electrones no compartidos
- Objetivos de aprendizaje
- PUNTOS CLAVE
- Puntos clave
- Términos clave
- Geometrías moleculares con pares de electrones solitarios
- Número de coordinación y átomo central
- El efecto repulsivo de los electrones del par solitario
- Interactivo: Los electrones no compartidos y la forma «doblada»: Utiliza el modelo 3D para ver cómo los electrones no compartidos repelen a los que están compartidos en los enlaces entre el hidrógeno y el oxígeno, provocando que la molécula tenga una forma «doblada».
- Licencias y atribuciones
- Contenido con licencia CC, compartido anteriormente
- CONTENIDO CON LICENCIA CC, ATRIBUCIÓN ESPECÍFICA
Tabla de Geometrías
La teoría VSEPR detremina las geometrías moleculares (lineal, trigonal, trigonal bipiramidal, tetraédrica y octaédrica).
Objetivos de aprendizaje
Aplicar el modelo VSEPR para determinar la geometría de una molécula que no contiene pares de electrones solitarios en el átomo central.
PUNTOS CLAVE
Puntos Clave
- Fundamentalmente, el modelo VSEPR teoriza que las regiones de carga eléctrica negativa se repelen entre sí, haciendo que éstas (y los enlaces químicos que forman) se mantengan lo más alejadas posible.
- Las geometrías moleculares tienen en cuenta el número de átomos y el número de electrones de pares solitarios.
- Las principales geometrías sin electrones de par solitario son: lineal, trigonal, tetraédrica, trigonal bipiramidal y octaédrica.
Términos clave
- Teoría VSEPR: un modelo químico utilizado para predecir la forma de las moléculas individuales basado en la repulsión electrostática de pares de electrones
Modelo VSEPR
El modelo de repulsión de pares de electrones de la capa de valencia (VSEPR) se centra en los pares de electrones enlazados y no enlazados presentes en la capa más externa (de valencia) de un átomo que se conecta con otros dos o más átomos.
Fundamentalmente, el modelo VSEPR teoriza que estas regiones de carga eléctrica negativa se repelen entre sí, haciendo que (y los enlaces químicos que forman) se mantengan lo más alejados posible. Por lo tanto, las dos nubes de electrones contenidas en una simple molécula triatómica ![]() se extenderán en direcciones opuestas. Una separación angular de 180° coloca los dos orbitales de enlace lo más lejos posible el uno del otro; por lo tanto, esperamos que los dos enlaces químicos se extiendan en direcciones opuestas, produciendo una molécula lineal.
se extenderán en direcciones opuestas. Una separación angular de 180° coloca los dos orbitales de enlace lo más lejos posible el uno del otro; por lo tanto, esperamos que los dos enlaces químicos se extiendan en direcciones opuestas, produciendo una molécula lineal.

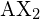 . Los dos átomos X (en blanco) están a 180° el uno del otro.
. Los dos átomos X (en blanco) están a 180° el uno del otro.Si el átomo central también contiene uno o más pares de electrones no enlazados, estas regiones adicionales de carga negativa se comportarán de forma muy parecida a las asociadas con los átomos enlazados. Los orbitales que contienen los distintos pares enlazados y no enlazados en la capa de valencia se extenderán fuera del átomo central en direcciones que minimizan sus repulsiones mutuas. Si el átomo central posee orbitales d parcialmente ocupados, puede ser capaz de acomodar cinco o seis pares de electrones, formando lo que a veces se llama un «octeto expandido»
Geometrías moleculares
Las geometrías moleculares (lineal, trigonal, tetraédrica, trigonal bipiramidal y octaédrica) están determinadas por la teoría VSEPR. Una tabla de geometrías utilizando la teoría VSEPR puede facilitar el dibujo y la comprensión de las moléculas. La tabla de geometrías moleculares se encuentra en la primera figura. La segunda figura sirve como ayuda visual para la tabla.


Cómo determinar la geometría molecular – YouTube: Este vídeo describe un método para encontrar rápidamente las principales formas geométricas de las moléculas simples.
Geometrías moleculares
La teoría VSEPR describe cinco formas principales de las moléculas simples: lineal, trigonal plana, tetraédrica, trigonal bipiramidal y octaédrica.
Objetivos de aprendizaje
Aplicar el modelo VSEPR para determinar la geometría de las moléculas donde el átomo central contiene uno o más pares de electrones solitarios.
PUNTOS CLAVE
Puntos clave
- Lineal: molécula triatómica simple del tipo
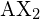 ; sus dos orbitales de enlace están separados 180°.
; sus dos orbitales de enlace están separados 180°. - Trigonal plana: triangular y en un plano, con ángulos de enlace de 120°.
- Tetraédrica: cuatro enlaces en un átomo central con ángulos de enlace de 109,5°.
- Bipiramidal trigonal: cinco átomos alrededor del átomo central; tres en un plano con ángulos de enlace de 120° y dos en extremos opuestos de la molécula.
- Octaédrica: seis átomos alrededor del átomo central, todos con ángulos de enlace de 90°.
Términos clave
- Teoría VSEPR: el modelo de repulsión de pares de electrones de la envoltura de valencia (VSEPR) se utiliza para predecir la forma de las moléculas individuales basándose en el grado de repulsión electrostática de los pares de electrones
Método AXE
Otra forma de ver las geometrías moleculares es a través del «método AXE» de recuento de electrones. A en AXE representa el átomo central y siempre tiene un subíndice uno implícito; X representa el número de enlaces sigma entre el átomo central y el exterior (los enlaces covalentes múltiples -doble, triple, etc.- cuentan como una X); y E representa el número de pares de electrones solitarios que rodean al átomo central. La suma de X y E, conocida como número estérico, también está asociada al número total de orbitales hibridados utilizados por la teoría del enlace de valencia. VSEPR utiliza el número estérico y la distribución de X y E para predecir las formas geométricas moleculares.

Nótese que las geometrías se nombran según las posiciones atómicas solamente, no la disposición de los electrones.

Geometrías principales (sin pares solitarios de electrones):
En un modelo lineal, los átomos están conectados en línea recta, y un ángulo de enlace es simplemente el ángulo geométrico entre dos enlaces adyacentes. Una molécula triatómica simple del tipo ![]() tiene sus dos orbitales de enlace separados 180°. Ejemplos de moléculas triatómicas para las que la teoría VSEPR predice una forma lineal son
tiene sus dos orbitales de enlace separados 180°. Ejemplos de moléculas triatómicas para las que la teoría VSEPR predice una forma lineal son ![]() (que no posee suficientes electrones para cumplir la regla del octeto) y
(que no posee suficientes electrones para cumplir la regla del octeto) y ![]() . Al escribir la fórmula del punto de electrones para el dióxido de carbono, observe que los enlaces C-O son enlaces dobles; esto no supone ninguna diferencia para la teoría VSEPR. El átomo central de carbono sigue unido a otros dos átomos. Las nubes de electrones que conectan los dos átomos de oxígeno están separadas 180°.
. Al escribir la fórmula del punto de electrones para el dióxido de carbono, observe que los enlaces C-O son enlaces dobles; esto no supone ninguna diferencia para la teoría VSEPR. El átomo central de carbono sigue unido a otros dos átomos. Las nubes de electrones que conectan los dos átomos de oxígeno están separadas 180°.

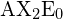 en la tabla.
en la tabla.Trigonal Planar
Las moléculas con la forma trigonal planar son triangulares y en un plano, o superficie plana. Una molécula ![]() como
como ![]() tiene tres regiones de densidad de electrones que se extienden desde el átomo central. La repulsión entre ellas será mínima cuando el ángulo entre dos de ellas sea de 120o.
tiene tres regiones de densidad de electrones que se extienden desde el átomo central. La repulsión entre ellas será mínima cuando el ángulo entre dos de ellas sea de 120o.
Tetraédrica
Tetra significa cuatro, y -hedral se refiere a una cara de un sólido; «tetraédrica» significa literalmente «que tiene cuatro caras». «Esta forma se encuentra cuando hay cuatro enlaces todos en un átomo central, sin pares de electrones solitarios. De acuerdo con la teoría VSEPR, los ángulos de unión entre los enlaces electrónicos son de 109,5o. Un ejemplo de molécula tetraédrica es el metano ![]() . Los cuatro enlaces equivalentes apuntan en cuatro direcciones geométricamente equivalentes en tres dimensiones, correspondientes a las cuatro esquinas de un tetraedro centrado en el átomo de carbono.
. Los cuatro enlaces equivalentes apuntan en cuatro direcciones geométricamente equivalentes en tres dimensiones, correspondientes a las cuatro esquinas de un tetraedro centrado en el átomo de carbono.

Una forma bipiramidal trigonal se forma cuando un átomo central está rodeado por cinco átomos en una molécula. En esta geometría, tres átomos están en el mismo plano con ángulos de enlace de 120°; los otros dos átomos están en los extremos opuestos de la molécula. Algunos elementos del grupo 15 de la tabla periódica forman compuestos del tipo ![]() ; algunos ejemplos son
; algunos ejemplos son ![]() y
y ![]() .
.

Octaédrica
Octa- significa ocho, y -hedral se refiere a una cara de un sólido, por lo que «octaédrica» significa literalmente «que tiene ocho caras.» Los ángulos de enlace son todos de 90°, y al igual que cuatro pares de electrones experimentan una repulsión mínima cuando se dirigen hacia las esquinas de un tetraedro, seis pares de electrones tratan de apuntar hacia las esquinas de un octaedro. Un ejemplo de molécula octaédrica (![]() ) es el hexafluoruro de azufre (
) es el hexafluoruro de azufre (![]() ).
).
https://lab.concord.org/embeddable.html#interactives/jsmol/electron-geometry.json
Interactivo: Geometría de los electrones: Las moléculas asumen diferentes formas debido a los patrones de electrones compartidos y no compartidos. En estos ejemplos todos los electrones que afectan a la forma de las moléculas son compartidos en los enlaces covalentes que mantienen unidos a los átomos para formar las moléculas.
Pares de electrones no compartidos
Los electrones no compartidos están en orbitales que ocupan espacio, repelen a los otros orbitales y cambian la forma de una molécula.
Objetivos de aprendizaje
Reconocer el efecto de los pares de electrones solitarios en las geometrías de las moléculas.
PUNTOS CLAVE
Puntos clave
- Los orbitales que contienen los distintos pares enlazantes y no enlazantes de la capa de valencia se extenderán hacia fuera del átomo central en direcciones que minimicen sus repulsiones.
- Un orbital no enlazante no tiene un núcleo atómico en su extremo lejano para atraer la nube de electrones hacia él; la carga en tal orbital se concentrará por lo tanto más cerca del átomo central.
- Los orbitales no enlazantes ejercen más repulsión sobre otros orbitales que los orbitales enlazantes.
Términos clave
- Número de coordinación: en química y cristalografía, el número de vecinos de un átomo central en una molécula o cristal
- par solitario: un conjunto de valencia de dos electrones que existe sin enlazar o compartir con otros átomos
Geometrías moleculares con pares de electrones solitarios
Hasta ahora, sólo hemos hablado de geometrías sin ningún par de electrones solitarios. Como probablemente haya notado en la tabla de geometrías y en el método AXE, añadir pares solitarios cambia la forma de la molécula. Hemos mencionado antes que si el átomo central también contiene uno o más pares de electrones no enlazados, estas regiones adicionales de carga negativa se comportarán de forma muy parecida a las asociadas a los átomos enlazados. Los orbitales que contienen los distintos pares enlazados y no enlazados en la capa de valencia se extenderán hacia fuera del átomo central en direcciones que minimicen sus repulsiones mutuas.

Número de coordinación y átomo central
El número de coordinación se refiere al número de pares de electrones que rodean a un átomo determinado, a menudo denominado átomo central. Las geometrías de las moléculas con pares solitarios se diferencian de las que no los tienen, porque el par solitario parece un espacio vacío en una molécula. Ambas clases de geometría reciben el nombre de las formas de las figuras geométricas imaginarias (en su mayoría polígonos sólidos regulares) que estarían centradas en el átomo central y tendrían un par de electrones en cada vértice.
En la molécula de agua (![]() ), el átomo central es
), el átomo central es ![]() , y la fórmula del punto de electrones de Lewis predice que habrá dos pares de electrones no enlazados. Por lo tanto, el átomo de oxígeno estará coordinado tetraédricamente, lo que significa que se encuentra en el centro del tetraedro. Dos de las posiciones de coordinación están ocupadas por los pares de electrones compartidos que constituyen los enlaces O-H, y las otras dos por los pares no enlazantes. Por lo tanto, aunque el átomo de oxígeno está coordinado tetraédricamente, la geometría de enlace (forma) de la molécula
, y la fórmula del punto de electrones de Lewis predice que habrá dos pares de electrones no enlazados. Por lo tanto, el átomo de oxígeno estará coordinado tetraédricamente, lo que significa que se encuentra en el centro del tetraedro. Dos de las posiciones de coordinación están ocupadas por los pares de electrones compartidos que constituyen los enlaces O-H, y las otras dos por los pares no enlazantes. Por lo tanto, aunque el átomo de oxígeno está coordinado tetraédricamente, la geometría de enlace (forma) de la molécula ![]() se describe como doblada.
se describe como doblada.

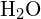 se describe como doblada.
se describe como doblada.El efecto repulsivo de los electrones del par solitario
Hay una diferencia importante entre los orbitales electrónicos de enlace y los de no enlace. Debido a que un orbital no enlazante no tiene un núcleo atómico en su extremo lejano para atraer la nube de electrones hacia él, la carga en tal orbital se concentrará más cerca del átomo central; como consecuencia, los orbitales no enlazantes ejercen más repulsión sobre otros orbitales que los orbitales enlazantes. En ![]() , los dos orbitales no enlazantes empujan a los orbitales enlazantes más cerca, haciendo que el ángulo H-O-H sea de 104,5° en lugar del ángulo tetraédrico de 109,5°.
, los dos orbitales no enlazantes empujan a los orbitales enlazantes más cerca, haciendo que el ángulo H-O-H sea de 104,5° en lugar del ángulo tetraédrico de 109,5°.
La estructura de punto de electrones de ![]() coloca un par de electrones no enlazantes en la capa de valencia del átomo de nitrógeno. Esto significa que hay tres átomos enlazados y un par solitario para un número de coordinación de cuatro alrededor del nitrógeno, lo mismo que ocurre en
coloca un par de electrones no enlazantes en la capa de valencia del átomo de nitrógeno. Esto significa que hay tres átomos enlazados y un par solitario para un número de coordinación de cuatro alrededor del nitrógeno, lo mismo que ocurre en ![]() .
.

 .: El par solitario unido al nitrógeno central crea ángulos de enlace que difieren del tetraédrico 109,5 °.
.: El par solitario unido al nitrógeno central crea ángulos de enlace que difieren del tetraédrico 109,5 °.Podemos, por tanto, predecir que los tres átomos de hidrógeno se situarán en las esquinas de un tetraedro centrado en el átomo de nitrógeno. El orbital del par solitario apuntará hacia la cuarta esquina del tetraedro, pero como esa posición estará vacía, la molécula ![]() no puede ser tetraédrica, sino que adopta una forma piramidal, más concretamente, la de una pirámide trigonal (una pirámide con base triangular). Los átomos de hidrógeno están todos en el mismo plano, con el nitrógeno fuera del plano. Los electrones no enlazantes empujan los orbitales enlazantes ligeramente, haciendo que los ángulos de enlace H-N-H sean de unos 107°.
no puede ser tetraédrica, sino que adopta una forma piramidal, más concretamente, la de una pirámide trigonal (una pirámide con base triangular). Los átomos de hidrógeno están todos en el mismo plano, con el nitrógeno fuera del plano. Los electrones no enlazantes empujan los orbitales enlazantes ligeramente, haciendo que los ángulos de enlace H-N-H sean de unos 107°.
En las moléculas de 5 coordenadas que contienen pares solitarios, estos orbitales no enlazantes (que están más cerca del átomo central y por lo tanto es más probable que sean repelidos por otros orbitales) residirán preferentemente en el plano ecuatorial. Esto los colocará en ángulos de 90° con respecto a no más de dos orbitales de enlace orientados axialmente. Por lo tanto, podemos predecir que una molécula ![]() (una en la que el átomo central A está coordinado con otros cuatro átomos X y con un par de electrones no enlazantes) como
(una en la que el átomo central A está coordinado con otros cuatro átomos X y con un par de electrones no enlazantes) como ![]() tendrá una forma de «balancín».
tendrá una forma de «balancín».

La sustitución de los átomos enlazados por pares no enlazados reduce la coordinación bipiramidal triangular a formas moleculares aún más simples.
https://lab.concord.org/embeddable.html#interactives/jsmol/unshared-electrons.json
Interactivo: Los electrones no compartidos y la forma «doblada»: Utiliza el modelo 3D para ver cómo los electrones no compartidos repelen a los que están compartidos en los enlaces entre el hidrógeno y el oxígeno, provocando que la molécula tenga una forma «doblada».
Licencias y atribuciones
Contenido con licencia CC, compartido anteriormente
- Curación y revisión. Proporcionado por: Boundless.com. Licencia: CC BY-SA: Atribución-CompartirIgual
CONTENIDO CON LICENCIA CC, ATRIBUCIÓN ESPECÍFICA
- Teoría VSEPR. Proporcionado por: Wikipedia. Ubicado en: http://en.wikipedia.org/wiki/VSEPR_Theory. Licencia: CC BY-SA: Reconocimiento-CompartirIgual
- Geometría molecular. Proporcionado por: Wikipedia. Ubicado en: http://en.wikipedia.org/wiki/Molecular_geometry. Licencia: CC BY-SA: Atribución-CompartirIgual
- Teoría VSEPR. Proporcionado por: Wikipedia. Ubicado en: http://en.wikipedia.org/wiki/VSEPR%20Theory. Licencia: CC BY-SA: Reconocimiento-CompartirIgual
- Geometría molecular. Proporcionado por: Wikipedia. Ubicado en: http://en.wikipedia.org/wiki/Molecular_geometry. Licencia: Dominio Público: Sin derechos de autor conocidos
- Geometrías VSEPR. Proporcionado por: Wikimedia. Ubicado en: http://commons.wikimedia.org/wiki/File:VSEPR_geometries.PNG. Licencia: CC BY-SA: Reconocimiento-CompartirIgual
- Cómo determinar la geometría molecular – YouTube. Ubicado en: http://www.youtube.com/watch?v=pA9ML0HVOYE. Licencia: Dominio Público: Sin derechos de autor conocidos. Términos de la licencia: Licencia estándar de YouTube
- Bolas lineales-3D. Proporcionado por: Wikipedia. Ubicado en: http://en.wikipedia.org/wiki/File:Linear-3D-balls.png. Licencia: CC BY: Atribución
- Geometría molecular. Proporcionado por: Wikipedia. Ubicado en: http://en.wikipedia.org/wiki/Molecular_geometry. Licencia: CC BY-SA: Atribución-CompartirIgual
- Teoría VSEPR. Proporcionado por: Wikipedia. Ubicado en: http://en.wikipedia.org/wiki/VSEPR_Theory. Licencia: CC BY-SA: Atribución-CompartirIgual
- Teoría VSEPR. Proporcionado por: Wikipedia. Ubicado en: http://en.wikipedia.org/wiki/VSEPR%20Theory. Licencia: CC BY-SA: Reconocimiento-CompartirIgual
- Geometría molecular. Proporcionado por: Wikipedia. Ubicado en: http://en.wikipedia.org/wiki/Molecular_geometry. Licencia: Dominio Público: Sin derechos de autor conocidos
- Geometrías VSEPR. Proporcionado por: Wikimedia. Ubicado en: http://commons.wikimedia.org/wiki/File:VSEPR_geometries.PNG. Licencia: CC BY-SA: Reconocimiento-CompartirIgual
- Cómo determinar la geometría molecular – YouTube. Ubicado en: http://www.youtube.com/watch?v=pA9ML0HVOYE. Licencia: Dominio Público: Sin derechos de autor conocidos. Términos de la licencia: Licencia estándar de YouTube
- Bolas lineales-3D. Proporcionado por: Wikipedia. Ubicado en: http://en.wikipedia.org/wiki/File:Linear-3D-balls.png. Licencia: CC BY: Atribución
- Teoría VSEPR. Proporcionado por: Wikipedia. Ubicado en: http://en.wikipedia.org/wiki/VSEPR_Theory%23AXE_method. Licencia: Dominio Público: Sin derechos de autor conocidos
- Teoría VSEPR. Proporcionado por: Wikipedia. Ubicado en: http://en.wikipedia.org/wiki/VSEPR_Theory%23AXE_method. Licencia: Dominio Público: Sin derechos de autor conocidos
- número de coordinación. Proporcionado por: Wikcionario. Ubicado en: http://en.wiktionary.org/wiki/coordination_number. Licencia: CC BY-SA: Reconocimiento-CompartirIgual
- John Hutchinson, Estudios de desarrollo de conceptos en química. 18 de septiembre de 2013. Proporcionado por: OpenStax CNX. Ubicado en: http://cnx.org/content/m12594/latest/?collection=col10264/latest. Licencia: CC BY: Atribución
- Sin límites. Proporcionado por: Boundless Learning. Ubicado en: http://www.boundless.com//chemistry/definition/lone-pair. Licencia: CC BY-SA: Reconocimiento-CompartirIgual
- Geometría molecular. Proporcionado por: Wikipedia. Ubicado en: http://en.wikipedia.org/wiki/Molecular_geometry. Licencia: Dominio Público: Sin derechos de autor conocidos
- Geometrías VSEPR. Proporcionado por: Wikimedia. Ubicado en: http://commons.wikimedia.org/wiki/File:VSEPR_geometries.PNG. Licencia: CC BY-SA: Reconocimiento-CompartirIgual
- Cómo determinar la geometría molecular – YouTube. Ubicado en: http://www.youtube.com/watch?v=pA9ML0HVOYE. Licencia: Dominio Público: Sin derechos de autor conocidos. Términos de la licencia: Licencia estándar de YouTube
- Bolas lineales-3D. Proporcionado por: Wikipedia. Ubicado en: http://en.wikipedia.org/wiki/File:Linear-3D-balls.png. Licencia: CC BY: Atribución
- Teoría VSEPR. Proporcionado por: Wikipedia. Ubicado en: http://en.wikipedia.org/wiki/VSEPR_Theory%23AXE_method. Licencia: Dominio Público: Sin derechos de autor conocidos
- Teoría VSEPR. Proporcionado por: Wikipedia. Ubicado en: http://en.wikipedia.org/wiki/VSEPR_Theory%23AXE_method. Licencia: Dominio Público: Sin derechos de autor conocidos
- Teoría VSEPR. Proporcionado por: Wikipedia. Ubicado en: http://en.wikipedia.org/wiki/VSEPR_Theory. Licencia: Dominio Público: Sin derechos de autor conocidos
- Tetrahedral_Structure_of_Water.png. Proporcionado por: Wikimedia. Ubicado en: https://commons.wikimedia.org/wiki/File:Tetrahedral_Structure_of_Water.png. Licencia: Dominio Público: Sin derechos de autor conocidos
un modelo químico utilizado para predecir la forma de las moléculas individuales basado en la repulsión electrostática de los pares de electrones
.par de electrostáticos
el número total de átomos que son vecinos directos de un átomo central en una molécula o ion
dos (un par de) electrones de valencia que no se utilizan para formar un enlace covalente
.