1Introducción
La hepatitis autoinmune (AIH) es una enfermedad hepática crónica de etiología desconocida con patrones de presentación variables. La mayoría de los pacientes experimentan un inicio crónico insidioso que se manifiesta por una elevación asintomática de las enzimas hepáticas. Sin embargo, esta enfermedad puede presentarse como hepatitis de inicio agudo, insuficiencia hepática fulminante, hepatitis crónica insidiosa o cirrosis bien establecida. En el 20-30% de los casos, la HIA provoca ictericia y un subgrupo de estos pacientes pasa a una insuficiencia hepática fulminante o subaguda. Este patrón no se ha descrito ampliamente en la literatura médica y representa un reto para los médicos, ya que puede ser muy similar a otros tipos de hepatitis aguda; además, puede progresar rápidamente a un fallo hepático fulminante . Lamentablemente, los criterios del grupo internacional de HIA y los criterios simplificados tienen un papel limitado en la puntuación de este subtipo de HIA. Algunos investigadores han sugerido que la HIA de inicio agudo puede ser una secuencia de brotes espontáneos de una enfermedad crónica preexistente. La HIA aguda afecta a todos los grupos de edad, pero es más frecuente en niños y adultos jóvenes. La insuficiencia hepática fulminante se desarrolla con mayor frecuencia en los grupos de edad más jóvenes. Tokumoto et al. dividieron la HIA de inicio agudo en dos tipos distintos en función de los hallazgos clínicos e histológicos: el primero es una exacerbación aguda de la hepatitis crónica y el segundo es una HIA de inicio agudo con características clínicas e histológicas de hepatitis aguda sin signos de cronicidad . Los niveles elevados de aminotransferasa sérica y las características histológicas clásicas están presentes en todos los tipos de HIA. El obstáculo más apremiante que dificulta el tratamiento eficaz de la HIA de inicio agudo es la obtención de un diagnóstico preciso y la distinción de este trastorno de otras hepatopatías agudas. En este estudio, nos proponemos describir la presentación clínica, la respuesta al tratamiento y el resultado de los pacientes con HIA de inicio agudo.
2Materiales y métodos
Este estudio retrospectivo, multicéntrico y de cohorte incluyó a todos los pacientes adultos diagnosticados con HIA de tres hospitales de atención terciaria en Riad, Arabia Saudita, entre enero de 1999 y diciembre de 2017. Como no había directrices especificadas ni consenso sobre el diagnóstico de la HIA de inicio agudo, el diagnóstico se basó en el sistema de puntuación del grupo internacional de HIA revisado . Solo se incluyeron los pacientes que se presentaron de forma aguda con HIA definitiva (puntuación>15) o probable HIA (puntuación 11-15) con una respuesta favorable a los esteroides. La HIA aguda se definió como la aparición reciente de síntomas de hepatitis (ictericia, fatiga, dolor en el cuadrante superior derecho y/o anorexia) durante menos de seis meses y un aumento mínimo de 10 veces en las transaminasas séricas en relación con el límite superior de los valores normales en alguien que tenía pruebas de función hepática sanas durante al menos seis meses antes de la presentación. Los pacientes con HIA que no cumplían los criterios de HIA de inicio agudo fueron etiquetados como HIA clásica y fueron excluidos de este análisis. También se excluyeron los pacientes que se sabía que padecían otras enfermedades hepáticas agudas o crónicas, como hepatitis víricas (A, B, C), metabólicas, vasculares u otras enfermedades hepáticas autoinmunes (colangitis biliar primaria o colangitis esclerosante primaria). Otros criterios de exclusión fueron la exposición a medicamentos potencialmente hepatotóxicos en los seis meses anteriores a la aparición de los síntomas y el trasplante previo de órganos.
Datos demográficos, historia clínica, pruebas de laboratorio que incluían: pruebas de la función hepática (LFT): alanina transaminasa (ALT), aspartato transaminasa (AST), fosfatasa alcalina (ALP), gamma-glutamil transpeptidasa, bilirrubina total (TB) y albúmina sérica; pruebas hematológicas: recuento completo de células sanguíneas, cociente internacional normalizado (INR); pruebas inmunológicas: anticuerpos antinucleares (ANA), anticuerpos antimúsculo liso (ASMA), anticuerpos antimitocondriales (AMA), anticuerpos microsómicos hepáticos y renales, e inmunoglobulina G (IgG) se recogieron en la presentación inicial y en cada visita de seguimiento. En las visitas de seguimiento se registraron los resultados histopatológicos, los hallazgos radiológicos y la medicación prescrita, junto con las pruebas de función hepática y otras pruebas de laboratorio. Todos los pacientes se sometieron a una biopsia hepática antes de iniciar el tratamiento. El grado de inflamación y el estadio de fibrosis de la biopsia hepática se comunicaron según el sistema de puntuación METAVIR. El resultado del tratamiento se notificó como respuesta completa, parcial o sin respuesta. La respuesta completa se definió como la normalización de las transaminasas en el plazo de un año de tratamiento con la desaparición de los síntomas, la respuesta parcial se definió como la mejora de las transaminasas en al menos un 50% con respecto a las pruebas basales sin una normalización completa, y el fracaso del tratamiento se utilizó para indicar la ausencia de mejora en las pruebas de función hepática o que el paciente había fallecido o requería un trasplante de hígado. Dado que nuestro objetivo era analizar retrospectivamente la presentación clínica, la respuesta bioquímica y serológica al tratamiento y los resultados de los pacientes que presentaban una HIA de inicio agudo, no se intentó realizar más pruebas. Además, debido a la naturaleza de los ensayos retrospectivos, no fue posible calcular un tamaño de muestra previo al estudio, sino que se incluyeron todos los casos que cumplían los criterios de inclusión.
2.1Consideraciones éticas
Debido a la naturaleza retrospectiva de este estudio, no se requirió el consentimiento de los pacientes; sin embargo, el estudio fue aprobado por las juntas de revisión institucional de los hospitales participantes. Todos los procedimientos se llevaron a cabo de acuerdo con la Declaración de Helsinki de 1975.
2.2Análisis estadísticos
Se realizó un análisis descriptivo e inferencial utilizando el paquete SPSS versión 17 para Windows (SPSS, Chicago, IL, USA). Los datos categóricos se describieron como frecuencia y porcentaje y se compararon mediante las pruebas de chi-cuadrado o exacta de Fisher. Los datos numéricos se describieron como media y desviación estándar y se compararon mediante la prueba de la t de Student en el caso de las variables con distribución normal o como mediana y rango y se compararon mediante la prueba de la U de Mann-Whitney si no tenían una distribución normal. Las variables pronósticas que predicen el resultado se determinaron mediante análisis de regresión logística univariante y multivariante. Las curvas de supervivencia se estimaron mediante el método de Kaplan-Meier y las diferencias se compararon mediante la prueba de rangos logarítmicos. Un valor p de
0,05 se consideró estadísticamente significativo.3Resultados
Durante el período de estudio, se diagnosticaron 70 pacientes con HIA de inicio agudo. Las características basales de estos pacientes se presentan en la tabla 1. La edad media de presentación fue de 33,8±1,5 años. Predominaban las mujeres, y la proporción entre mujeres y hombres era de 1,4:1. Los síntomas más comunes fueron la ictericia (94%), seguida de la fatiga (44%), el prurito (31%) y el dolor abdominal (29%). Se encontró diabetes mellitus en siete pacientes (10%) y enfermedad tiroidea en cinco (7,1%). El 61%, el 69% y el 86% de los pacientes presentaban ANA, ASMA e IgG elevados, respectivamente. Las frecuencias de los marcadores inmunológicos positivos figuran en la tabla 2. El nivel medio de IgG era de 28,3±13,5, y el nivel medio de IgM estaba dentro del rango normal. Desde el punto de vista bioquímico, todos los pacientes presentaban un aumento significativo de las transaminasas, el 50% tenía el INR elevado y todos tenían una función renal normal. Se observaron niveles normales de TB en el 5%, de ALP en el 33% y de albúmina en más del 40% de los pacientes con HIA de inicio agudo. Se obtuvieron biopsias hepáticas de todos los pacientes antes de iniciar el tratamiento, pero sólo se dispuso de los cortes histopatológicos de 60 pacientes (86%). En los 10 pacientes restantes, el diagnóstico se basó en el informe histopatológico disponible, que describía la patología típica de la HIA. Los hallazgos histológicos detallados se muestran en la Tabla 3. La inflamación era grave (grado 3) en el 70% de los casos y el 38,7% presentaba una fibrosis avanzada en el momento de la presentación (estadio 3-4). Tras una mediana de seguimiento de 85 meses (rango: 1-212), se alcanzó la respuesta completa y la remisión clínica en 52 (74,3%) y la respuesta incompleta en 10 (14,3%) pacientes. Sólo dos pacientes (2,86%) requirieron trasplante de hígado y seis (8,6%) fallecieron durante el evento agudo.
Características demográficas, clínicas y de laboratorio iniciales de los pacientes que presentaron hepatitis autoinmune aguda.
| Variables | HIA aguda | |
|---|---|---|
| n=70 | % | |
| Características demográficas | ||
| Edad (Media±SD) | 33.8±1,5 | |
| Género | ||
| Mujer | 41 | 58,6% |
| Hombre | 29 | 41.4% |
| Presentación clínica | ||
| Indice | 66 | 94,3% |
| Fatiga | 30 | 43.5% |
| Prurito | 22 | 31,4% |
| Dolor abdominal | 20 | 28.6% |
| Fiebre | 12 | 17,1% |
| Hepatomegalia | 6 | 8,6% |
| Esplenomegalia | 6 | 8.6% |
| Dolor articular | 5 | 7,1% |
| Factores de laboratorio | ||
| Bilirrubina (mmol/L): Media±SD | 210±181,8 | |
| Albúmina (g/L): Media±SD | 32,5±7,0 | |
| AST (U/L): Media±SD | 699±423 | |
| ALT (U/L): Media±SD | 733±463,6 | |
| ALP (U/L): Media±SD | 258,8±194,6 | |
| GGT (U/L): Media±SD | 190,3±256,2 | |
| Nivel de IgG (g/L): Media±SD | 28,3±13,5 | |
| Número de glóbulos blancos (109/L): Media±SD | 7,2±3,05 | |
| Hemoglobina (g/L): Media±SD | 12,7±2,0 | |
| Placas (109/L): Media±SD | 272±99,9 | |
| INR (Media±SD) | 1,6±0,6 | |
AIH: hepatitis autoinmune. DE: desviación estándar. AST: aspartato aminotransferasa. ALT: alanina aminotransferasa. ALP: fosfatasa alcalina. GGT: gamma-glutamil transferasa. IgG: inmunoglobulina G. INR: razón internacional normalizada.
Marcadores inmunológicos de todos los pacientes que presentaron HIA de inicio agudo.
| Variables | n (%) |
|---|---|
| Ana positivo | 43 (61,4%) |
| Asma positivo | 48 (68.6%) |
| Ana/ASMA positivos o ambos | 62 (88,6%) |
| Anti-LKM positivos | 2 (2.9%) |
| Positivos ANCA | 3 (4,3%) |
| Positivos ANA+ASMA | 22 (31.4%) |
| Negativo ANA+ASMA | 8 (11,4%) |
| Alta IgG | 60 (85.7%) |
| IgM alta | 3 (4,3%) |
AIH: hepatitis autoinmune. ANA: anticuerpos antinucleares. ASMA: anticuerpo antimúsculo liso. Anti-LKM: anticuerpo microsómico hepático/renal. ANCA: anticuerpos citoplasmáticos antineutrófilos. IgG: inmunoglobulina G. IgM: inmunoglobulina M.
Características histológicas en la biopsia hepática de 60 pacientes con HIA aguda.
| Características histológicas | Hallazgos | Frecuencia (%) | |
|---|---|---|---|
| Infiltrado de células plasmáticas | No presente | 3 | (5) |
| Poco | 7 | (11.7) | |
| Moderado | 30 | (50) | |
| Abundante | 20 | (33.3) | |
| Cambios inflamatorios | |||
| Hepatitis de interfase | Presente | 57 | (95) |
| Inflamación lobular | Presente | 23 | (38.3) |
| Necrosis centrilobular | Presente | 20 | (33.3) |
| Inflamación ductal | Presente | 12 | (20) |
| Grados de inflamación | Leve | 4 | (6.7) |
| Moderado | 14 | (23.3) | |
| Severa | 42 | (70) | |
| Estados de fibrosis | Estado 0-1 | 19 | (31.7) |
| Estadio 2 | 18 | (30) | |
| Estadio 3 | 14 | (23.3) | |
| Etapa 4 | 9 | (15) | |
Del análisis univariado, no se encontraron variables estadísticamente significativas para predecir la respuesta al tratamiento en esta cohorte, sin embargo, esto podría ser un error de tipo II debido al pequeño tamaño de la muestra (Tabla 4). Por otra parte, la mayor edad en el momento de la presentación fue un factor predictivo de un mal resultado en el análisis univariante y multivariante (tablas 5 y 6). Estudiamos la tasa de progresión de la enfermedad y el mal resultado (trasplante de hígado o muerte) en relación con el estadio de la fibrosis hepática y encontramos un curso de progresión más lento y un mejor resultado en los pacientes con fibrosis leve en comparación con aquellos con fibrosis grave (Fig. 1). Todos los pacientes recibieron una inducción con dosis moderadas de prednisolona oral (30-60 mg diarios) con una reducción gradual semanal y un tratamiento posterior (normalmente en 2-4 semanas) con azatioprina (50 mg diarios, dosis ajustada según la respuesta). Los dos pacientes que no alcanzaron una respuesta completa fueron cambiados a micofenolato.
Predictores de respuesta en pacientes con HIA de inicio agudo mediante análisis univariante.
| Variables | Remisiónn=52 | Sin remisiónn=18 | Valor P |
|---|---|---|---|
| Edad (Media±SD) | 32.7±1,4 | 37,0±1,8 | 0,28 |
| Género (masculino) (%) | 38.5% | 50% | 0,39 |
| Diabetes mellitus (%) | 7,7% | 16.7% | 0,27 |
| Enfermedad tiroidea (%) | 9,6% | 0% | 0,17 |
| Bilirrubina total: Mediana (intervalo) | 137 (14-623) | 204 (14-664) | 0,60 |
| ALT: Mediana (intervalo) | 573 (400-2368) | 548 (400-1312) | 0.79 |
| ANA (%) | 63,8% | 57,1% | 0,64 |
| ASMA (%) | 63.5% | 83,3% | 0,12 |
| IgG: Mediana (rango) | 24.1 (10,0-74,7) | 31 (15,0-58,1) | 0,25 |
| Inflamación (grado) (1/2/3)a | 15,4/30,7/53,8% | 6,5/21,7/71,8% | 0.63 |
| Fibrosis (estadio) (0-2/3-4)a | 53,8/46,2% | 64,4/35,6% | 0,14 |
AIH: hepatitis autoinmune. ALT: alanina aminotransferasa. ANA: anticuerpos antinucleares. ASMA: anticuerpo antimúsculo liso. IgG: inmunoglobulina G.
El grado de inflamación y el estadio de fibrosis se comunicaron según el sistema de puntuación METAVIR.
Variables predictivas asociadas con el mal resultado (Muerte o trasplante de hígado) en la HIA aguda por análisis univariante.
| Variables | Resultado favorableN=62 | Resultado pobreN=8 | Valor P |
|---|---|---|---|
| Edad (Media±SD) | 32.2±1,3 | 46,1±2,0 | 0,01 |
| Género (masculino) (%) | 43.5% | 25% | 0,32 |
| Diabetes mellitus (%) | 8,1% | 25% | 0.13 |
| Enfermedad tiroidea (%) | 8,1% | 0 | 0,41 |
| Bilirrubina total: Mediana (rango) | 134 (14-664) | 205 (38-461) | 0,47 |
| ALT: Mediana (rango) | 576 (400-2368) | 554 (400-776) | 0.96 |
| INR: Mediana (rango) | 1,4 (1-4,1) | 1,5 (1,1-3,1) | 0.82 |
| ANA | 62,3% | 66,7% | 0,88 |
| ASMA | 66.1% | 87,5% | 0,22 |
| IgG: Mediana (rango) | 23,7 (10-74.7) | 32 (13,0-58,2) | 0,44 |
| Inflamación (1/2/3)a | 9/19.6/71,4% | 12,5/37,5/50% | 0,41 |
| Fibrosis (0-2/3-4)a | 30.6% | 75% | 0,01 |
AIH: hepatitis autoinmune. ALT: alanina aminotransferasa. ANA: anticuerpos antinucleares. ASMA: anticuerpo antimúsculo liso. IgG: inmunoglobulina G.
El grado de inflamación y el estadio de fibrosis se comunicaron según el sistema de puntuación METAVIR.
Análisis multivariante de las variables que contribuyen a la predicción de un mal resultado (muerte o trasplante de hígado) en la HIA de inicio agudo.
| Variables | OR | 95% CI | Valor P | |
|---|---|---|---|---|
| Edad | 1.109 | 1.011 | 1.216 | 0.03 |
| Género | 6.309 | 0.215 | 184,836 | 0,29 |
| Diabetes mellitus | 0,763 | 0,040 | 14,412 | 0,86 |
| Bilirrubina total | 1.000 | 0,994 | 1,007 | 0,92 |
| ALT | 0,999 | 0,994 | 1,007 | 0.55 |
| INR | 1,784 | 0,449 | 7,092 | 0,41 |
| IgG | 1,010 | 0,920 | 1.109 | 0,83 |
| Fibrosis avanzada | 7,988 | 0,630 | 101,292 | 0,11 |
OR: odds ratio. IC: intervalo de confianza. ALT: alanina aminotransferasa. INR: relación internacional normalizada. IgG: inmunoglobulina G.
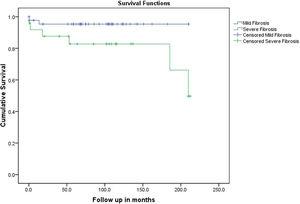
La tasa de progresión a un mal resultado (Muerte o Trasplante de hígado) según el estadio de fibrosis.
4Discusión
En este estudio, analizamos las características clínicas, bioquímicas e histológicas junto con los resultados del tratamiento y la mortalidad en pacientes con HIA de inicio agudo. Esta presentación es única y difiere de la HIA clásica. En un estudio anterior, demostramos que casi un tercio de los pacientes con HIA tenían una presentación aguda en el momento del diagnóstico. Esta cifra se aproxima al 36,4% registrado en el oeste de Arabia Saudí. Por otra parte, los informes internacionales sobre la HIA de inicio agudo han revelado tasas diferentes en distintos estudios . Por ejemplo, cuando el diagnóstico de presentación aguda se basó en parámetros bioquímicos, la HIA de inicio agudo osciló entre el 5,6% y el 26%. Sin embargo, cuando la definición de presentación aguda se basó en las características histológicas y la presencia de necrosis centrilobular (NCL), la tasa de HIA de inicio agudo aumentó hasta el 31,7% y hasta el 87% en algunos informes. En nuestra cohorte, la edad de presentación de la HIA de inicio agudo no fue diferente de la comunicada para la HIA clásica. Sin embargo, la edad media de nuestros pacientes es mucho menor en comparación con algunos estudios internacionales que informaron de una edad media de 42-58 años. Además, la HIA de inicio agudo afecta a una amplia gama de grupos de edad (de 13 a más de 80 años). La mayoría de nuestros pacientes eran mujeres, un patrón típico de las enfermedades autoinmunes, incluida la HIA, y confirmamos que la forma aguda no era una excepción. Basándose en los parámetros bioquímicos e histológicos, varios informes anteriores sobre la HIA de inicio agudo subdividieron la enfermedad en HIA de inicio agudo verdadera (genuina) y exacerbación aguda de HIA crónica preexistente . Esto coincide con nuestro estudio, en el que el 8,6% de los pacientes presentaban indicios de esplenomegalia, lo que sugiere hipertensión portal, y las biopsias hepáticas de cerca del 40% presentaban fibrosis avanzada. Este hallazgo no es inusual, dado que la HIA se caracteriza por un curso insidioso con fases de exacerbación y remisión. Los sistemas de puntuación diagnóstica originales y simplificados para la HIA son menos precisos a la hora de diagnosticar la HIA de inicio agudo. Esto representa tradicionalmente un reto diagnóstico que conduce a retrasos en el diagnóstico y, por tanto, en el inicio de la inmunosupresión . Estos retrasos en el tratamiento de la enfermedad pueden permitir la progresión de la misma hacia la forma fulminante de la HIA, que puede requerir un trasplante de hígado inmediato. En nuestra cohorte, el seguimiento relativamente largo nos permitió considerar la respuesta al tratamiento y ayudó a identificar casos que podrían haber sido excluidos en base a sus puntuaciones iniciales. Utilizamos niveles de transaminasas elevados por encima de 10 veces el límite superior normal como parte de la definición de hepatitis aguda. Informes anteriores han utilizado una definición similar para la HIA de inicio agudo con una ALT sérica de 5-10 veces el límite superior normal . El perfil autoinmune mostró una positividad de ANA y ASMA aislados o ambos juntos en aproximadamente el 90% de los casos. Esto es similar a los informes de Yamamoto et al. y Fujiwara et al. , pero más alto que lo descrito por otros . La elevación de las IgG séricas es un importante indicador bioquímico utilizado en el diagnóstico de la HIA. En el presente estudio, los niveles de IgG eran más elevados que los descritos anteriormente para la HIA clásica. Mientras que Dohmen et al. informaron de una tendencia similar, algunos autores han informado de niveles más bajos de IgG en suero en comparación con la HIA crónica y de IgG normales en aproximadamente el 30-47% de los pacientes. El análisis histológico reveló que la mayoría de nuestros pacientes presentaban una inflamación de moderada a grave; sin embargo, no estaba claro si esto tenía un impacto en el pronóstico general.
La fibrosis fue altamente prevalente en esta cohorte de pacientes a pesar de su presentación aguda y se asoció con una mala supervivencia. Del mismo modo, estudios anteriores sobre la HIA de inicio agudo encontraron una inflamación aguda grave con NLC en pacientes con HIA de inicio agudo . Varios investigadores han demostrado que entre el 55 y el 65% de los pacientes con HIA de inicio agudo mostraban indicios de cronicidad en el examen histológico. La respuesta global inicial al tratamiento fue excelente, con una tasa de respuesta completa del 80%. La tasa de respuesta de la HIA de inicio agudo ha demostrado ser similar a la de la HIA crónica en varios informes, aunque las tasas de respuesta comunicadas varían entre el 36 y el 100%. Yamamoto et al. descubrieron que el uso de esteroides en pulso no influía en el resultado de los pacientes en comparación con un régimen de dosificación de esteroides convencional. Esta diferencia observada en la tasa de respuesta puede deberse a las diferentes definiciones de HIA de inicio agudo empleadas para el diagnóstico.
El fracaso del tratamiento puede dar lugar a la progresión a la forma fulminante de HIA de inicio agudo, que requiere un trasplante de hígado urgente y causa mortalidad. En este estudio, el 2,9% de los pacientes con HIA de inicio agudo requirieron un trasplante de hígado y esta tasa es similar a la comunicada por Yamamoto et al. Por el contrario, Yeoman et al. informaron de una tasa de trasplante de hígado del 48% en su cohorte; esto podría deberse a su inclusión de pacientes con formas graves (fulminantes) de HIA de inicio agudo. Aproximadamente una quinta parte de nuestros pacientes no alcanzaron la remisión. Estos pacientes son más propensos a evolucionar hacia un resultado fulminante o incluso a la mortalidad . Yamamoto et al. demostraron que la presentación grave aguda de la HIA, pero no la exacerbación aguda de la HIA crónica, tenía más probabilidades de evolucionar hacia la muerte durante el seguimiento . Lamentablemente, en la HIA no existen biomarcadores específicos y medibles que se correlacionen con su patogénesis, la progresión de la enfermedad, la recaída, la remisión o la respuesta al tratamiento. Sin embargo, algunos biomarcadores se utilizan como importantes indicadores terapéuticos: los ácidos micro-ribonucleicos, la muerte programada soluble-1 (sPD-1), el factor inhibidor de la migración de macrófagos (MIF), el CD163 soluble, el factor activador de las células B (BAFF) y los patrones de metabolitos en sangre. Se ha propuesto que estos marcadores poseen características específicas que potencian su importancia como marcadores sustitutos del proceso inflamatorio, que pueden ser monitorizados durante el tratamiento. Nishikawa et al. informaron de que los niveles séricos de BAFF y de proteína 10 inducible por interferón-γ (IP-10) son útiles para evaluar el grado de inflamación hepática en la HIA. Aarslev et al. estudiaron a pacientes con HIA activa, respuesta parcial y respuesta completa al tratamiento estándar. Descubrieron que los niveles de sPD-1 eran mayores en los pacientes con HIA activa y en los que respondían parcialmente en comparación con los que respondían completamente. Assis et al. demostraron que un polimorfismo de MIF se asocia con la gravedad de la enfermedad en la HIA, tal y como indica la elevación de la ALT, y requiere el mantenimiento del tratamiento con esteroides.
El presente estudio tiene algunas limitaciones. No pudimos analizar ninguno de los biomarcadores mencionados porque no estaban disponibles para la práctica clínica diaria en nuestros centros. En futuros estudios debería incluirse un perfil bioquímico amplio para facilitar la identificación de biomarcadores pronósticos. La naturaleza retrospectiva de este estudio y la falta de un protocolo estandarizado para el tratamiento y el seguimiento también limitan nuestra capacidad para establecer conexiones causales entre los datos. Se necesitan futuros estudios prospectivos, multicéntricos y a largo plazo para comprender mejor la enfermedad e informar sobre su diagnóstico, especialmente en el caso de los pacientes con hepatitis aguda de etiología poco clara. Las ventajas de este estudio incluyen el hecho de ser un estudio multicéntrico con un número relativamente alto de pacientes, dada la naturaleza poco común de la enfermedad de interés. Además, la larga duración del seguimiento permitió una investigación sin precedentes de los resultados del tratamiento a largo plazo de la HIA de inicio agudo. Este estudio ha puesto de manifiesto varios aspectos clínicamente relevantes de una enfermedad relativamente rara que se ha investigado poco en todo el mundo. Los hallazgos descritos aquí confirman que el diagnóstico precoz y el tratamiento oportuno son fundamentales para detener la progresión hacia la insuficiencia hepática, reducir la necesidad de trasplante de hígado y aumentar la supervivencia.
5Conclusión
La HIA de inicio agudo es una enfermedad que requiere un diagnóstico y un tratamiento precoces para garantizar un resultado favorable para el paciente. En este estudio, describimos las características clínicas, bioquímicas e histológicas de esta enfermedad, además de la respuesta a largo plazo al tratamiento y la supervivencia. Las transaminasas e IgG elevadas con ANA y ASMA positivos son las características distintivas de la HIA de inicio agudo; sin embargo, la ausencia de estos parámetros no excluye totalmente un diagnóstico positivo. Una gran proporción de nuestros pacientes mostraba una considerable fibrosis y cirrosis a pesar de la presentación aguda. En general, observamos una excelente respuesta inicial al tratamiento; sin embargo, la mortalidad a largo plazo fue superior a la de la población general de pacientes, especialmente en el caso de los pacientes con cirrosis.
Abreviaturas
AIH
Hepatitis autoinmune
LFTs
pruebas de función hepática
ALT
transaminasa de alanina
AST
transaminasa de aspartato
ALP
fosfatasa alcalina
GGT
gamma-glutamil transferasa
TB
bilirrubina total
INR
ratio internacional normalizado
ANA
anticuerpo antinuclear
ASMA
anti-músculo liso
AMA
anticuerpo antimitocondrial
IgG
inmunoglobulina G
IgM
inmunoglobulina M
Apoyo financiero
Los autores de este manuscrito no han recibido ninguna subvención o financiación de organismos públicos o comerciales.
Conflictos de intereses
No hay conflictos de intereses que revelar.