Temas de química general
Energía: Conceptos fundamentales
Formas de energía: Cinética y potencial.Trabajo y energía.Calor y temperatura.Energía potencial electrostática.
Energía: cinética y potencial
El concepto de energía es fundamental para las ciencias físicas. Aquí pretendemos exponer algunos primeros principios relativos a la energía, e introducir algunas de las formas que adopta la energía y que son de especial importancia para la química. En primer lugar, suele ser muy útil definir un sistema como una parte concreta del universo sobre la que se realizan nuestras observaciones. El sistema está formado por un objeto o conjunto de objetos, y se distingue del resto del universo -que llamamos entorno- por una frontera real o imaginaria.
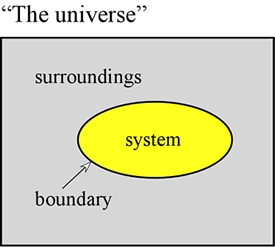
Una muestra de gas mantenida dentro de un volumen fijo, como un cilindro metálico, es un ejemplo de sistema, que nos resultará relevante cuando abordemos el estudio de las propiedades generales de los gases. Otros ejemplos son una muestra de gas dentro de un globo o una mezcla de combustión en un cilindro con un pistón. En ambos casos, el sistema está rodeado por una frontera física, pero móvil, de modo que el volumen del sistema no es fijo. Otro ejemplo que consideraremos a menudo es el de una mezcla de sustancias en disolución que experimenta una reacción química dentro de un tubo de ensayo o un vaso de precipitados. La terminología introducida aquí es de particular importancia en el estudio de cómo se manifiesta la energía en los sistemas químicos, que cae en gran medida bajo el título de la termodinámica.
En la química general, los sistemas que consideramos relevantes están típicamente en reposo y se ignoran los efectos gravitacionales. A menudo, lo que más nos interesa son los sistemas en los que tienen lugar reacciones químicas, cuya composición química cambia con el tiempo. Sin embargo, adoptemos por el momento una perspectiva más amplia utilizando sistemas mecánicos como un péndulo que se balancea, o bolas de billar que ruedan y chocan, para ayudarnos a entender los principios generales relacionados con la energía.
Se puede decir que un sistema posee energía de dos maneras diferentes, que llamamos energía cinética y potencial. La energía cinética es la energía de la materia en movimiento. La física proporciona una definición matemática exacta de la energía cinética (KE), que se muestra en la ecuación (abajo a la izquierda).
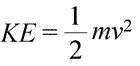
Aquí, la energía cinética de un objeto se representa como un producto de la masa del objeto (m) y el cuadrado de su velocidad (v), multiplicado también por la constante ½. Si el sistema está formado por más de un objeto, la energía cinética total es expresable como una suma de las energías cinéticas de los objetos individuales.
Podemos derivar unidades para la energía dada esta definición. La unidad del SI para la energía es el joule (J), que se define como:
1 J = 1 kg-m-s-2
La energía potencial es la energía de un sistema que típicamente puede ser convertida en energía cinética de alguna forma, y capaz de producir, en alguna medida, una cantidad llamada trabajo (discutida más adelante). Un ejemplo claro de energía potencial es un ladrillo en la cornisa de un edificio. El ladrillo tiene una cierta cantidad de energía potencial en virtud de su altura, es decir, su ubicación con respecto a un campo gravitatorio. Si le damos un empujón al ladrillo para que caiga de la cornisa, se mueve espontáneamente en la dirección de la energía potencial gravitatoria más baja y, al hacerlo, gana energía cinética. Otro ejemplo es la energía potencial eléctrica de una batería (que se expresa en términos de tensión). Cuando se hace un circuito con un cable y una bombilla, conectando los dos terminales de una pila, la diferencia de potencial eléctrico entre ellos hace que los electrones del cable se muevan (energía cinética), dando lugar a la producción tanto de calor como de luz.
Un importante principio general sobre la energía es que no puede crearse ni destruirse. Esto se conoce como la ley de conservación de la energía. Cuantitativamente, esto significa que en un sistema como el ladrillo que cae o el péndulo de un reloj, la suma de la energía cinética y potencial es constante. Esto es en cierto modo una abstracción, ya que en un péndulo real, parte de la energía se pierde continuamente debido a la fricción, y hay que añadir una pequeña cantidad de energía al péndulo para que siga oscilando (y el reloj funcione). Pero si tenemos en cuenta esa energía «perdida» (que en realidad aparece como un aumento de la energía térmica de las moléculas de aire circundantes) mediante cuidadosas mediciones experimentales, se comprueba que, efectivamente, la energía se conserva siempre. Otra advertencia se resume en la famosa ecuación de Einstein E = mc2, que expresa una equivalencia fundamental de masa y energía. Una forma más general de la ley de conservación de la energía, que puede denominarse ley de conservación de la masa-energía, da cuenta de esta equivalencia. Volviendo a la química general, estas interconversiones materia-energía no son típicamente de su competencia, mientras que el estudio de las reacciones nucleares y de la radiactividad se engloba en la física nuclear.
Si consideramos una reacción química en la que los cambios químicos van acompañados de la producción de calor, surge una pregunta: ¿Qué pasa con la conservación de la energía en este caso? La respuesta es que existe una forma de energía potencial, que podemos llamar energía potencial química (o simplemente potencial químico), que puede considerarse que reside en la composición molecular de los reactivos. Esta energía potencial se convierte en energía en forma de calor, pero resulta que la cantidad neta de energía presente permanece constante, una vez que somos capaces de definir y medir la producción de calor. Un ejemplo cotidiano de lo que ahora podemos entender como energía potencial química viene dado por un motor de gasolina, en el que la mezcla de gasolina y oxígeno posee una forma de energía latente. Esta energía latente en la mezcla de gasolina y oxígeno se gasta para producir la energía cinética de un coche.
Trabajo y energía
El trabajo es otro concepto que admite una definición precisa en física. Además, las leyes de la mecánica pueden relacionarse con la energía mediante el teorema trabajo-energía. Una patada a un balón de fútbol, o cualquier otro ejemplo similar, ilustra la idea de que la energía cinética de un objeto puede aumentar mediante la aplicación de una fuerza. El teorema trabajo-energía, que es una generalización de esta idea, puede enunciarse a grandes rasgos como sigue: El cambio en la energía que posee un objeto es igual a la magnitud de la fuerza que actúa sobre él, multiplicada por la distancia a través de la cual actúa la fuerza.
El cambio de energía que se produce en un sistema como resultado del trabajo puede ser positivo o negativo, desde el punto de vista del sistema. El trabajo puede ser realizado por un sistema, o un sistema puede tener trabajo realizado sobre él por el entorno. Si el sistema realiza trabajo, pierde energía en el entorno. Si el sistema recibe trabajo, la energía del sistema aumenta. Por ejemplo, cuando una chispa que desencadena una mezcla de combustión en un cilindro con un pistón móvil provoca una rápida expansión del sistema, y la expansión está acoplada mecánicamente al movimiento de un vástago en el entorno, el sistema del cilindro realiza un trabajo sobre el entorno y, al hacerlo, pierde energía. Esto, por supuesto, es una parte de cómo un motor de combustión interna convierte la energía potencial química en la energía cinética de un coche en movimiento.
Una implicación del teorema trabajo-energía es para las unidades, es decir, que el trabajo se puede medir en las mismas unidades que la energía. Dado que la segunda ley de Newton es fuerza = masa × aceleración, el newton (N), la unidad del SI para la fuerza, se deriva como M × L × T -2, y por tanto 1 N = 1 kg m s-2. La fuerza por la distancia tiene las cantidades M × L2 × T -2, y así la unidad del SI para la energía, el joule (J), se define como 1 J = 1 kg m2 s-2. En este punto, debes verificar por ti mismo que la ecuación de la energía cinética implica la misma combinación de las cantidades fundamentales masa (M), longitud (o distancia, L) , y tiempo (T).
Calor y temperatura
Usamos las palabras calor y temperatura con bastante frecuencia, y a menudo hablamos del calor como una forma de energía. Todos tenemos un sentido intuitivo de lo que son estas cosas, pero aquí queremos pensar en ellas de forma más científica, y darles definiciones más formales si podemos. Esto es un preludio necesario para la cuantificación de la energía correspondiente al calor, y de ahí a las mediciones para verificar la ley de conservación de la energía. Lo que encontramos es que la energía térmica de un sistema puede compararse con la energía cinética total (como se ha definido anteriormente) de los átomos y moléculas que lo componen. La temperatura de un objeto o sistema es en realidad una medida de la energía cinética media de los átomos y/o moléculas que lo componen. (Nota: la temperatura no es exactamente igual a la energía cinética molecular media, pero es directamente proporcional a ella. Para más detalles, véase la página web de la teoría cinética molecular).
Una forma de visualizar lo que entendemos por calor y temperatura, y la distinción entre ellos, es considerar una analogía con la bola de billar. En algunos contextos simples, el comportamiento de las bolas de billar es un modelo adecuado para una colección de átomos o moléculas, como en una muestra de un gas. Al igual que las bolas de billar que acaban de ser golpeadas por una bola blanca que se mueve rápidamente, las moléculas de un gas se mueven por todas partes, rebotando entre sí y contra las paredes del recipiente que las contiene. La energía cinética total de las bolas de billar, que no es más que la suma de las energías cinéticas individuales de cada bola, es análoga al contenido de energía térmica de una muestra de moléculas de gas. En un «break» al comienzo de una partida de billar, la energía cinética inicial de la bola blanca se distribuye entre todas las bolas de la mesa. Algunas se mueven bastante rápido y otras no tanto, pero la analogía con el «calor» o la «energía térmica» para el sistema de bolas de billar es sólo la suma de estas energías cinéticas. Por otro lado, la temperatura del sistema de bolas de billar sería proporcional a la energía cinética media del conjunto de bolas.
Energía potencial electrostática
La ley de atracción y repulsión electrostática, o Ley de Coulomb, describe la fuerza ejercida sobre un objeto cargado debido a la presencia de otro objeto cargado. La fuerza se calcula más fácilmente cuando las cargas pueden tratarse como cargas puntuales muy pequeñas. La magnitud de la fuerza que «siente» un objeto cargado es proporcional al producto de las cargas (la unidad del SI para la carga eléctrica es el Coulomb, C), e inversamente proporcional al cuadrado de la distancia de separación entre las cargas (r en la figura de la derecha). La fuerza es una fuerza atractiva (como la gravedad, e indicada por las puntas de flecha hacia adentro en la figura) si las cargas son de signo opuesto, y repulsiva cuando las cargas tienen el mismo signo.
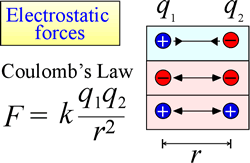
Cuando las fuerzas (como las electrostáticas, magnéticas y gravitacionales) pueden actuar a distancia (a través del espacio, sin contacto mecánico), se dice que los objetos sujetos a dichas fuerzas están en un campo de energía potencial. Ya hemos hablado de la energía potencial gravitatoria y, de forma similar, en el caso de las fuerzas electrostáticas, un objeto cargado tendrá energía potencial electrostática en virtud de su ubicación en un campo eléctrico. Dicho campo existe en la proximidad de cualquier otra carga o cargas.
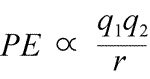
Ecuación de la energía potencial electrostática: PE es proporcional a las cargas q1 y q2, e inversamente proporcional a la distancia de separación, r. La forma de la función de energía potencial se desprende matemáticamente de la expresión de la fuerza, la Ley de Coulomb.
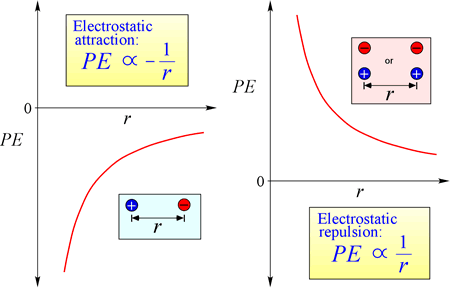
Dados los signos opuestos de las cargas en atracción, la energía potencial es siempre negativa, y cuanto más se acercan las cargas, más negativa -es decir, más baja- se vuelve la energía potencial. A medida que la distancia de separación, r, se aproxima a cero, la energía potencial se vuelve infinitamente negativa. Para cargas del mismo signo, la energía de repulsión es siempre positiva, y se vuelve infinitamente positiva a medida que la distancia de separación, r se aproxima a cero.
La energía potencial electrostática es una consideración importante en química. La comprensión de la naturaleza del átomo, del enlace químico y de las fuerzas intermoleculares depende absolutamente de que se tenga en cuenta la influencia de las interacciones carga-carga que contribuyen a la energía de un sistema.
Unidades importantes
Energía (unidad SI) 1 julio = 1 J = 1 kg-m-s-2
Carga elemental, e = 1,60218 × 10-19 C (culombio, C)
Constante de Faraday: F = NAe = 9,64853 × 104 C-mol-1
Potencial eléctrico: voltios, V 1 V = 1 J C-1