¿Cómo empezó la vida en la Tierra? En un planeta joven y rocoso, ¿cómo pudieron juntarse las sustancias químicas de la manera adecuada para formar las primeras células? ¿Cómo empezaron esas células primitivas a comportarse como la vida: creciendo, dividiéndose y transmitiendo rasgos ventajosos a la siguiente generación?
Los orígenes de la vida son especialmente turbios porque el registro geológico -las capas de roca y los fósiles incrustados que contienen pistas sobre la historia de la Tierra y la vida- desaparece hace aproximadamente 3.900 millones de años, borrado por los movimientos de la corteza del planeta. Como resultado, los científicos carecen de pruebas directas de las condiciones de la Tierra primitiva, incluidas las pruebas de las moléculas que podrían haberse arremolinado en los estanques primordiales y formado los bloques de construcción de la vida.
Esto plantea una gran cantidad de preguntas, precisamente el tipo de grandes preguntas a las que Jack Szostak se siente atraído. Él y otros creen que pueden reconstruir en el laboratorio el largo camino que condujo desde las sustancias químicas en el espacio, a la formación de la Tierra, a la química previa a la vida en el planeta, a las primeras protocélulas y, finalmente, a las células avanzadas con metabolismo y síntesis de proteínas. Exploraciones tan extensas como éstas requieren conocimientos en muchos campos, como la química y la bioquímica, la geología y la geofísica, y la astronomía.
Szostak (pronunciado shah-stak) puede ser la persona ideal para buscar respuestas. Premio Nobel, profesor de genética en la Facultad de Medicina de Harvard, profesor de química y biología química en la Facultad de Artes y Ciencias, investigador distinguido Rich del Hospital General de Massachusetts (MGH) e investigador del Instituto Médico Howard Hughes, es descrito por otros como un científico brillante y motivado. Pero también es conocido por su suave humildad, que incluye la voluntad de profundizar en temas que son nuevos para él, y por su compañerismo, por ayudar a fomentar el intercambio de ideas que está haciendo avanzar la ciencia.
Su propia investigación se centra en un segmento de la vía hacia la vida: la protocélula, «una célula primordial muy, muy simple que podría ensamblarse a partir de sustancias químicas que estaban alrededor, en la superficie de la Tierra», explica Szostak. Espera entender cómo creció, se dividió y empezó a replicarse, y finalmente evolucionó. «Puede que no sepamos lo que ocurrió realmente, pero tal vez podamos elaborar diferentes caminos posibles», dice. «Todo lo que podemos hacer es intentar reunir en el laboratorio cosas que parezcan plausibles».
«Evolución dirigida»
Este mes de agosto Szostak cumplió cuarenta años en Harvard y treinta y cinco en el MGH (donde se encuentra su laboratorio), un mandato marcado por importantes descubrimientos en una sorprendente variedad de campos. En la década de 1980, su laboratorio llevó a cabo experimentos con levaduras para comprender la genética y la bioquímica de la recombinación del ADN, trabajo que condujo al modelo de reparación de la rotura de la doble cadena, que describe cómo se rompen las cadenas largas de ADN, se intercambian segmentos y se vuelven a unir. Esto dio lugar a investigaciones posteriores sobre el mecanismo de recombinación durante la meiosis, la división celular que da lugar a los espermatozoides y los óvulos.
Durante el mismo periodo, su equipo también realizó importantes descubrimientos sobre los telómeros, las tapas protectoras que se encuentran en los extremos de los cromosomas y que garantizan que el ADN se replique correctamente cuando las células se dividen. Por esta investigación, Szostak recibió más tarde el Premio Nobel de Fisiología o Medicina de 2009, que compartió con las investigadoras Elizabeth Blackburn, doctora en ciencias en 2006, ahora emérita en la Universidad de California en San Francisco, y Carol Greider, de Johns Hopkins.
Cuando Szostak recibió la llamada telefónica de madrugada desde Suecia en octubre de 2009, ya había pasado más de 20 años haciendo contribuciones fundamentales en otras áreas de la ciencia. Tras los descubrimientos sobre los telómeros a mediados de la década de 1980 (la investigación relacionó los telómeros acortados con muchas enfermedades del envejecimiento), muchos científicos entraron en el campo y Szostak optó por cambiar de dirección. «Estaba bastante claro cuáles debían ser los siguientes experimentos, y parecía que cualquier cosa que hiciéramos se haría de todos modos», recuerda. «Nunca me ha parecido que tenga mucho sentido hacer cosas que se van a hacer de todos modos. Así que eso me hizo mirar a mi alrededor y pensar en qué otro tipo de cuestiones científicas podría empezar a abordar». En 1984 aceptó una oferta para trasladar su laboratorio de lo que entonces era el Instituto del Cáncer Sidney Farber al MGH, para unirse a los investigadores que allí trabajaban en ciencia básica. «Fue una oferta increíble: toda mi investigación estaría totalmente financiada durante 10 años», recuerda Szostak. «Era perfecto para mí, ya que me permitía cambiar de dirección sin preocuparme por la redacción de subvenciones en un nuevo campo».»
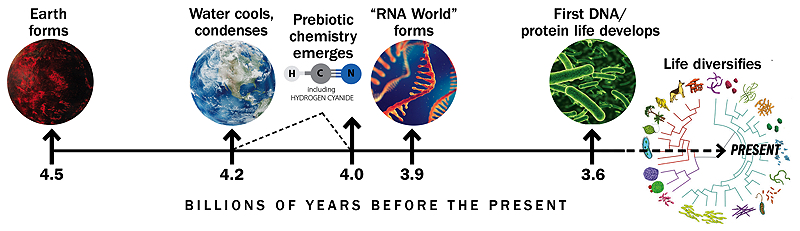
Línea de tiempo basada en un gráfico similar de Gerald Joyce
Tras considerar sus opciones, se decantó por las enzimas de ARN conocidas como ribozimas, un campo que veía «interesante, manejable y no muy competitivo». Él y sus estudiantes de posgrado comenzaron a desarrollar herramientas para hacer evolucionar el ARN, las moléculas monocatenarias de las células que copian la información genética contenida en el ADN. En los tubos de ensayo, su equipo hizo que el ARN asumiera nuevas funciones, como el reconocimiento de moléculas objetivo y la catalización de reacciones. Este proceso, conocido como «evolución dirigida», consistía en introducir mutaciones en las cadenas de ARN, buscar variantes que pudieran desempeñar funciones útiles y permitir que esas nuevas moléculas se reprodujeran. También realizaron trabajos similares con el ADN, los péptidos y las proteínas.
En 1994, Szostak recibió el Premio de la Academia Nacional de Ciencias en Biología Molecular, junto con el investigador Gerald Joyce, ahora del Instituto Salk de Estudios Biológicos, por desarrollar simultánea pero independientemente la evolución in vitro del ARN. «Es una tecnología para fabricar moléculas que hagan lo que tú quieras», explicó Joyce en una entrevista, describiéndola como algo similar a la forma en que los científicos agrícolas crían vacas para que produzcan más leche, o desarrollan cultivos que resisten la sequía. «Esta es la versión molecular de eso. Y es algo que ahora se practica muy ampliamente», añade (véase «Aprovechamiento de la evolución», enero-febrero de 2017, página 15), una forma de desarrollar nuevas moléculas para una serie de usos, incluidos los medicamentos.
Para Szostak, el trabajo sobre la evolución dirigida planteó nuevas preguntas. «Cada vez me interesaba más cómo se inició la evolución por sí sola en la Tierra primitiva», recuerda. «Una cosa es imponer presiones selectivas y hacer la evolución darwiniana en el laboratorio, donde tienes enzimas y estudiantes e instrumentos. Pero, de alguna manera, la evolución darwiniana comenzó por sí sola». Dado que la capacidad de evolucionar es una característica clave de la vida, Szostak se planteaba una de las preguntas fundamentales de la ciencia: ¿Cómo empezó la vida?
Orígenes: «Tres grandes preguntas fundamentales»
El canadiense-estadounidense Szostak nació en Londres, donde su padre estudiaba la carrera de ingeniería aeronáutica. La familia regresó finalmente a Canadá, donde vivieron en Ottawa y luego en Montreal, y su padre trabajó para la Fuerza Aérea Canadiense. (Su madre trabajó durante muchos años en funciones administrativas para una empresa química industrial, y Szostak tuvo su primer trabajo de verano allí cuando era adolescente, probando la solidez del color en el laboratorio de tintes de la empresa. «El trabajo era repetitivo y aburrido, pero me dio mi primera visión de lo importante que es probar y volver a probar los productos para su uso en el mundo real», recuerda. Para entonces ya estaba «seriamente interesado» en la ciencia, las matemáticas y la ingeniería. Se doctoró en bioquímica a los 25 años en Cornell, y considera a su asesor, Ray Wu, un importante mentor: «Creó un gran ambiente de laboratorio, pero también me enseñó a buscar ayuda en un proyecto cuando me encontraba con problemas»
Aunque Szostak ha llevado a cabo algunas investigaciones prácticas y aplicadas en su carrera -una de las empresas que lanzó, Ra Pharma, ha descubierto un fármaco para la enfermedad de la miastenia gravis que está a punto de comenzar la fase III de los ensayos clínicos-, lo que más le apasiona es la ciencia básica.
«Es un momento apasionante para dedicarse a la neurociencia, porque ahora se pueden abordar problemas que hace 30 años ni siquiera se podían plantear»
«En mi opinión, hay tres grandes cuestiones científicas fundamentales que son superinteresantes: el origen de la vida, el origen del universo y el origen de la mente o la conciencia», ofrece, sentado en su tranquilo despacho, casi vacío, en el Laboratorio Mallinckrodt de Oxford Street, en Cambridge. (La oficina es para reuniones ocasionales; Szostak trabaja principalmente en su laboratorio del MGH). Después del origen de la vida, el origen de la mente es lo que más le interesa. En los años 80, cuando planeaba qué hacer después de su investigación sobre los telómeros, contempló la posibilidad de pasarse al estudio de la neurociencia e incluso asistió a seminarios de Harvard sobre el tema. «Era fascinante, pero también deprimente, porque la tecnología era muy primitiva», recuerda. Desde entonces ha observado con interés el avance de las herramientas de este campo. «Es un momento emocionante para que los jóvenes se dediquen a la neurociencia porque, con toda la nueva tecnología, ahora se pueden abordar problemas que hace 30 años ni siquiera se podían pensar», dice. «Sin embargo, el problema general sigue siendo enorme y algo desalentador. Tal y como yo lo veo, estoy trabajando en el más fácil de estos grandes problemas». Como las preguntas sobre los orígenes de la vida se adaptan bien a las tecnologías de investigación actuales, añade, cree que es «un problema solucionable».
Protocélulas modelo y ARN «desordenado»
El equipo de Szostak lleva fabricando protocélulas modelo desde principios de la década de 2000, tratando de averiguar cómo podrían haberse ensamblado y evolucionado originalmente. Estas estructuras primitivas eran «extremadamente simples» en comparación con la bacteria unicelular más sencilla de la Tierra en la actualidad, explica. Las protocélulas probablemente incluían una membrana grasa mínima e inicialmente sólo un gen que confería alguna ventaja a la célula. Las bacterias modernas, por el contrario, «tienen al menos cientos y normalmente miles de genes».
A pesar de algunas teorías de que la vida primitiva surgió cerca de respiraderos hidrotermales en las profundidades del océano, Szostak está más convencido por las investigaciones que demuestran que las primeras células se desarrollaron en tierra, en estanques o charcas, posiblemente en regiones de actividad volcánica. La luz ultravioleta y los rayos podrían haber ayudado a convertir las moléculas de la atmósfera en cianuro y otros materiales útiles para generar los componentes básicos de la vida. El agua poco profunda daría a esos materiales un lugar para acumularse en altas concentraciones, y la actividad volcánica podría crear fluctuaciones de temperatura calientes y frías útiles para ciertas reacciones químicas.
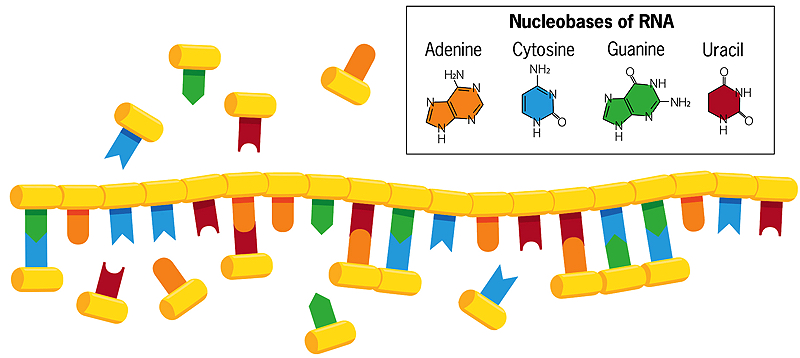
Una historia de la Tierra y los inicios de la vida
A diferencia del ADN de doble cadena, en el que las bases citosina y timina se emparejan con guanina y adenina en la cadena opuesta, las bases de una cadena helicoidal simple de ARN en el agua pueden formar asociaciones con nucleobases que flotan libremente (mostradas en la imagen de arriba). Si estas bases flotantes se fusionan entre sí, se crea una nueva copia en espejo de la cadena de ARN, que se separa de la original cuando se calienta el agua. Cuando esa nueva cadena se replica a su vez, crea una copia en espejo de sí misma que coincide con la cadena de ARN original. A veces se producen errores en este proceso de copia, y los errores beneficiosos se perpetúan. Así, cada cadena, actuando como plantilla para su propia replicación, evoluciona e interactúa con su entorno.
Algunos científicos, entre ellos Gerald Joyce, sugieren que la vida podría haber comenzado fuera de las células, con moléculas que flotan libremente encontrándose y formando vínculos que les permitirían actuar como vida. Pero Szostak sostiene que la membrana celular era necesaria, en parte porque mantendría unidas las moléculas genéticas beneficiosas y evitaría que los metabolitos útiles producidos por las ribozimas codificadas genéticamente flotaran en el agua circundante o fueran enganchados por otras protocélulas que pasaran por allí.
Los experimentos realizados en su laboratorio mostraron cómo podría crecer y dividirse dicha membrana. Los investigadores combinaron ácidos grasos como el ácido oleico con agua y un tampón (para mantener estable el pH de la solución) y luego agitaron la solución. Cuando se observó al microscopio, los ingredientes se habían reunido formando vesículas: estructuras circulares llenas de líquido con membranas bicapa. La adición de ácidos grasos adicionales al entorno -para que sirvieran de nutrientes- hizo que las vesículas crecieran con filamentos largos, parecidos a pelos, tan frágiles que incluso un leve soplo de aire sobre el portaobjetos del microscopio hizo que se rompieran en pedazos. El equipo de Szostak obtuvo resultados similares con diferentes moléculas formadoras de membranas y en diferentes entornos, lo que sugiere que ésta es una forma plausible de que la membrana de una protocélula crezca y se divida. Pero, ¿cómo podría esa estructura pasar el material genético beneficioso a la siguiente generación de células hijas? «Es el material genético el que realmente parece un problema mucho más difícil», afirma.
Para compartir los rasgos heredados con las sucesivas generaciones, las células actuales dependen del ADN -la molécula de doble hélice compuesta por las nucleobases adenina, citosina, guanina y timina- para almacenar y transmitir la información genética. Pero la replicación del ADN en las células requiere tanto la molécula monocatenaria de ARN como enzimas proteicas, y las proteínas codificadas genéticamente son demasiado complejas para haberse formado espontáneamente en la Tierra primitiva. Dado que el ARN puede almacenar y transmitir información genética (como el ADN) y catalizar reacciones químicas (como las enzimas proteicas), muchos investigadores creen que las células primitivas utilizaban moléculas de ARN para desempeñar tanto funciones genéticas como enzimáticas.
A finales de la década de 1960, el científico británico Leslie Orgel propuso que el ARN, o algo parecido, podría haber sido la primera molécula de la Tierra en replicarse y evolucionar; esto se conoció como la hipótesis del «mundo del ARN». Orgel y otros trabajaron durante décadas para entender cómo las cadenas de ARN podrían haberse unido y replicado, pero sus esfuerzos no fueron del todo exitosos. «Al principio se avanzó mucho y luego se estancó porque había una docena de problemas diferentes y en ese momento no había una respuesta obvia para ninguno de ellos», explica Szostak. «Casi todo el mundo se frustró y pensó: ‘Quizá la vida no empezó con el ARN. Tal vez haya algo más sencillo, más fácil de fabricar, más fácil de replicar'»
«Ahora sabemos mucho más, y sólo dividiendo las cosas en problemas individuales y más pequeños, hemos sido capaces de resolver algunos de ellos»
Los investigadores buscaron alternativas al ARN, «y eso nos llevó a 10 o 20 años de química realmente interesante, dando con un montón de moléculas interesantes», señala Szostak. «Pero hasta ahora no ha aparecido nada más sencillo o mejor que el ARN que realmente funcione». Algunos investigadores apoyan la hipótesis del «metabolismo primero», que sugiere que la vida podría haber comenzado sin material genético, a través de una serie de reacciones autosostenibles, pero Szostak y otros siguen sin estar convencidos. Hace unos siete años, empezó a revisar los obstáculos a los que se enfrentaban Orgel y sus contemporáneos para entender la síntesis del ARN. «El laboratorio de Szostak se centra ahora casi por completo en la forma en que el ARN primigenio podría haberse copiado a sí mismo. El ARN moderno se une de forma muy regular y predecible, con bloques de construcción de nucleótidos que encajan como una cadena. Cada bloque contiene un azúcar (ribosa), un fosfato y una de las cuatro nucleobases (también llamadas bases nitrogenadas): adenina, citosina, guanina y uracilo (normalmente llamadas A, C, G y U). Las unidades de ribosa-fosfato se unen para formar la «columna vertebral» del ARN. En las células modernas, las enzimas proteicas catalizan la reacción que une las unidades de nucleótidos para formar las cadenas de ARN.
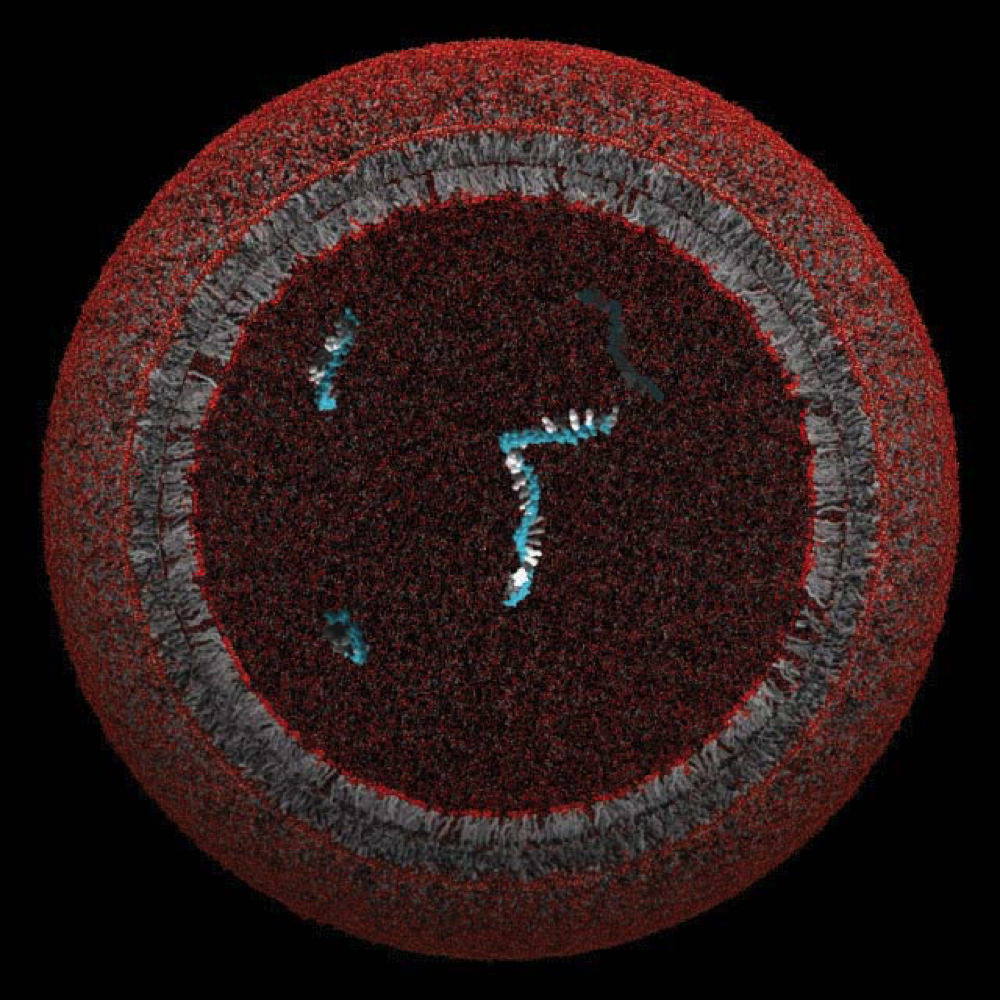
Un modelo de protocélula, cuya membrana lipídica podría haber encerrado y protegido un único gen
Imagen cortesía del Laboratorio Szostak
En las protocélulas de la Tierra primitiva, la cadena de ARN habría servido como plantilla sobre la que se ensamblaba una nueva cadena complementaria de nucleótidos antes de desprenderse para convertirse en una plantilla adicional sobre la que podían encajar otros nucleótidos que flotaban libremente. Pero, a diferencia del ARN moderno predecible, el ARN primitivo no tenía la ventaja de las proteínas para catalizar el proceso de construcción. (Dado que las proteínas no pueden formarse sin la compleja y muy evolucionada maquinaria celular necesaria para su síntesis, la mayoría de los investigadores creen que era improbable que existieran en la Tierra primigenia). El ARN primitivo, por tanto, era probablemente más desordenado, con mucha más variación en la espina dorsal del azúcar y las bases, dice Szostak. Su equipo está experimentando actualmente «para hacerse una idea de la variabilidad que se toleraría y la que se eliminaría. Nuestro modelo actual es que empiezas con algo que es desordenado y tiene muchas variaciones diferentes en él, y a lo largo de los ciclos de replicación, terminas con algo que está más cerca del ARN homogéneo moderno».
Un artículo de 2018 de Szostak y el estudiante de posgrado Seohyun Kim ilustra la posible variabilidad del ARN primitivo, y sus bloques de construcción A, C, G y U. Los científicos han avanzado en la comprensión de cómo la C y la U podrían haber sido generadas por reacciones químicas prebióticas, pero han tenido problemas con la A y la G. Szostak y Kim sugieren que el ARN puede haber comenzado con diferentes nucleobases, y sus experimentos han demostrado que el nucleósido inosina, que puede hacerse a partir de la A (adenina), funciona eficazmente en lugar de la G (guanosina). «Esto simplifica el problema general», explica Szostak. «Ahora sólo necesitamos saber cómo fabricar A.»
Otros experimentos recientes en el laboratorio se han centrado en los iones metálicos necesarios para poner en marcha el proceso de copia del ARN. Los investigadores suelen utilizar magnesio, «pero tenemos que usarlo en concentraciones muy altas», lo que tiene efectos secundarios negativos, desencadenando la degradación del ARN o la destrucción de la membrana celular. «Ojalá encontremos alguna forma sencilla y plausible de hacer que todo funcione con menos magnesio, o tal vez tengamos que replantear todo el problema y abordarlo desde una dirección diferente», explica Szostak. «Solo estamos tanteando en la oscuridad, tratando de ver dónde puede haber un camino hacia una solución».»

El calentamiento y el enfriamiento atribuibles al vulcanismo, como en el Gran Manantial Prismático de Yellowstone, habrían facilitado la evolución temprana del ARN.
Fotografía de Istock Images
Algunos de los caminos no funcionan, e incluso arrojan errores. En 2016, el laboratorio de Szostak publicó un artículo en Nature Chemistry que mostraba que un péptido podría haber ayudado a que el ARN se replicara sin enzimas. Poco después, la investigadora Tivoli Olsen se unió al laboratorio y no pudo reproducir esos hallazgos. Su revisión del artículo reveló que el equipo había interpretado mal los datos, y Szostak se retractó del artículo. «Estamos trabajando en problemas difíciles, y lo más difícil en la ciencia, como creo que dijo Feynman, es no engañarse a sí mismo», dice Szostak. La solución potencial era emocionante, «y creo que nos cegó lo que estaba pasando». La «gracia salvadora», añade, es que descubrieron los errores por sí mismos, aunque desearía que eso hubiera ocurrido «antes de que se publicara el artículo en lugar de después. Diría que muchas de nuestras ideas acaban siendo erróneas, pero normalmente nos damos cuenta bastante rápido».
Es optimista sobre el potencial de los descubrimientos recientes en otros laboratorios; por ejemplo, John Sutherland, del Laboratorio de Biología Molecular del Consejo de Investigación Médica (MRC) en Cambridge (Inglaterra), descubrió recientemente una nueva técnica para activar nucleótidos -modificando químicamente estos bloques de construcción para impulsar el proceso de replicación. Sutherland compartió estos descubrimientos con el laboratorio de Szostak antes de que fueran publicados, y Szostak dice que están explorando formas de incorporar esta técnica en sus propios experimentos.
Una vez que su equipo ensambla protocélulas que funcionan y que contienen trozos de ARN, esperan que la información de algunas secuencias específicas de ARN confiera algún beneficio a la protocélula que la rodea. Por ejemplo, trabajos anteriores sugieren que algunas secuencias de ARN podrían plegarse para convertirse en una ribozima que podría fabricar lípidos algo más avanzados para la membrana celular. «Cualquier secuencia de ARN que haga algo que ayude a sus propias células a sobrevivir o a replicarse más rápido empezará a apoderarse de la población», explica Szostak. «Ese es el comienzo de la evolución darwiniana. Y entonces volvemos a ser biólogos».
Tras ganar el Premio Nobel, Szostak podría haber dejado el laboratorio para dedicarse a los viajes y a las invitaciones a conferencias, pero «se mantiene centrado en la ciencia», dice Gerald Joyce. «Eso es lo que más admiro de él». Algunos pueden ver la investigación básica como un lujo intelectual, pero sus practicantes defienden que toda la ciencia aplicada comienza con los hallazgos de la ciencia básica. «Cuando Crick y Watson se sentaron y empezaron a hacer modelos de cartón de la estructura del ADN, no tenían ni idea de que eso daría lugar a una industria valorada en miles de millones de dólares 70 años después», señala John Sutherland.
Szostak sigue empeñado en avanzar en esas grandes y desafiantes cuestiones, continuando el trabajo de décadas. «Espero poder construir un sistema celular evolutivo antes de jubilarme», afirma. Es optimista sobre sus posibilidades. «Creo que lo estamos consiguiendo. Quedan algunos problemas difíciles, y luego creo que, con suerte, todo estará resuelto en un par de años.»