La generación de energía renovable no siempre satisface la demanda. Esto se debe a la sencilla razón de que los consumidores pueden desear utilizar la energía cuando el sol no brilla o el viento no sopla. Las baterías pueden utilizarse para equilibrar este problema de generación y demanda. Las baterías pueden cargarse cuando se genera energía y descargarse cuando se necesita.
Las baterías también pueden hacer mucho más que simplemente equilibrar la generación y la demanda de energía. Las baterías pueden ayudar en una amplia gama de aplicaciones de la red, como los servicios de respaldo, la generación de inercia sintética y la conversión de energía no síncrona en energía síncrona. Todos estos servicios son esenciales para el funcionamiento fiable de una red eléctrica.
¿Y cómo funcionan las baterías?
Las baterías tienen tres partes fundamentales:
- un electrodo positivo;
- un electrodo negativo; y
- un electrolito que separa los electrodos.
Diferentes electrodos y electrolitos producen diferentes reacciones químicas que afectan al funcionamiento de la batería. Por eso hay una gran diversidad de baterías en el mercado y en desarrollo. Las diferentes características de las baterías incluyen:
- tamaño;
- capacidad de almacenamiento;
- velocidad de respuesta;
- velocidad de recarga;
- vida útil;
- seguridad;
- costes; y
- reciclabilidad.
La batería de redox de vanadio (VRB) es una de las últimas baterías que han aparecido en el mercado comercial. Es especialmente prometedora por su gran capacidad de almacenamiento. Desde el punto de vista medioambiental, la VRB también es prometedora. El VRB no produce productos de desecho y tiene una larga vida útil. Los productos químicos de un VRB no necesitan ser sustituidos y pueden utilizarse infinitamente. Sólo habrá que sustituir la carcasa y el hardware del VRB. La larga vida útil también significa que el VRB tiene el potencial de ser una alternativa de bajo coste a otras opciones.
El VRB tiene una cámara positiva y otra negativa separadas por una membrana. La cámara positiva tiene un electrodo positivo y la cámara negativa tiene un electrodo negativo. En ambas cámaras circulan electrolitos de vanadio: – un electrolito o especie de vanadio positivo en la cámara positiva, y una especie negativa en la cámara negativa. Las cámaras están conectadas a tanques de almacenamiento para poder bombear grandes volúmenes de electrolitos de vanadio y hacerlos circular por las cámaras. La membrana impide que los electrolitos positivo y negativo se mezclen, pero permite el paso de iones (átomos con carga positiva o negativa).
Cuando el VRB se carga y se descarga, las especies de vanadio sufren simultáneamente oxidación y reducción, transfiriendo electrones a través de la membrana. La reacción de oxidación-reducción se conoce como reacción redox. La reducción implica la ganancia de electrones. La oxidación implica la pérdida de electrones. Durante la carga, el electrolito de la cámara positiva se oxida y el electrolito de la cámara negativa se reduce. Durante la descarga el proceso se invierte, y el electrolito de la cámara positiva se reduce mientras que el electrolito de la cámara negativa se oxida.
La reacción redox de carga puede utilizarse para almacenar electricidad cuando se genera y la reacción redox de descarga puede suministrar electricidad cuando se demanda. La VRB tiene una eficiencia de carga/descarga del 75% al 80%.
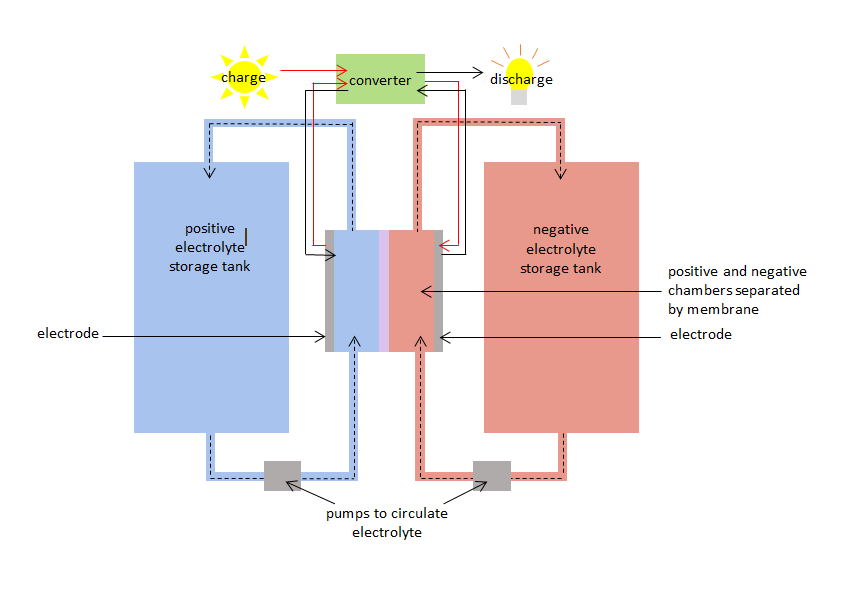
Diagrama de la batería de redox de vanadio