Las interacciones entre el cerebro y el proceso de coagulación tienen una larga historia, incluyendo la observación de que el mecanismo de coagulación dentro del sistema nervioso central tiene una serie de diferencias con el que se encuentra en otros órganos-el endotelio del cerebro expresa poca trombomodulina, por ejemplo.
Cualquiera que sea el mecanismo, es difícil evitar la observación de que el tratamiento con anticoagulación (por ejemplo, con heparina de bajo peso molecular) suele revertir drásticamente los síntomas, incluyendo la migraña, las dificultades de memoria y la corea. Tales observaciones sugieren que la patología cerebral en muchos casos podría no ser tanto un infarto, sino que podría relacionarse más con el «enlodamiento» del suministro de sangre y la alteración de la oxigenación.
Migraña &Accidente cerebrovascular
«¿Sufría de dolores de cabeza cuando era adolescente?»
«Sí, doctor. Fueron casi semanales durante un tiempo. Desaparecieron durante unos años, pero ahora han vuelto con fuerza. Son cosa de mi familia».
Así habla la paciente de 30 años con APS (los miembros masculinos de la familia aparecen con menos frecuencia en las clínicas de APS).
Esta es una pista diagnóstica tan importante en la evaluación de un paciente con posible APS. Sin embargo, a pesar de los muchos años de experiencia del APS, hay sorprendentemente pocos datos que evalúen el verdadero papel del APS en el mundo más amplio de la migraña. Hay muchas razones para estudiar la asociación: la respuesta a la anticoagulación -generalmente buena, a menudo sorprendente-, el estudio de los hermanos y otros miembros de la familia de los pacientes con migraña/APS. Y, por encima de todo, los vínculos que ahora se están comunicando entre la migraña y el ictus.
El síndrome de APS/Hughes es en gran medida una afección neurológica. La función cerebral parece ser un objetivo especial: cuantos más pacientes de APS se ven, más se extienden las ondas neuropsiquiátricas.
Al igual que la migraña, el ictus es una de las complicaciones reconocidas del APS/síndrome de Hughes. Se han notificado cifras de hasta 1 de cada 5 ictus jóvenes (menores de 45 años) con pruebas de aPL positivas.14-19
Sin embargo, al igual que con la migraña, el reconocimiento de la aPL en la etiología del ictus es, en general, todavía pobre. Por ejemplo, el ictus infantil -bien reconocido clínicamente- es un objetivo primordial para los estudios sobre los LAP.
Hace algunos años, el gobierno del Reino Unido puso en marcha una importante iniciativa sobre el ictus, educando al público sobre los síntomas, los signos y el tratamiento del mismo. El síndrome antifosfolípido no estaba en la lista.
Convulsiones
En 1985, observamos que en los pacientes con lupus, las convulsiones eran más frecuentes en aquellos pacientes con pruebas de aPL positivas.20 Desde entonces, ha quedado claro que la epilepsia, en todas sus formas, es un acompañante importante del SPA. Tanto es así, que en un estudio de epilepsia idiopática en adolescentes, 1 de cada 5 resultó ser positivo aPL.21

La revisión inicial de la matrona o del obstetra debería incluir un simple cuestionario para descartar el APS.
Image Credit: SPL/Science Source
Las ramificaciones de estas observaciones son muchas. Permítanme dar dos ejemplos clínicos:
En primer lugar, la epilepsia del lóbulo temporal en el APS puede estar infravalorada. Una de mis pacientes, una mujer con APS clásico, se convirtió en técnica de EEG. Durante su formación utilizó a cuatro de sus hermanos como conejillos de indias. Tres tenían una actividad anormal en el lóbulo temporal. Es interesante ver la frecuencia con la que los antecedentes familiares de epilepsia aparecen en la anamnesis de los pacientes con APS.
La segunda anécdota clínica se ha publicado en otro lugar.22 Una paciente de 42 años tenía antecedentes de lupus leve. Sin embargo, su principal problema -y uno con un impacto significativo en su ajetreada vida- eran las convulsiones recurrentes, tanto de pequeño mal como de gran mal, estas últimas requiriendo atención especializada y la combinación de varios medicamentos antiepilépticos. Durante su estancia en Londres, desarrolló una trombosis venosa profunda (resultó ser aPL positiva), y se inició la anticoagulación rutinaria con warfarina. Una ventaja inmediata e inesperada fue la notable reducción de la frecuencia y la gravedad de los ataques, que requirieron un tratamiento antiepiléptico mucho menos agresivo.
‘EL ESCÁNDALO DE LOS NIÑOS MUERTOS: Cada día nacen en el Reino Unido hasta tres bebés que podrían haber vivido. Uno de cada 200 nacimientos de mujeres británicas nacerá muerto. Es hora de que el NHS adapte nuevas políticas y una nueva actitud». -The Times (Londres), 28 de noviembre de 2012
Pérdida de memoria
Posiblemente la manifestación más común del SFA sea la pérdida de memoria. A menudo, el problema sólo ve la luz cuando se le pregunta al paciente por el síntoma. Por ello, muchos pacientes confiesan estar preocupados por el Alzheimer. Hasta la fecha, los estudios clínicos detallados son escasos. De vez en cuando, y, hay que decirlo, de forma bastante desordenada, hemos llevado a cabo pruebas psicométricas en pacientes seleccionados de APS, y los resultados han sido a menudo sorprendentes. Más aún, teniendo en cuenta la sorprendente mejora observada en las pruebas de memoria cuando se inicia la anticoagulación.23
Esclerosis múltiple
En vista de la prominencia de las características neurológicas, incluidas las alteraciones visuales y la mielopatía fluctuante, que se observan en el SCA, no es de extrañar que varios casos se diagnostiquen como esclerosis múltiple.24,25
El tema está lejos de ser sencillo. Algunos en neurología declaran que las pruebas de aPL positivas se ven, de hecho, a veces en la EM clásica. Yo preferiría dar la vuelta al panorama. Estos pacientes, al menos algunos, pueden ser primero APS y luego EM. Aunque anecdóticamente algunos de estos casos responden a la anticoagulación, en otros la respuesta es, en el mejor de los casos, limítrofe. Uthman ha revisado recientemente la literatura bastante sustancial sobre el APS frente a la EM.26
Otras características neurológicas
Estas incluyen problemas de equilibrio (varios casos se presentan como Meniere), corea (a veces grave),27,28 anosmia, trastornos del sueño (incluyendo cataplexia y narcolepsia) y, recientemente, trastornos autonómicos con una serie de casos de POTS (síndrome de taquicardia ortostática postural).29
Una de las cuestiones sobre las que hay debate es la prevalencia de las manifestaciones psiquiátricas.
En mi opinión, la psicosis aguda ha sido más una característica del lupus que del APS, pero en esto puedo estar equivocado. Una de mis pacientes, una mujer con APS y TOC (trastorno obsesivo compulsivo), mejoró con el tratamiento anticoagulante. Curiosamente, su hijo adolescente, también paciente con TOC (y aPL positivo), descubrió que las manifestaciones neuropsiquiátricas eran mucho menos prominentes cuando se inició el tratamiento con aspirina.
No el cerebro
Articulaciones óseas &¿Ha sufrido alguna fractura? Una pregunta que quizás no forma parte de la anamnesis rutinaria en los pacientes con APS. Y, sin embargo, la fractura ósea espontánea está siendo bien reconocida tras el informe de 27 fracturas metatarsales espontáneas del Dr. Shirish Sangle en pacientes con APS.30
Los informes anecdóticos sugieren que las fracturas óseas (isquémicas) pueden ser una manifestación importante de la enfermedad: Mi colega, el profesor Munther Khamashta, tiene un paciente con síndrome de Hughes con estudios de DEXA y paratiroides normales que ha tenido 57 fracturas espontáneas. Claramente, esta es un área importante para la investigación clínica.
Así mismo, el dolor de cadera por necrosis avascular (AVN) no es infrecuente en nuestros pacientes con APS. La resonancia magnética ha mostrado una AVN temprana en algunos casos sin otros factores de riesgo, como los esteroides. Mi impresión clínica es que el dolor de cadera suele mejorar cuando se inicia la heparina o la warfarina.
Corazón-Una de las principales preocupaciones es la presencia de angina y otros síntomas cardíacos en el APS. A pesar de unos pocos informes tempranos de isquemia miocárdica y trombosis coronaria, sólo en los últimos años han aumentado las publicaciones que revelan una alta frecuencia de estas complicaciones.
Dos ejemplos son la investigación de Greco et al que muestra una prevalencia relativamente alta de pruebas de aPL positivas en pacientes con isquemia cardíaca, y la sorprendente observación de que las mujeres fumadoras que tomaban la píldora y que eran aPL positivas tenían un riesgo relativo de 22 veces para el desarrollo de infarto de miocardio.31,32
Los vínculos cardíacos aumentan por la notificación de una asociación con el síndrome cardíaco X, angina de pecho con angiografías coronarias normales.33 Es una apuesta justa que las pruebas de aPL se convertirán en un estándar en la clínica cardiológica, especialmente en mujeres sintomáticas menores de 40 años.
Al igual que la migraña, el ictus es una de las complicaciones reconocidas del síndrome APS/Hughes. Se han notificado cifras tan elevadas como 1 de cada 5 ictus jóvenes (menores de 45 años) con pruebas de aPL positivas.
Tracto IGI &Hígado-Desde que hicimos nuestras observaciones sobre las lesiones estenóticas focales en varias arterias, incluidas las arterias celíacas y mesentéricas, nos hemos centrado más en los síntomas de angina abdominal en pacientes con aPL/APS.34 Se trata de una afección difícil de cuantificar, pero hemos visto varios casos en los que el clopidogrel o la heparina han dado lugar a una mejoría (a veces notable) del dolor postprandial.
Aunque la afectación hepática en el lupus es rara, las pruebas de función hepática anormales en el APS se observan con frecuencia. Aunque éstas pueden presagiar una trombosis hepática grave, como el síndrome de Budd-Chiari o el síndrome HELLP en el embarazo, que advierten de una inminente APS catastrófica, lo más habitual es que tengan un pronóstico más benigno.35,36
Una historia de un caso muy positivo: A principios de los años ochenta, vi a una adolescente con una TVP, un aPL positivo y el síndrome de Budd-Chiari.
¿Pronóstico pobre?
Treinta años después, sigue estando bien con una cuidadosa warfarina de por vida administrada por sus médicos en Portugal.
La enfermedad de Goldblatt, el riñón &La estenosis de la arteria renal, observada sobre un fondo claro de arterias por lo demás normales, puede imitar las primeras observaciones de Goldblatt sobre el desarrollo de la hipertensión en animales con arterias renales ocluidas experimentalmente. El descubrimiento de las lesiones localizadas de estenosis de la arteria renal por parte de Sangle condujo a hallazgos similares en otros vasos, dando lugar a teorías sobre la patología trombótica/endotelial localizada.37
Piel: livedo reticularis, un enigma-Aunque las úlceras cutáneas, las venas dilatadas y las hemorragias subungueales en astilla son secuelas bien conocidas de la trombosis cutánea en el SCA, la livedo reticularis tiene un aura de misterio.38,39
Desde el punto de vista del diagnóstico, su presencia es una pista importante en los pacientes en los que se sospecha que tienen el síndrome de Hughes, incluido el SCA seronegativo.
Al repasar algunas de las afecciones mencionadas en este artículo (esclerosis múltiple, migraña, fracturas múltiples, problemas de memoria), uno se pregunta si la observación cuidadosa de la presencia o ausencia de livedo podría resultar significativa en el diagnóstico diferencial de estas afecciones.
Una cosa es cierta: La presencia de livedo añade una dimensión adicional a la gravedad del cuadro clínico.
Embarazo
Por supuesto, el protagonista del síndrome es el embarazo, donde la tasa de éxito de los partos sanos en embarazos con aPL positivo se ha disparado de menos del 15% a más del 90%. Sin duda, el diagnóstico y el tratamiento de estos casos ha supuesto un avance significativo en el mundo de la obstetricia.40
Por desgracia, todos los que trabajamos con el APS hemos atendido a pacientes con aPL (algunas de las cuales habían sufrido abortos espontáneos tempranos) que han perdido un bebé al final del embarazo. Mortinatos.
Hace dos años, el diario The Times de Londres publicó un artículo titulado «El escándalo de los mortinatos», en el que destacaba las malas cifras de mortinatos en el Reino Unido.41 Sin embargo, algunos casos de mortinatos en las mujeres aPL-positivas podrían haberse evitado. Por ejemplo, un estudio reciente realizado en Utah descubrió que los embarazos con aPL tenían entre tres y cinco veces más probabilidades de nacer muertos.42
¿Ayudarían unas pruebas de aPL más rutinarias en el embarazo? Hay que tener en cuenta los costes. El aborto espontáneo es frecuente y existen numerosas causas. Por lo tanto, la recomendación actual es reservar las pruebas para aquellas mujeres con tres o más abortos espontáneos. Esto parece duro. Tal vez un simple proceso de cribado podría ayudar.
He sugerido que parte del cribado inicial de la comadrona o del obstetra incluya un sencillo cuestionario de tres partes:
- ¿Ha tenido usted una trombosis?
- ¿Es usted migrañosa?
- ¿Tiene usted antecedentes familiares de enfermedades autoinmunes (es decir, Estoy seguro de que un cuestionario tan sencillo podría ayudar a identificar un pequeño grupo de riesgo.
En la mayoría de los centros, una vez que la madre y el bebé son enviados a casa de forma segura, no hay un seguimiento a largo plazo. Sin embargo, a menudo, las pacientes con APS que se presentan, por ejemplo, a los 40 años con un problema trombótico, dan una historia pasada de aborto espontáneo 20 años antes. En un mundo ideal, las mujeres con abortos recurrentes merecen un seguimiento regular a largo plazo. Pero el mundo dista mucho de ser ideal.
Lupus & APS
Los primeros estudios clínicos del APS se llevaron a cabo en clínicas de lupus, y bien podrían haber incluido «características del lupus.» Tal vez sea sorprendente que el tiempo haya mostrado pocas diferencias entre el APS primario y el asociado al lupus. Sin duda, hay algunas características clásicas del lupus (por ejemplo, endocarditis de Libman Sachs, accidentes cerebrovasculares, convulsiones) que es más probable que estén relacionadas con la aPL. También parece probable que la positividad de la aPL en el lupus confiera un mayor índice de cronicidad.
El paso del tiempo también ha revelado un hallazgo positivo: Es muy inusual que los pacientes con APS primario desarrollen lupus en años posteriores.
Los 3 grandes
La asociación entre el síndrome de Hughes, el Sjögren y el hipotiroidismo es tan común que he tomado el nombre de los 3 grandes. Desde el punto de vista clínico, es una asociación importante porque los síntomas clínicos de las tres afecciones -fatiga, circulación fría, dolores y problemas de equilibrio y memoria- son comunes a las tres. Del mismo modo, muchos de estos pacientes cargan con la etiqueta de fibromialgia.
Cada uno de los tres síndromes interconectados puede responder bien al tratamiento -por ejemplo, el Sjögren clínico a la hidroxicloroquina, etc. Muchos de estos pacientes reciben mi tratamiento de dos árboles: sauce (aspirina) y quina (quinina).
APS seronegativo
Creo que uno de los beneficios del tiempo que un clínico en formación pasa en el laboratorio es el reconocimiento de que muchas pruebas de laboratorio están abiertas a la variación. Muchos, muchos estudios han intentado evaluar la importancia del título, la clase de inmunoglobulina, la triple o doble positividad, la relevancia de «otros» aPL como los anti-fosfatidil-serina, etc.43,44
En términos generales, todos ellos tienen relevancia, pero en la clínica, algunos no encajan, como aquellos pacientes con todas las características clínicas del APS cuyas pruebas de aPL siguen siendo obstinadamente negativas.
Hace algunos años, escribimos un artículo en el que introdujimos el término APS seronegativo, llamando la atención sobre los pacientes con fuertes características clínicas de APS pero con pruebas negativas.45 El concepto se remonta a los primeros días de la AR seronegativa y el lupus seronegativo, etiquetas que, aunque se basaban únicamente en la observación clínica, tenían importantes consecuencias terapéuticas y pronósticas.
Tres posibles explicaciones para el APS seronegativo son: 1) El diagnóstico es incorrecto (poco probable en todos los casos); 2) las pruebas anteriormente positivas se han vuelto negativas con el paso del tiempo (poco común en mi experiencia); o 3) se necesitan nuevas pruebas.46
Tal vez la razón más potente para tener una mente abierta sobre el APS seronegativo proviene de los estudios familiares. Hace unas semanas, vi a una pareja de gemelos idénticos, el primero con APS seropositivo clásico, que luego trajo a su hermana gemela (absolutamente) idéntica. La segunda gemela tenía un conjunto idéntico de síntomas, pero a diferencia de la primera gemela, tenía pruebas de aPL negativas. Ambos pacientes respondieron al tratamiento.
Una vez al año, celebramos una reunión de pacientes en nuestro hospital. En la última reunión, organizamos un sencillo cuestionario anónimo con dos preguntas: ¿Es usted un paciente con APS o un amigo/cónyuge? ¿Tiene algún pariente femenino cercano (hermana, madre, tía) con una enfermedad autoinmune (por ejemplo, lupus, AR, tiroides, esclerosis múltiple, APS)? El resultado: El 60% de los pacientes tenía un historial positivo de enfermedades autoinmunes en familiares cercanos. Menos del 20% de los amigos/cónyuges respondieron afirmativamente.
Puede que mi propia experiencia esté sesgada por el sesgo de remisión de las familias de los pacientes con APS, pero sean seropositivos o no, la mayoría de los pacientes con APS seronegativo responden igual de bien al tratamiento.
Si algunos de estos individuos en el estudio familiar tenían, de hecho, APS seronegativo y, sin embargo, respondían potencialmente al tratamiento, entonces las posibilidades son intrigantes. Tal vez un mayor porcentaje de nuestros pacientes con migraña, accidente cerebrovascular joven, angina de pecho joven podría beneficiarse de una mirada más cercana para más de las pistas de APS-la seca de Schirmer, la livedo, la historia familiar de la enfermedad autoinmune-por ejemplo.
Aspectos de tratamiento
En muchos sentidos, es decepcionante confesar que 30 años después, hay pocos tratamientos nuevos. La introducción de los nuevos anticoagulantes orales en el tratamiento del APS ha sido previsiblemente cautelosa, y es demasiado pronto para generalizar.47
Las estatinas, la IGIV y la hidroxiclorquina se han lanzado a la mezcla y, por supuesto, la terapia de células anti-B ha recibido anécdotas favorables. Un estudio reciente de París sugirió que el sirolimus, utilizado en el trasplante renal, podría tener un efecto protector sobre la vasculopatía inducida por la aPL.48
Así que en 2016, el tratamiento actual de la APS sigue limitándose en gran medida a la aspirina, el clopidogrel, la heparina y la warfarina.
La aspirina en dosis bajas, a pesar de sus detractores, es, por supuesto, la primera opción en muchos pacientes con APS. Sin embargo, el clopidogrel sigue siendo una alternativa útil en pacientes con gastritis o en asmáticos. Pero existe un tercer papel para el clopidogrel -importante en el mundo real de la medicina práctica-, es decir, en aquellos pacientes que, por la razón que sea, han probado la aspirina, sin un beneficio claro.
Heparina: la heparina de bajo peso molecular ha sustituido en gran medida, en la mayoría de los países, a la antigua heparina, y con ella han desaparecido en gran medida los temores de trombocitopenia y osteoporosis. Este es un punto importante, ya que muchos médicos son reacios a prolongar el uso de la heparina.
Dos observaciones: En primer lugar, un número de pacientes mejoran drásticamente con la heparina, sólo para sentirse menos bien con la warfarina.
¿Dónde ir ahora? Cuando los problemas de dosificación, la resistencia a la warfarina y el cumplimiento están (esperemos) descartados, una opción inmediata es volver temporalmente a la heparina. En algunos casos, lo temporal se ha convertido en semilargo. En nuestra clínica de APS tenemos un par de docenas de estos pacientes que, por elección, han permanecido con heparina subcutánea durante dos años o más. Sí, han experimentado hematomas, pero hasta ahora, no hemos visto un empeoramiento de las exploraciones DEXA.
La segunda observación (y muy clínica) se refiere a un ensayo de heparina. Es una observación habitual que las pacientes con aPL/APS que reciben heparina durante el embarazo no suelen tener dolores de cabeza durante los ocho o nueve meses completos. Esto nos llevó a desarrollar una herramienta clínica, un ensayo terapéutico que nos ha servido de ayuda. El ensayo es un curso de tres o cuatro semanas de heparina LMW.49
Permítanme dar un ejemplo de su uso: En el paciente con aPL/APS con cefaleas cada vez más graves a pesar de la aspirina/clopidogrel (y con una resonancia magnética cerebral normal), un ensayo de 10.000 unidades de dalteparina (o enoxaparina) durante tres o cuatro semanas puede lograr resultados sustanciales. En primer lugar, puede dar una indicación sorprendentemente clara de si la anticoagulación es el camino correcto. En segundo lugar, en el paciente traumatizado que ha seguido el camino conocido de múltiples consultas a especialistas, con un éxito clínico marginal, puede ser un punto de inflexión importante, el primer signo palpable de mejora.
Warfarina: hay poco que decir sobre la warfarina. Ha sido vilipendiada por los medios de comunicación, pero sigue siendo uno de los medicamentos más útiles de nuestro arsenal. La warfarina, para decirlo en términos sencillos, protege contra los accidentes cerebrovasculares y los infartos de miocardio en el SCA.
Se ha mencionado la necesidad frecuente de un INR más alto en muchos pacientes con SCA, especialmente en aquellos con características neurológicas. Soy un firme partidario del uso de máquinas de autodiagnóstico del INR siempre que sea posible en nuestros pacientes.
Lamentablemente, algunas clínicas de anticoagulantes se oponen al uso de máquinas de autodiagnóstico. Para mí, esto es un error. Fíjese en la libertad que ha alcanzado el autodiagnóstico para los diabéticos insulinodependientes.
Como médicos, creo que tenemos el deber (hasta que se establezcan anticoagulantes mejores y más nuevos) de apoyar la warfarina como un medicamento ampliamente seguro y eficaz que ha salvado muchos miles de vidas.
En 2015, el tratamiento actual del síndrome de Hughes sigue limitándose en gran medida a la aspirina, el clopidogrel, la heparina &la warfarina.
Miscelánea
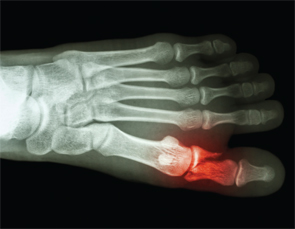
La fractura ósea espontánea está siendo bien reconocida tras el informe de 27 fracturas metatarsales espontáneas del Dr. Shirish Sangle en pacientes con APS.
Image Credit: Puwadol Jaturawutthichai/.comLa familia-No es ninguna sorpresa que los antecedentes familiares sean una pista importante en el síndrome de Hughes. Las enfermedades autoinmunes (especialmente las tiroideas) aparecen regularmente como diagnóstico en los familiares de nuestros pacientes. Pero, ¿con qué frecuencia se diagnostican estos casos familiares? Los ejemplos podrían incluir a la hija de 17 años de un paciente con APS que sufre de dolor de cabeza y fiebre glandular, el hermano con esclerosis múltiple o la madre y la tía de un paciente con APS recién diagnosticado que sufrió un accidente cerebrovascular a principios de los 40 años.
No es inconcebible que el APS haya cambiado el curso de la historia, como en el caso reportado por mi amigo, el Dr. Gerald Weissmann, de la reina Ana de Inglaterra que tuvo 17 embarazos fallidos y murió sin hijos, poniendo así fin al reinado de los Estuardo y el inicio de los Hannoverianos, con Jorge III, los impuestos de las colonias americanas, la revolución y el nacimiento de los EE.UU.50
La descendencia-Hasta la fecha, la mayoría de los estudios han sugerido que la descendencia de madres aPL-positivas no tiene efectos adversos importantes (aparte de, tal vez, el desarrollo posterior de rasgos hereditarios de APS en algunos). Sin embargo, algunos informes de casos preocupantes de problemas fetales y neonatales indican la necesidad de realizar más estudios. Los estudios en curso de las doctoras Anne Parke, Angela Tincani, Maria Claire Boffa y otros proporcionarán, con el tiempo, algunos de estos datos que faltan.51,52
Clasificación frente a diagnóstico-
Estimado doctor, le agradecería que me aconsejara sobre esta paciente. Ha desarrollado una trombosis con la píldora anticonceptiva oral. Ha tenido una prueba positiva de aPL, pero no se repitió la prueba 12 semanas después.Como en el caso del lupus, los criterios de clasificación se confunden a veces con el diagnóstico. Muchos pacientes no se someten a pruebas con «12 semanas de diferencia» (este criterio se introdujo para cubrir el riesgo de que una infección intercurrente pudiera haber provocado un resultado positivo transitorio en la prueba de aPL, lo cual no fue un factor importante en nuestra evaluación de este paciente).
También hay consideraciones financieras, como en el siguiente estudio de Beirut, Líbano.
«Sólo el 50,5% se sometió a pruebas tanto de aCL como de LA. … El coste de cada prueba era de unos 50 dólares para el paciente. … Queda por ver si los costes de las pruebas pueden explicar en parte el escaso porcentaje de pacientes que se sometieron a una prueba confirmatoria de seguimiento».
El paso del tiempo también ha revelado un hallazgo positivo: Es muy poco habitual que los pacientes con APS primario desarrollen lupus en años posteriores.
El reconocimiento de las numerosas manifestaciones no trombóticas del APS ha aumentado la importancia de separar el diagnóstico de la clasificación. Tal vez, los avances del laboratorio en la medición de los posibles marcadores de riesgo vengan, con el tiempo, en nuestra ayuda.44
Miedo a volar: esta anécdota clínica aparece regularmente en mi clínica. Tanto es así que creo que necesita un estudio más profundo. Algunos de mis pacientes con APS, sobre todo antes de iniciar el tratamiento, sufren un prolongado jet lag después de un vuelo de larga distancia, con fatiga, dolor de cabeza y confusión, que a veces dura días.
Interesantemente, una vez que se inicia con éxito el tratamiento con heparina o warfarina, este fenómeno desaparece. No se sabe si estos síntomas se relacionan con una hipoxia cerebral leve en segundo lugar con una presión de cabina ligeramente reducida. No obstante, algunos de mis pacientes con APS complementan su tratamiento con aspirina antes de un vuelo de larga distancia con una inyección de heparina LMW. Aunque el efecto placebo puede ser considerable, estoy lo suficientemente impresionado por la experiencia clínica de estos pacientes (observadores) como para creer que el fenómeno del jet lag prolongado en muchos de nuestros pacientes es muy real.
El futuro-En el 14º Congreso Internacional de Anticuerpos Antifosfolípidos celebrado en Río de Janeiro en 2013, me pidieron mis predicciones sobre el futuro del SFA.23 En resumen, creo que:
- Las pruebas de APS se convertirán en algo mundial y rutinario;
- Los kits de pruebas de APS de venta libre estarán disponibles;
- Un subgrupo sustancial de enfermos de migraña tendrá una nueva esperanza;
- Se reconocerá que el SAF es el principal vínculo entre la migraña y el accidente cerebrovascular;
- Se reducirán los ataques de corazón en las mujeres jóvenes (especialmente las menores de 45 años);
- Se reducirán los accidentes cerebrovasculares en los menores de 45 años;
- Se reconocerá que algunos casos de enfermedad arterial acelerada están asociados a la aPL (no tratada);
- Algunos casos de pérdida de memoria son tratables;
- La aPL seguirá teniendo un profundo efecto en nuestra evaluación clínica y en el tratamiento del lupus; y
- Por último, volviendo al tema inicial, se reducirá la incidencia de nacimientos de niños muertos, gracias, en parte, a un enfoque más proactivo de las pruebas de aPL en el embarazo.
Para repetir una frase tomada del artículo de 1983:1
Para aquellos de nosotros endurecidos en el nihilismo por años de estudio de varios autoanticuerpos en el LES, hay una rara sensación de emoción por las implicaciones de las asociaciones que ahora se reportan.
Treinta años después, ese entusiasmo clínico no ha disminuido.
 Graham R.V. Hughes, MD, FRCP, es un reumatólogo consultor y director del Centro de Lupus de Londres. Se formó en el Hospital de Londres y pasó dos años en Nueva York trabajando en la introducción de la prueba de unión al ADN, bajo la dirección del Dr. Charles Christian. En 1971, abrió una clínica especializada en Londres que se ocupa exclusivamente del lupus y las enfermedades relacionadas. Es fundador y editor de la revista internacional Lupus. En 1983, describió el síndrome antifosfolípido y, en 1991, recibió el premio ILAR (investigación mundial) por este trabajo. Otros honores incluyen el de Doctor Honoris Causa en las Universidades de Marsella y Barcelona, y el de Maestro de la ACR.
Graham R.V. Hughes, MD, FRCP, es un reumatólogo consultor y director del Centro de Lupus de Londres. Se formó en el Hospital de Londres y pasó dos años en Nueva York trabajando en la introducción de la prueba de unión al ADN, bajo la dirección del Dr. Charles Christian. En 1971, abrió una clínica especializada en Londres que se ocupa exclusivamente del lupus y las enfermedades relacionadas. Es fundador y editor de la revista internacional Lupus. En 1983, describió el síndrome antifosfolípido y, en 1991, recibió el premio ILAR (investigación mundial) por este trabajo. Otros honores incluyen el de Doctor Honoris Causa en las Universidades de Marsella y Barcelona, y el de Maestro de la ACR.- Hughes GR. Trombosis, aborto, enfermedad cerebral y el anticoagulante lúpico. Br Med J (Clin Res Ed). 1983 Oct 15;287(6399):1088-1089.
- Harris EN, Gharavi AE, Boey ML, et al. Anticardiolipina en anticuerpos: Detección por radioinmunoanálisis y asociación con la trombosis en el LES. Lancet. 1983 Nov 26;2(8361):1211-1214.
- Boey ML, Colaco CB, Gharavi AE, et al. Thrombosis in SLE: Striking association with the presence of circulating lupus anticoagulant. Br Med J (Clin Res Ed). 1983 Oct 8;287:1021-1023.
- Hughes GR. La oración de Prosser White 1983: Las enfermedades del tejido conectivo y la piel. Clin Exp Dermatol. 1984 Nov;9(6):535-544.
- Asherson RA, Mackworth-Young CG, Boey ML, Hughes GRV. Pulmonary hypertension in systemic lupus erythematosus. Br Med J (Clin Res Ed). 1983 Oct 8;287(6398):1024-1025.
- Derue GJ, Englert HJ, Harris EN, et al. Fetal loss in systemic lupus: Asociación con anticuerpos anticardiolipina. J Obstet Gynaecol. 1985;5(4):207-209.
- Hughes GR, Harris NN, Gharavi AE. El síndrome anticardiolipina. J Rheumatol. 1986 Jun;13(3):486-489.
- Hughes GR. El síndrome de Hughes: The anticardiolipin syndrome. Una visión histórica. Lupus. 1998;7 Suppl 2:S1-S4.
- Carecchio M, Cantello R, Comi C. Revisando el mecanismo molecular en el síndrome antifosfolípido: Más allá del daño vascular. J Immunol Res. 2014;2014:239398.
- Bluestein HG, Zvaifler NJ. Anticuerpos linfocitotóxicos reactivos al cerebro en el suero de pacientes con LES. J Clin Invest. 1976 Feb;57(2):509-516.
- Bresnihan B, Oliver N, Grigor R, Hughes GR. Brain-reactivity of lymphocytotoxic anitibodies in systemic lupus erythematosus with and without cerebral involvement. Clin Exp Immunol. 1977 Dec;30(3):333-337.
- Bresnihan B, Hohmeister R, Cutting J, et al. The neuropsychiatric disorder in SLE: Evidence for both vascular and immune mechanisms. Ann Rheum Dis. 1979 Aug;38(4):301-306.
- Denburg SD, Behmann SA, Carbotte RM, et al. Lymphocyte antigens in neuropsychiatric systemic lupus erythematosus. Relación de las especificidades de los anticuerpos linfocíticos con la enfermedad clínica. Arthritis Rheum. 1994 Mar;37(3):369-375.
- Harris EN, Gharavi AE, Asherson RA, et al. Cerebral infarction in SLE. Asociación con anticuerpos anticardiolipina. Clin Exp Rheumatol. 1984 Jan-Mar;2(1):47-51.
- Navarrete MG, Brey RL, Levine SR. «Cerebral disease in the antiphospholipid syndrome» en Hughes Syndrome-Antiphospholipid Syndrome. Khamashta MA, ed. Springer, Londres: 2000.
- Sanna G, Bertolaccini ML, Cuadrado MJ, et al. Central nervous system involvement in the antiphospholipid (Hughes) syndrome. Rheumatology (Oxford). 2003 Feb;42(2):200-213.
- Etminan M, Takkouche B, Isorna FC, Samii A. Risk of ischaemic stroke in people with migraine: Revisión sistémica y meta-análisis de estudios observacionales. BMJ. 2005 Jan 8;330(7482):63.
- Nencini P, Baruffi MC, Abbate R, et al. Anticoagulante lúpico y anticardiolipina en adultos jóvenes con isquemia cerebral. Stroke. 1992 Feb;23(2):189-193.
- Hughes GR. Síndrome antifosfolípido, migraña y accidente cerebrovascular. Lupus. 2010 Apr;19(5):555-556.
- Mackworth-Young CG, Hughes GR. Epilepsia: Un síntoma temprano del lupus eritematoso sistémico. J Neurol Neurosurg Psychiatry. 1985 Feb;48(2):185.
- Cimaz R, Meroni PL, Shoenfeld Y. Epilepsy as part of systemic lupus erythematosus and systemic antiphospholipid syndrome (Hughes syndrome). Lupus. 2006;15(4):191-194.
- Hughes GR. «Epilepsia diplomática» en Understanding Hughes Syndrome. Springer-Verlag, Londres: 2009.
- Hughes GR. Hughes syndrome/APS. 30 años después, ¿qué hemos aprendido? Charla de apertura en el 14º Congreso Internacional de anticuerpos antifosfolípidos. Río de Janeiro, octubre de 2013. Lupus. 2014;23:400-406.
- Cuadrado MJ, Khamashta MA, Ballesteros A, et al. ¿Se pueden distinguir las manifestaciones neurológicas del síndrome de Hughes (antifosfolípido) de la esclerosis múltiple? Análisis de 27 pacientes y revisión de la literatura. Medicine (Baltimore). 2000 Jan;79(1):57-68.
- Hughes GR. Migraña, pérdida de memoria y «esclerosis múltiple». Características neurológicas del síndrome antifosfolípido (de Hughes). Postgrad Med J. 2003 Feb;79(928):81-83.
- Uthman I, Noureldine MH, Berjawi A, et al. Hughes syndrome and multiple sclerosis. Lupus. 2015 Feb;24(2):115-121.
- Cervera R, Asherson RA, Font J, et al. Chorea in the antiphospholipid syndrome. Características clínicas, radiológicas e inmunológicas de 50 pacientes de nuestra clínica y de la literatura reciente. Medicine (Baltimore). 1997 May;76(3):203-212.
- Baizabal-Carvallo JF, Bonnet C, Jankovic J. Movement disorders in systemic lupus erythematosus and the antiphospholipid syndrome. J Neural Transm (Viena). 2013 Nov;120(11):1579-1589.
- Schofield JR, Blitshteyn S, Shoenfeld Y, et al. Postural tachycardia syndrome (POTS) and other autonomic disorders in antiphospholipid (Hughes) syndrome (APS). Lupus. 2014 Jun;23(7):697-702.
- Sangle S, D’Cruz DP, Khamashta MA, et al. Anticuerpos antifosfolípidos, lupus eritematoso sistémico y fracturas metatarsales no traumáticas. Ann Rheum Dis. 2004 Oct;63(10):1241-1243.
- Greco TP1, Conti-Kelly AM, Greco T Jr., et al. Newer antiphospholipid antibodies predict adverse outcomes in patients with acute coronary syndrome. Am J Clin Pathol. 2009 Oct;132(4):613-620.
- Urbanus RT, Siegerink B, Roest M, et al. Antiphospholipid antibodies and risk of myocardial infarction and ischaemic stroke in young women in the RATIO study: A case-control study. Lancet Neurol. 2009 Nov;8(11):998-1005.
- Nair S, Khamashta MA, Hughes GR. Síndrome X y síndrome de Hughes. Lupus. 2002;11(5):332.
- Sangle SR, Jan W, Lau IS, et al. Estenosis de la arteria celíaca y síndrome antifosfolípido (Hughes)/anticuerpos antifosfolípidos. Clin Exp Rheumatol. 2006 May-Jun;24(3):349.
- Mackworth-Young CG, Melia WM, Harris EN, et al. The Budd-Chiari syndrome. Posible papel patogénico de los anticuerpos antifosfolípidos. J Hepatol. 1986;3(1):83-86.
- Hanouna G, Morel N, Le Thi Huong D, et al. Catastrophic antiphospholipid syndrome and pregnancy: Una experiencia de 13 casos. Reumatología (Oxford). 2013 Sep;52(9):1635-1641.
- Sangle SR, D’Cruz DP, Jan W, et al. Estenosis de la arteria renal en el síndrome antifosfolípido (Hughes) e hipertensión. Ann Rheum Dis. 2003 Oct;62(10):999-1002.
- Englert HJ, Loizou S, Derue GG, et al. Clinical and Immunological features of livedo reticularis in lupus. Am J Med. 1989 Oct;87(4):408-410.
- Sangle SR, D’Cruz DP. Livedo reticularis: Un enigma. Isr Med Assoc J. 2015 Feb;17(2):104-107.
- Ateka-Barrutia O, Khamashta MA. El reto del embarazo en pacientes con LES. Lupus. 2013 Oct;22(12):1295-1308.
- Hughes GR. El escándalo de los mortinatos. Lupus. 2013 Jul;22(8):759-760.
- Silver RM, Parker CB, Reddy UM, et al. Antiphospholipid antibodies in stillbirth. Obstet Gynecol. 2013 Sep;122(3):641-657.
- Rodríguez-García JL, Bertolaccini ML, Cuadrado MJ, et al. Manifestaciones clínicas del síndrome antifosfolípido (SAF) con y sin anticuerpos antifosfolípidos (el llamado ‘SAF seronegativo’). Ann Rheum Dis. 2012 Feb;71(2):242-244.
- Meroni PL, Chighizab CB, Rovelli F, et al. Antiphospholipid syndrome in 2014: Más manifestaciones clínicas, nuevos actores patogénicos y biomarcadores emergentes. Arthritis Res Ther. 2014;16(2):209.
- Hughes GR, Khamashta MA. Síndrome antifosfolípido seronegativo. Ann Rheum Dis. 2003 Dec;62(12):1127.
- Rodguez-Garcia JL, Bertolaccini ML, Cuadrado MJ, et al. Manifestaciones clínicas del síndrome antifosfolípido (SAF) con y sin anticuerpos antifosfolípidos. Ann Rheum Dis. 2012 Feb;71(2):242-244.
- Giles I, Khamashta M, D’Cruz D, et al. Un nuevo amanecer de la anticoagulación para pacientes con síndrome antifosfolípido. Lupus. 2012 Oct;21(12):1263-1265.
- Canuad G, Bienaimé C, Taborin F, et al. Inhibición de la vía mTORC en el síndrome antifosfolípido. New Eng J Med. 2014 Jul 24;371(4):303-312.
- Hughes GR. Heparina, anticuerpos antifosfolípidos y el cerebro. Lupus. 2012 Sep;21(10):1039-1040.
- Weissmann G. Queen Anne’s lupus: Los fosfolípidos y el curso del imperio. FASEB J. 2014 Apr;28(4):1527-1530.
- Mekinian A, Lachassinne E, Nicaise-Roland P, et al. European registry of babies born to mothers with antiphospholipid syndrome. Ann Rheum Dis. 2013 Feb;72(2):217-222.
- Nalli C, Iodice A, Andreoti L, et al. Niños nacidos de madres con LES y APS. Lupus. 2014 Oct;23(12):1246-1248.
- Major S, Pashayan N, Atweh S, et al. Patrones de práctica del síndrome antifosfolípido en un hospital universitario terciario del Líbano. Lupus. 2002;11(11):759–764.