INTRODUCCIÓN
Las contracciones ventriculares prematuras (PVC) originadas en el tracto de salida del ventrículo derecho (TSVD) suelen aparecer en pacientes sin cardiopatía estructural. Pueden presentarse en forma de PVC aislada o incesante, o como taquicardia (hasta el 80% de las taquicardias ventriculares idiopáticas). El principal mecanismo causal es la actividad desencadenada, pero también se han postulado mecanismos de reentrada o automatismo anormal.
Los pacientes suelen presentar síntomas asociados al ejercicio, el estrés o el uso de estimulantes. Los síntomas pueden afectar a la calidad de vida y el tipo de EV incesante puede conducir a una taquicardiopatía.
Los bloqueadores beta o el verapamilo suelen mostrar una eficacia limitada en el control de este tipo de PVC. La ablación por radiofrecuencia puede ser eficaz, pero se ve obstaculizada por el hecho de que esta PVC tiene una inducibilidad limitada e impredecible. Los métodos convencionales guiados por fluoroscopia pueden tener una utilidad limitada si los PVC son escasos, porque el mapeo de la activación es complejo y el mapeo de la estimulación tiene una baja resolución espacial.
Los sistemas de mapeo sin contacto (NCMS) han demostrado ser útiles para localizar los latidos ectópicos y como guía en su ablación.1, 2 En este trabajo describimos la ablación de los PVC del TSVD utilizando el Ensite Array NCMS (St. Jude Medical, St. Paul, Minnesota, Estados Unidos). Este sistema utiliza un catéter de matriz multielectrodo (MAC) con un balón de 7,5 ml y 64 microelectrodos para localizar la taquicardia. El MAC proporciona más de 3000 electrogramas virtuales unipolares simultáneamente de un solo latido y los muestra en una imagen tridimensional de la cámara de interés.
MÉTODOS Características de los pacientes
Cuatro pacientes sin cardiopatía estructural pero con PVC sintomático incesante en el TSVD fueron sometidos a ablación mediante NCMS entre enero de 2006 y diciembre de 2009. La edad media de los pacientes era de 43±6 años y el 50% eran varones.
Todos tenían una mala calidad de vida debido a una PVC muy sintomática y frecuente (media, 30 763±4710 PVC / día). Todos habían fracasado con al menos 2 fármacos antiarrítmicos, uno de los cuales era siempre un betabloqueante. La ablación se había intentado previamente en 2 de los pacientes con un sistema convencional, pero sin éxito.
En todos los pacientes, la actividad extrasistólica era escasa el día del procedimiento. Se suspendieron los fármacos antiarrítmicos al menos 5 semividas antes del procedimiento y se evitó la sedación.
Estudio electrofisiológico
Se colocó un catéter de ablación de 4 mm (Livewire TC, St. Jude Medical) en el ventrículo derecho (VD). Si, tras la infusión de isoproterenol y la estimulación ventricular, no era posible conseguir una PVC suficiente para realizar el mapeo de activación, se introducía el MAC.
El MAC se avanzó sobre una guía de 0,035″ mediante fluoroscopia y el balón se colocó en el TSVD a 2 o 3 cm de la válvula pulmonar. En este punto se inició la anticoagulación con heparina. A continuación se reconstruyó la anatomía del VD, prestando especial atención al TSVD y a la situación de la válvula pulmonar (figura 1). Una distancia de
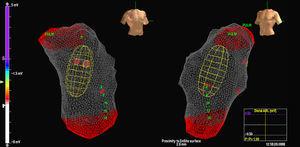
Figura 1. Imagen del catéter de matriz multielectrodo en el tracto de salida del ventrículo derecho.
Se analizaron posteriormente 3 latidos extrasistólicos por cada morfología de PVC que presentaba el paciente y se obtuvieron mapas de isopotenciales e isocronas offline. Se utilizaron filtros de 30 a 500 Hz para los electrogramas bipolares y un filtro de paso alto de 2 Hz con los electrogramas unipolares virtuales.
El mapa isopotencial representa dinámicamente la activación utilizando áreas de máxima amplitud de voltaje y muestra cómo se desplaza el frente de onda. El punto de activación más temprano se define como el punto que muestra la activación más temprana con respecto al inicio del QRS y muestra una morfología de QS con una rápida desviación negativa en el electrograma unipolar. El mapa isopotencial también identifica el punto de inicio del frente de onda antes de que se extienda al resto del miocardio. El mapa isocrono es un mapa convencional del tiempo de activación de la superficie endocárdica, y utiliza una señal unipolar virtual.
El objetivo de la ablación era tanto la zona de activación más temprana como el punto de inicio del frente de activación. La radiofrecuencia se aplicó ocasionalmente en estos lugares, con un control de temperatura limitado a 50W, temperaturas inferiores a 55°C y una duración de 60s. Se consideró que la ablación tenía éxito si el PVC desaparecía durante la aplicación y no se volvía a inducir.
Todos los procedimientos fueron realizados por el mismo electrofisiólogo, que dirigía al ingeniero que operaba el NCMS.
RESULTADOS
Tres pacientes tenían una única morfología de PVC, mientras que un paciente tenía 2 morfologías. En 3 casos, la localización fue septal mientras que en los otros 2 casos fue en la pared libre del RVOT. En todos los casos, fue el mapa isopotencial (figura 2) el que localizó con mayor precisión el foco originario; el mapa de isocronas tuvo relativamente poco valor (figura 3).
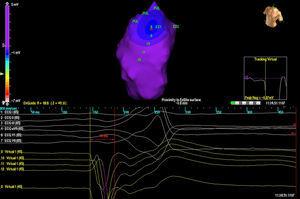
Figura 2. Mapa isopotencial en un paciente con 2 extrasístoles ventriculares diferentes originadas en el tracto de salida del ventrículo derecho. Cada salida está representada por las letras EX (1 y 2). El punto de activación más precoz se muestra en EX1, con la imagen de QS en las unipolares virtuales (abajo).
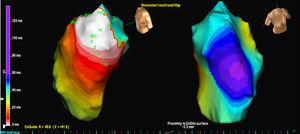
Figura 3. Mapa isócrono de la salida EX1 para las mismas extrasístoles ventriculares analizadas en la Figura 1 . El blanco indica la activación más temprana y el púrpura la más tardía.
También confirmamos en todos los casos que el PVC no era de causa mecánica y que coincidía con la morfología del PVC clínico. En un paciente, el balón estaba muy cerca de la superficie endocárdica donde se originó la PVC y tuvo que ser reposicionado para permitir una adecuada movilización del electrocatéter de ablación.
Una vez identificado el lugar de origen, se utilizó una media de 3 aplicaciones de radiofrecuencia por foco para ablacionar tanto el punto de activación más temprana como el punto de inicio del frente de activación. El tiempo medio de aplicación fue de 113±15s para cada foco. Se observó un aumento de la actividad ectópica que precedía a la terminación de la aplicación.
El tiempo medio de fluoroscopia fue de 31±11 (21-46) min y el tiempo total del procedimiento fue de 136±38min, aunque éste disminuyó a lo largo de la curva de aprendizaje, de 190min para el primer procedimiento a 100min para el cuarto.
Alcanzamos una tasa de éxito agudo del 100% sin complicaciones y sin reaparición de PVC con infusión de isoproterenol o repetición del protocolo de estimulación. Tras una media de 30±16 meses, los pacientes permanecieron asintomáticos sin tratamiento farmacológico, y en la monitorización Holter en la visita de seguimiento de 1 año el número medio de PVC fue de 159±113/día.
DISCUSIÓN
Aunque otros autores han demostrado la utilidad de la NCMS para ablacionar el PVC del TSVD,2, 3 su uso no está generalizado.4 En nuestra experiencia se consiguieron excelentes resultados desde los primeros casos. Habitualmente, se han descrito tasas de éxito superiores al 80% en la ablación de taquicardias ventriculares del TSVD5; sin embargo, nosotros conseguimos una tasa de éxito superior a pesar de que sólo pudimos mapear el PVC aislado. Nuestro criterio de valoración agudo fue la desaparición de la PVC, y estuvo limitado por la baja frecuencia de PVC durante el procedimiento. Esto hizo necesario confirmar la eficacia de la ablación durante el seguimiento mediante la disminución de la frecuencia de PVC en la monitorización Holter.
La arritmia en nuestros pacientes tuvo un origen focal, lo que coincide con las observaciones de otros autores.2, 6 La ablación se limitó al punto de activación más temprano, lo que puede haber contribuido a la alta tasa de éxito.
El NCMS sólo requirió un único latido para localizar con precisión el origen de la PVC. Aunque preferimos confirmar la localización mediante el mapeo de otros PVC idénticos, el lugar de origen no se modificó. En nuestra experiencia, el éxito de la ablación se consiguió basándose únicamente en el mapa isopotencial.
Una de las limitaciones del sistema es que localiza el punto de activación más temprano en el endocardio de la cámara explorada, incluso cuando el punto no se encuentra en el endocardio, sino en el epicardio o en otra cámara anexa. En estos casos, el análisis unipolar virtual ayuda a indicar que el origen no está en el endocardio del VD, ya que en ese caso el punto endocárdico más precoz presentaría un rS.
Además, el MAC puede producir PVC mecánico y, al estar localizado en el RVOT, puede confundirse con el PVC clínico. Para diferenciarlo, analizamos la correspondencia electrocardiográfica con la PVC clínica y confirmamos que el punto de origen de la PVC no estaba en contacto con el balón.
La PVC también puede originarse muy cerca de donde se encuentra la MAC, impidiendo así el acceso al catéter de ablación. En estos casos, puede ser necesario reposicionar el balón.
En nuestra serie, el NCMS demostró ser un medio eficaz y seguro para eliminar el PVC del TSVD aislado y difícil de inducir y ayudó a reducir la complejidad de los procedimientos implicados.
CONFLICTOS DE INTERÉS
Ninguno declarado.
Agradecimientos
Deseamos agradecer a Joaquín Panduro su revisión crítica del manuscrito.
Recibido el 21 de enero de 2011
Aceptado el 1 de mayo de 2011