Electrones de núcleo y de valencia
A medida que continuamos a través de la tabla periódica de esta manera, escribiendo las configuraciones de electrones de átomos cada vez más grandes, se vuelve tedioso seguir copiando las configuraciones de las subcubiertas interiores llenas. En la práctica, los químicos simplifican la notación utilizando un símbolo de gas noble entre corchetes para representar la configuración del gas noble de la fila anterior, ya que todos los orbitales de un gas noble están llenos. Por ejemplo, representa la configuración electrónica 1s2 2s2 2p6 del neón (Z = 10), por lo que la configuración electrónica del sodio, con Z = 11, que es 1s2 2s2 2p6 3s1, se escribe como 3s1
| Configuración electrónica completa | Declaración abreviada del gas Nobel | ||
| Neón | Z = 10 | Ne: 1s2 2s2 2p6 | Ne: 2s2 2p6 |
| Sodio | Z = 11 |
Na: 1s2 2s2 2p6 3s1 |
Na: 3s1 |
Los electrones de los orbitales interiores llenos están más cerca del núcleo y más unidos a él, por lo que raramente participan en las reacciones químicas. Los llamaremos electrones del núcleo. Para los elementos representativos (columnas 1, 2 y 13-18 de la Tabla Periódica), los electrones del núcleo son todos los electrones con un valor n inferior al valor n máximo de la configuración electrónica. Por ejemplo, en el átomo de sodio el valor n más alto es 3. Por lo tanto, los electrones del núcleo son los de los orbitales atómicos con n < 3, es decir, los de los orbitales 1s, 2s y 2p. Por lo tanto, el sodio tiene 10 electrones centrales. Más adelante volveremos a revisar esta definición de electrones del núcleo para los metales de transición.
Esto significa que la química de un átomo depende sobre todo de los electrones de su capa más externa, los de mayor valor n, que se denominan electrones de valencia. La notación simplificada nos permite ver más fácilmente la configuración de los electrones de valencia. Utilizando esta notación para comparar las configuraciones electrónicas del sodio y del litio, tenemos:
| Sodio | 1s2 2s2 2p6 3s1 | 3s1 |
| Litio | 1s2 2s1 | 2s1 |
Es evidente que tanto el sodio como el litio tienen un electrón s en su capa de valencia. Por lo tanto, podríamos predecir que el sodio y el litio tienen una química muy similar, lo cual es efectivamente el caso.
A medida que continuamos construyendo los ocho elementos del período 3, los orbitales 3s y 3p se llenan, un electrón a la vez. Esta fila concluye con el gas noble argón, que tiene la configuración electrónica 3s2 3p6, correspondiente a una capa de valencia llena.
Ejemplo 2.2.2
Dibuje un diagrama de orbitales y utilícelo para obtener la configuración electrónica del fósforo, Z = 15. ¿Cuál es su configuración electrónica? ¿Cuál es su configuración de electrones de valencia?
Dado: número atómico
Se pide: diagrama orbital y configuración de electrones de valencia para el fósforo
Estrategia:
- Localice el gas noble más cercano que precede al fósforo en la tabla periódica. A continuación, reste su número de electrones a los del fósforo para obtener el número de electrones de valencia del fósforo.
- Refiriéndose a la figura 2.1.1, dibuje un diagrama de orbitales para representar esos orbitales de valencia. Siguiendo la regla de Hund, coloque los electrones de valencia en los orbitales disponibles, empezando por el orbital de menor energía. Escribe la configuración de electrones de tu diagrama orbital.
- Ignora los orbitales interiores (los que corresponden a la configuración de electrones del gas noble más cercano) y escribe la configuración de electrones de valencia para el fósforo.
Solución:
A Como el fósforo está en la tercera fila de la tabla periódica, sabemos que tiene una capa cerrada con 10 electrones. Comenzamos restando 10 electrones de los 15 del fósforo.
B Los cinco electrones adicionales se colocan en los siguientes orbitales disponibles, que la Figura 2.1.1 nos dice que son los orbitales 3s y 3p:
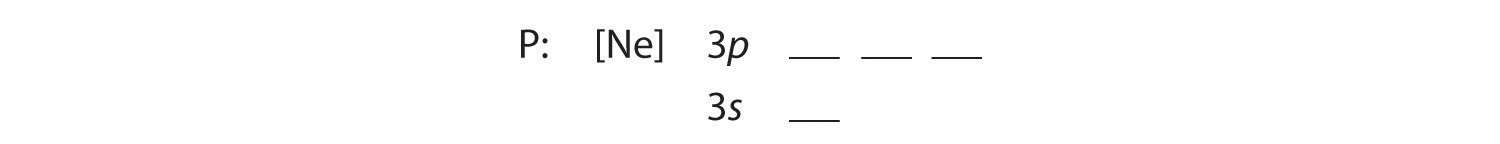
Debido a que el orbital 3s es más bajo en energía que los orbitales 3p, lo llenamos primero:
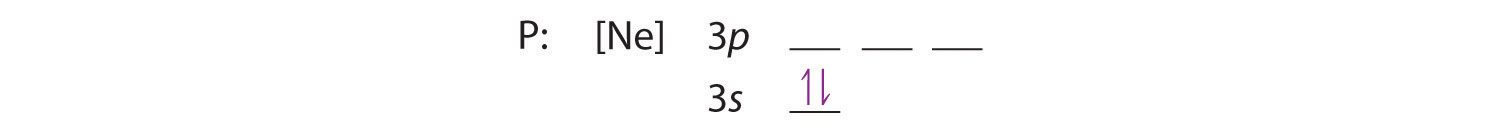
La regla de Hund nos dice que los tres electrones restantes ocuparán los orbitales 3p degenerados por separado pero con sus espines alineados:
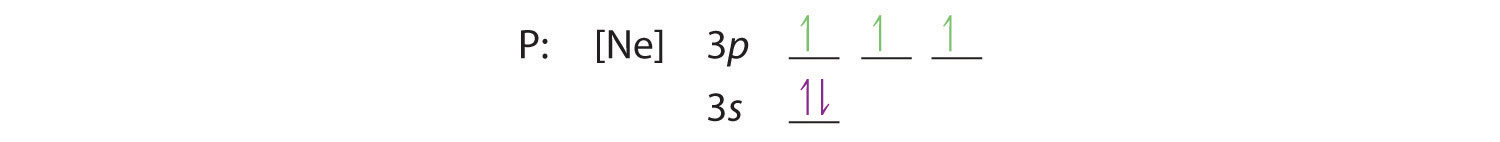
La configuración electrónica es 3s2 3p3.
C Obtenemos la configuración de electrones de valencia ignorando los orbitales internos, lo que para el fósforo significa que ignoramos la capa cerrada. Esto da una configuración de electrones de valencia de 3s2 3p3.
Ejercicio 2.2.2
Dibuja un diagrama de orbitales y úsalo para derivar la configuración electrónica del cloro, Z = 17. ¿Cuál es su configuración electrónica de valencia?
Respuesta: 3s2 3p5
Configuración electrónica de valencia: 3s23p5
El orden general en que se llenan los orbitales se representa en la figura 2.2.1. Las subcubiertas correspondientes a cada valor de n están escritas de izquierda a derecha en líneas horizontales sucesivas, donde cada fila representa una fila de la tabla periódica. El orden de llenado de los orbitales está indicado por las líneas diagonales que van de la parte superior derecha a la inferior izquierda. En consecuencia, el orbital 4s se llena antes que el orbital 3d debido a los efectos de apantallamiento y penetración. En consecuencia, la configuración electrónica del potasio, que inicia el cuarto periodo, es 4s1, y la del calcio es 4s2. Los siguientes 10 elementos, los metales de transición, llenan cinco orbitales 3d, seguidos de tres orbitales 4p. Obsérvese que el último miembro de esta fila es el gas noble criptón (Z = 36), Kr: 4s2 3d10 4p6, que tiene orbitales 4s, 3d y 4p llenos. La quinta fila de la tabla periódica es esencialmente la misma que la cuarta, excepto que los orbitales 5s, 4d y 5p se llenan secuencialmente.
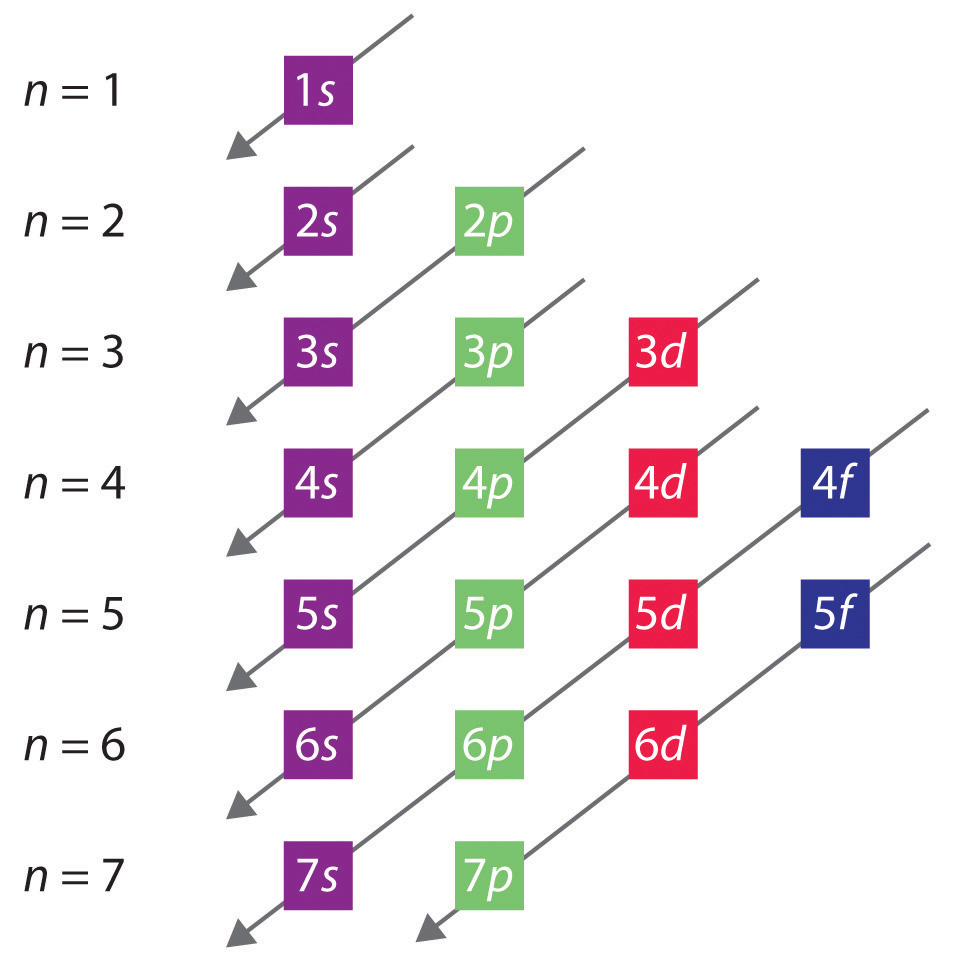
Figura 2.2.1 Predicción del orden en que se llenan los orbitales en los átomos multielectrónicos. Si se escriben los subcapítulos para cada valor del número cuántico principal en líneas sucesivas, el orden observado en que se llenan se indica mediante una serie de líneas diagonales que van de la parte superior derecha a la inferior izquierda.
La sexta fila de la tabla periódica será diferente de las dos anteriores porque los orbitales 4f, que pueden contener 14 electrones, se llenan entre los orbitales 6s y 5d. Los elementos que contienen orbitales 4f en su capa de valencia son los lantánidos. Cuando los orbitales 6p se llenan finalmente, hemos llegado al siguiente (y último conocido) gas noble, el radón (Z = 86), Rn: 6s2 4f14 5d10 6p6. En la última fila, los orbitales 5f se llenan entre los orbitales 7s y 6d, lo que da los 14 elementos actínidos. Como el gran número de protones hace que sus núcleos sean inestables, todos los actínidos son radiactivos.
Ejemplo 2.2.3
Escriba la configuración electrónica del mercurio (Z = 80), mostrando todos los orbitales internos.
Dado: número atómico
Se pide: configuración electrónica completa
Estrategia:
Utilizando el diagrama de orbitales de la figura 2.2.1 y la tabla periódica como guía, rellene los orbitales hasta colocar los 80 electrones.
Solución:
Colocando los electrones en los orbitales siguiendo el orden mostrado en la figura 2.2.1 y utilizando la tabla periódica como guía, obtenemos
| 1s2 | fila 1 | 2 electrones |
| 2s22p6 | fila 2 | 8 electrones |
| 3s23p6 | fila 3 | 8 electrones |
| 4s23d104p6 | fila 4 | 18 electrones |
| 5s24d105p6 | fila 5 | 18 electrones |
| Fila 1-5 | 54 electrones |
Después de llenar las primeras cinco filas, todavía tenemos 80 – 54 = 26 electrones más que acomodar. Según la figura 2.2.2, tenemos que llenar los orbitales 6s (2 electrones), 4f (14 electrones) y 5d (10 electrones). El resultado es la configuración electrónica del mercurio:
Hg: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10
Hg: 6s2 4f14 5d10
con una subesfera 5d llena, una configuración de valencia 6s2 4f14 5d10 y un total de 80 electrones. (Siempre debe comprobar que el número total de electrones es igual al número atómico.)
Ejercicio 2.2.3
Aunque el elemento 114 no es lo suficientemente estable como para ocurrir en la naturaleza, dos isótopos del elemento 114 fueron creados por primera vez en un reactor nuclear en 1999 por un equipo de científicos rusos y estadounidenses. Escribe la configuración electrónica completa del elemento 114.
Respuesta: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p2
Las configuraciones electrónicas de los elementos se presentan en la figura 2.2.3, que enumera los orbitales en el orden en que se llenan. En varios casos, las configuraciones electrónicas del estado básico son diferentes de las predichas por la figura 2.2.1. Algunas de estas anomalías se producen a medida que se llenan los orbitales 3d. Por ejemplo, la configuración electrónica observada en el estado básico del cromo es 4s1 3d5 en lugar de la predicha 4s2 3d4. Del mismo modo, la configuración electrónica observada del cobre es 4s1 3d10 en lugar de s2 3d9. La configuración real de los electrones puede racionalizarse en términos de una estabilidad añadida asociada a una subesfera semillena (ns1, np3, nd5, nf7) o rellena (ns2, np6, nd10, nf14). Dadas las pequeñas diferencias entre los niveles de energía superiores, esta estabilidad añadida es suficiente para desplazar un electrón de un orbital a otro. En los elementos más pesados, también pueden ser importantes otros efectos más complejos, que dan lugar a algunas de las anomalías adicionales indicadas en la figura 2.2.3. Por ejemplo, el cerio tiene una configuración electrónica de 6s2 4f1 5d1, que es imposible de racionalizar en términos simples. En la mayoría de los casos, sin embargo, estas aparentes anomalías no tienen consecuencias químicas importantes.
Nota
La estabilidad adicional se asocia con subcáscaras semillenas o llenas.