Introducción y Función de las Osteoprogenitoras
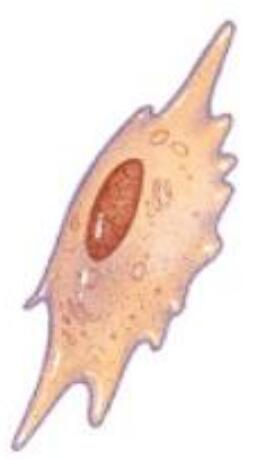
Las células osteoprogenitoras, también conocidas como osteoblastos, se denominan así por su capacidad de autosostenimiento y autorrenovación. Las células madre pueden dividirse en dos células madre o dos células progenitoras dirigidas por un alto grado del mecanismo de regulación. La renovación celular es precisa, y las células madre son relativamente estáticas durante todo el proceso de proliferación. La célula completa la tarea de síntesis de ADN y de expansión celular y conserva su información genética original, mientras produce continuamente células progenitoras, no prolifera ni se diferencia. Puede diferenciarse en osteoblastos bajo la inducción del medio de cultivo que contiene dexametasona, ácido ascórbico y fosfato de glicerol. En el proceso de diferenciación, pueden surgir características propias de las células óseas: síntesis de colágeno tipo I, expresión de fosfatasa alcalina, secreción de calcio óseo y deposición de hidroxiapatita. En los estudios actuales de ingeniería de tejidos óseos, hay muchos informes sobre células osteogénicas, y hay relativamente pocos estudios sobre células osteoprogenitoras que pueden proliferar, diferenciarse en células osteogénicas y finalmente formar hueso. Mediante la comprensión de las características biológicas de las células progenitoras y algunos avances relativamente nuevos en la investigación, podemos proporcionar algunas ideas y formas nuevas en el tratamiento de la reparación de defectos o de la osteoporosis del tejido óseo.
Características de las células osteoprogenitoras
Características de la etapa de diferenciación de las células osteoprogenitoras: Los osteoblastos derivan de las células osteoprogenitoras mesenquimales y desempeñan un papel importante en la osteogénesis. Cuando estas células se introducen en la zona de defecto óseo de animales adultos, pueden promover la formación de hueso, por lo que está claro que la función y el proceso de diferenciación de los osteoprogenitores nos permite tener un conocimiento más profundo del metabolismo del tejido óseo. Se ha informado de que las células progenitoras óseas se obtienen mediante la digestión del cráneo de ratas fetales con enzimas cronometradas y continuas. Las células osteoprogenitoras son muy sensibles a la dexametasona y la expresión de los marcadores de formación ósea aumenta bajo la inducción de la dexametasona. Se confirmó mediante la prueba de la actividad de la fosfatasa alcalina y la deposición de calcio que las células de cráneo de rata fetal de la primera a la tercera generación respondían bien a la dexametasona. Esto indica que se trata de osteoprogenitores localizados en el periostio y la superficie ósea y de osteoblastos inmaduros. La tercera generación de células puede formar el mayor número de nódulos óseos, lo que indica que se trata del mayor número de células osteoprogenitoras. La primera generación es la célula osteoprogenitora más prolífica. Por el contrario, la cuarta generación de células de cráneo de rata fetal tiene una pobre respuesta a la dexametasona. El experimento muestra que la expresión del receptor de glucocorticoides en las células óseas es menor que la de las células osteoprogenitoras y los osteoblastos, lo que indica que la cuarta y quinta generaciones de enzimas digestivas de células de cráneo de rata fetal incluyen principalmente células óseas. Cambios relacionados con la edad en las células osteoprogenitoras: En los estudios sobre los cambios relacionados con la edad en los osteoblastos, se descubrió que la capacidad de formación de hueso de las células estromales de la médula ósea humana no estaba relacionada con la edad. El número de células estromales en los ancianos y en los adultos jóvenes es básicamente similar en términos de cultivo in vitro. La menor capacidad de formación ósea de los ancianos se debe a cambios en el entorno interno del individuo que reducen el potencial osteogénico de las células osteoprogenitoras. Con el aumento de la edad, la capacidad proliferativa de las células osteoprogenitoras se debilita gradualmente, pero su número no disminuye significativamente. Las células osteoprogenitoras de los ratones envejecidos son menos sensibles a los resultados mitogénicos inducidos por el factor de crecimiento de fibroblastos básico que las ratas jóvenes.
Regulación de las células osteoprogenitoras
Como las células osteoprogenitoras desempeñan un papel importante en la formación del hueso, la regulación de las células osteoprogenitoras es particularmente importante. Receptores de Y-neuropeptide tipo 2 en las células osteoprogenitoras: Tradicionalmente, el proceso de formación ósea está regulado principalmente por el sistema endocrino y por factores locales como las citoquinas y los factores de crecimiento. Sin embargo, esta visión está cambiando gradualmente. Cada vez hay más pruebas de que las citoquinas neuro en el tejido óseo también pueden alterar la actividad de las células óseas. Los estudios han confirmado que las células nerviosas que entran en el tejido óseo están asociadas al hipotálamo, lo que es coherente con la supresión condicional de los receptores del neuropéptido Y de tipo 2. Se ha demostrado que las fibras inmunorreactivas del neuropéptido Y están presentes en la médula ósea, el periostio y el tejido óseo. Los estudios han demostrado que el número de células osteoprogenitoras derivadas de ratones Y2-/- y su capacidad osteogénica es mayor. Al mismo tiempo, la falta del receptor Y2 puede hacer que las células del estroma regulen a la baja el receptor Y1, posiblemente porque el tejido óseo no puede inhibir la liberación de la retroalimentación del neuropéptido Y, lo que conduce a una estimulación excesiva del receptor Y1 y promueve la mineralización ósea, lo que puede ser para el tratamiento de la masa ósea. La tirosina quinasa rica en prolina 2 y la quinasa de adhesión focal (FAK) son una proteína quinasa de tirosina no receptora que juntas forman la familia de las quinasas de adhesión focal. La tirosina quinasa 2 rica en prolina es la quinasa de mayor nivel en el cerebro y el sistema hematopoyético. Muchos experimentos in vitro han demostrado que la tirosina quinasa 2 rica en prolina regula la función y la actividad de los osteoclastos. Algunos estudiosos han descubierto de forma inesperada que la formación ósea de los ratones PYK2-/- ha aumentado significativamente. En consonancia con este hallazgo, la capacidad de diferenciación y la actividad de las células osteoprogenitoras en la médula ósea de los ratones PYK2-/- aumentaron. Además, la inyección diaria de pequeños inhibidores de la tirosina quinasa 2 rica en prolina en ratas ovariectomizadas puede aumentar eficazmente la formación de hueso y reducir la pérdida ósea. Se cree que la tirosina quinasa 2 rica en prolina regula la diferenciación de las células osteoprogenitoras tempranas, y que los inhibidores de la tirosina quinasa 2 ricos en prolina promueven la formación de hueso y pueden utilizarse en el tratamiento de la osteoporosis en el futuro. La fijación interna es un método habitual para el tratamiento de las fracturas, pero al mismo tiempo, el dispositivo de fijación interna también proporciona un espacio parasitario adecuado para la biopelícula necesaria para la reproducción de patógenos, provocando así una infección y otra enfermedad concurrente. Las infecciones graves pueden retrasar la curación de la fractura y estimular la absorción del tejido óseo. En caso de infección, el tratamiento habitual es retirar el dispositivo de fijación interna o cambiarlo por uno de fijación externa, lo que obviamente afectará a la curación de la fractura o causará molestias al paciente. Se ha demostrado que la recombinación humana de la proteína ósea-1 (rhOP-1, también conocida como BMP7) induce la formación de hueso nuevo en defectos óseos de tamaño crítico en ratones con infección aguda. Algunos estudiosos han descubierto mediante experimentos que el uso de la inyección de proteína morfogenética ósea puede promover la formación de hueso si se produce una infección crónica tras la fijación dentro de la fractura, y el tratamiento con antibióticos puede potenciar el proceso. La proteína morfogenética ósea puede promover eficazmente la proliferación y diferenciación de las células osteoprogenitoras y expresar marcadores de osteoblastos. Se ha informado de la presencia de células osteoprogenitoras en el pericondrio. Estas células osteoprogenitoras regulan al alza la proteína morfogenética ósea 2 durante su diferenciación en osteoblastos maduros que producen una matriz ósea, y la propia proteína morfogenética ósea 2 es un potente inductor de la osteogénesis. Efecto de la onda de choque extracorpórea sobre las células osteoprogenitoras: Las ondas de choque extracorpóreas se han utilizado en el tratamiento de los cálculos renales durante más de 20 años. En los últimos años, las ondas de choque se han aplicado al tratamiento de la curación de fracturas. En la actualidad, la mayoría de los estudiosos creen que la osteogénesis de las ondas de choque se debe a la promoción de la expresión de una o varias citoquinas. Wang et al. estudiaron los efectos de las ondas de choque en las células progenitoras mesenquimales de la médula ósea. En este estudio, se recogió el estroma de la médula ósea y las células hematopoyéticas para evaluar el impacto de las ondas de choque en el fémur de rata, formando células progenitoras de colonias (CFU-F y CFU-O), granulocitos, glóbulos rojos, monocitos y megacariocitos. Al mismo tiempo, se midió la actividad de la fosfatasa alcalina y la cantidad de factor de crecimiento transformante β1 producido en las células estromales de la médula ósea cultivadas. Los resultados muestran que el parámetro de ondas de choque más idóneo es el de 500 pulsos, 0,06 mg/mm2, que puede promover mejor el crecimiento de CFU2F y CFU2O. La actividad de la fosfatasa alcalina aumentó 1173 veces con el nitrofenol P2. El experimento también encontró que la onda de choque fue mejorada por la densidad de energía de 0,16 mg/mm2, la dosis de 500, y la expresión del factor de crecimiento transformante β1 fue reforzada. Después de 12 días, las células osteoprogenitoras formaron colonias, lo que confirmó que el factor de crecimiento transformante β1 promovió las células estromales de la médula ósea en la onda de choque. Desempeña un papel importante en la transformación de las células osteoprogenitoras. Por lo tanto, se han estudiado los efectos biológicos de las ondas de choque sobre las células osteoprogenitoras y la formación de hueso. Se ha demostrado que el papel de las uniones en hueco entre las células endoteliales y las células osteoprogenitoras en la osteogénesis es un proceso acoplado de angiogénesis y desarrollo y maduración del tejido óseo. La estrecha relación entre el endotelio vascular y los osteoblastos sugiere que las células endoteliales (CE) desempeñan un importante papel en la regulación de la formación y la función del hueso. Algunos estudiosos han descubierto que la unión entre las células endoteliales y las células osteoprogenitoras es un factor clave para potenciar la actividad osteogénica de las células osteoprogenitoras. Sobre esta base, otros estudiosos han propuesto que las células endoteliales pueden expresar la proteína morfogenética ósea 2 y potenciar la capacidad osteogénica de las células osteoprogenitoras. Este efecto requiere una estrecha conexión entre las células endoteliales y las células osteoprogenitoras. Muchas veces, la formación de hueso nuevo se ve limitada por la falta de vasos sanguíneos en el tejido. Para resolver este problema, los investigadores esperan promover la angiogénesis mediante el uso de factores angiogénicos. No ha habido informes sobre la formación de hueso por ingeniería de tejidos mediante el trasplante de células endoteliales, el impacto de esta compleja interacción entre las células endoteliales y las células osteoprogenitoras en la osteogénesis merece más investigación.
- Ibrahim A, Bulstrode N W, Whitaker I S, et al. Nanotechnology for Stimulating Osteoprogenitor Differentiation. Open Orthopaedics Journal. 2016, 10(Suppl-3, M5):849.
- Goodman S B, Hwang K L. Treatment of Secondary Osteonecrosis of the Knee With Local Debridement and Osteoprogenitor Cell Grafting. Journal of Arthroplasty. 2015, 30(11):1892-1896.
- Park J, Gebhardt M, Golovchenko S, et al. Vías duales hacia los osteoblastos endocondrales: una nueva célula osteoprogenitora derivada de condrocitos identificada en el cartílago hipertrófico. Biology Open. 2015, 4(5):608-621.
- Pikilidou M, Yavropoulou M, Antoniou M, et al. La contribución de las células osteoprogenitoras a la rigidez arterial y la hipertensión. Journal of Vascular Research. 2015, 52(1):32.
- Dogaki Y, Lee S Y, Niikura T, et al. Derivación eficiente de células osteoprogenitoras a partir de células madre pluripotentes inducidas para la regeneración ósea. Ortopedia Internacional. 2014, 38(9):1779-1785.