- Hintergrund
- Normale Physiologie und Pathophysiologie des Kaliums
- Aktionspotential eines nicht schrittmachenden Kardiomyozyten
- Aktionspotenzial einer Herzschrittmacherzelle
- Stromleitung
- Refraktärzeit
- Hyperkaliämie, Klassifizierung und Ursachen
- Klassifizierung
- Ursachen
- Auswirkungen der Hyperkaliämie
- Metabolische Wirkungen
- Natrium-Kalium-Pumpe
- Schlussfolgerung
Hintergrund
Kalium ist ein weiches, silbrig-weißes, hochreaktives Kation, das zur Familie der Alkalimetalle im Periodensystem gehört. Es ist das am häufigsten vorkommende Kation im menschlichen Körper insgesamt und das am weitesten verbreitete Ion in den intrazellulären Kompartimenten.
Im Durchschnitt enthält eine westliche Ernährung 80-100 mEq Kalium pro Tag, und unter normalen physiologischen Bedingungen werden 90 % davon passiv absorbiert, so dass nur 9,0 mmol für die fäkale Ausscheidung übrig bleiben. Die im Körper gespeicherten 3500-4000 mmol stehen in keinem Verhältnis zu den täglichen Plasmakaliumspiegeln, die normalerweise durch einen straffen Homöostasemechanismus im Bereich von 3,5-5,3 mmol/L gehalten werden, wobei die niedrigsten Spiegel nachts und in den frühen Morgenstunden und die höchsten Spitzenwerte in den Nachmittagsstunden erreicht werden.
Nach der Aufnahme in den Blutkreislauf ist es die Aufgabe der Niere, die Kaliumzufuhr mit der Kaliumabgabe in Einklang zu bringen; dies erfordert mehrere Stunden, in denen das „interne Kaliumgleichgewicht“ unter dem Einfluss von Insulin und Katecholaminen eine vorübergehende Homöostase aufrechterhält, indem es das Kalium zwischen dem intrazellulären und dem extrazellulären Raum verschiebt. Die Stimulierung der Alpha-Rezeptoren behindert den Kaliumeintritt in die Zellen, die Stimulierung der Beta-Rezeptoren fördert ihn durch die Aktivierung der Natrium-Kalium-ATPase-Pumpe.
Die Natrium-Kalium-ATPase-Pumpe ist das Gate-Keeper-Enzym im Sarkolemma. Es trägt dazu bei, 98 % des in der Zelle gespeicherten Kaliums (etwa 144,0 mmol) zu sichern. Dies gewährleistet die Aufrechterhaltung der lebenswichtigen Potentialdifferenz über die Zellmembranen, die für eine ordnungsgemäße Zellfunktion erforderlich ist, insbesondere bei erregbaren Zellen wie Nervenzellen und Herzmuskelzellen.
Normale Physiologie und Pathophysiologie des Kaliums
Nach seiner raschen Resorption trägt Kalium durch die Freisetzung von Insulin und Aldosteron zur Regulierung seines eigenen Körperhaushalts bei. Andere körpereigene Stimuli, die ebenfalls den Kaliumspiegel im Körper steuern, sind die adrenergen Beta-2-Rezeptoren, der alkalische PH-Wert des Blutes und der zelluläre Anabolismus.
Freisetzung von Insulin und Aldosteron: Mit der Nahrung aufgenommenes Kalium gelangt schnell in den Blutkreislauf. Wenn es den Pfortaderkreislauf erreicht, stimuliert es die Bauchspeicheldrüse zur Freisetzung von Insulin. Gleichzeitig führt das zirkulierende Kalium, das die juxtaglomerulären Zellen erreicht, zu einer Freisetzung von Renin. Wenn Renin die Leber erreicht, wird es in Angiotensin I umgewandelt. Angiotensin I gelangt in die Lunge, wo es in Angiotensin II umgewandelt wird. Angiotensin II gelangt dann über das zirkulierende Blut zurück zu den Nieren und regt die Zona glomerulosa zur Sekretion von Aldosteron an.
Interner Kaliumhaushalt: Das postprandial freigesetzte Insulin wirkt vor allem auf die Skelettmuskulatur und aktiviert zwei Wege, den AKT-abhängigen Weg, der für den Einbau des Glukosetransporters GLUT4 verantwortlich ist, und den APK-Weg, der die zelluläre Natrium-Kalium-ATPase aktiviert, um das Kalium in den intrazellulären Raum zu verschieben. Im Gegensatz zum AKT-abhängigen Weg wird der APK-Weg weder durch das metabolische Syndrom noch durch eine chronische Nierenerkrankung beeinträchtigt (Abbildung 1).
Ausscheidung: Das von den Nierenglomeruli gefilterte Kalium wird im proximalen Tubulus und in der Henle-Schleife im Verhältnis zur abgegebenen Menge an Natrium und Wasser passiv rückresorbiert. Normalerweise erreichen nur etwa 10 % der filtrierten Menge das distale Nephron.
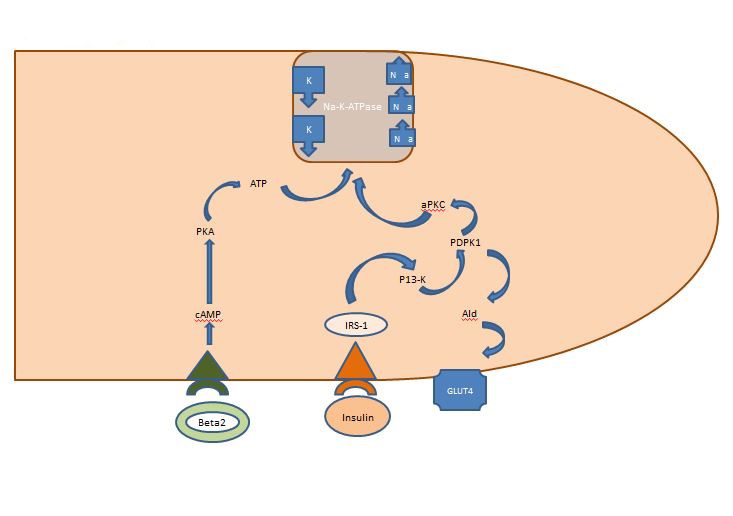
Abbildung 1. Wirkung von Insulin auf eine Skelettmuskelzelle. Postprandial freigesetztes Insulin aktiviert in der Skelettmuskulatur zwei Wege, den AKT-abhängigen Weg, der für die Einschleusung des Glukosetransporters GLUT4 verantwortlich ist, und den APK-Weg, der die zelluläre Natrium-Kalium-ATPase aktiviert, um das Kalium in den intrazellulären Raum zu verschieben.
Am Anfang des distalen Tubulus convolutus beginnt die Sekretion von überschüssigem Kalium, die mit dem Voranschreiten in Richtung des distalen Nephrons und in den Sammelkanal zunehmend zunimmt. Dies wird durch die Hochregulierung der Wasserstoff-Kalium-ATPase auf den alpha-interkalierten Zellen vermittelt.
Das Vorhandensein höherer Kaliumspiegel in den peritubulären Zellen der Nieren aktiviert das RAAS-System zur Freisetzung von Aldosteron, das die Natrium-Kalium-ATPase in der basolateralen Membran aktiviert, was zu einer Abnahme des intrazellulären Natriums führt, was zu einem verstärkten elektrogenen Transport der Kaliumaufnahme durch Hyperpolarisierung der Membranspannung führt und seine Ausscheidung in den Urin ermöglicht .
Bei Hyperkaliämie kann die über den Dickdarm ausgeschiedene Kaliummenge um bis zu 30% ansteigen, z.B., bei Nierenversagen, wo das Kalium dann aktiv von der aktivierten Natrium-Kalium-ATPase-Pumpe in der basolateralen Membran der Kolon-Enterozyten aufgenommen wird, um auf der anderen Seite über die apikalen großen kalziumabhängigen Kaliumkanäle der Zellen in das Kolonlumen ausgeschieden zu werden.
Aus den obigen Ausführungen geht hervor, dass der Mechanismus der Homöostase des Kaliumplasmaspiegels hauptsächlich durch das Zusammenspiel dreier gleichzeitiger Vorgänge bestimmt wird – Kaliumaufnahme, intra- und extrazelluläre Kaliumverschiebung und Kaliumausscheidung über den Urin, die alle letztlich von der Natrium-Kalium-Pumpe abhängen.
Um den Mechanismus der drohenden Gefahr einer Hyperkaliämie und deren Bewältigung zu verstehen, muss man die Physiologie des Aktionspotentials und das Innenleben des Natrium-Kalium-ATPase-Enzyms verstehen.
Elektrophysiologie des Aktionspotentials, d.h., Die Elektrophysiologie des Aktionspotentials, d.h. der Ionenbewegung durch die Zellmembranen, wird durch die Differenz zweier Potentiale bestimmt, eines „chemischen Potentials“, bei dem sich die Ionen ihren Konzentrationsgradienten hinunterbewegen, und eines „elektrischen Potentials“, bei dem Ionen und Moleküle gleichartige Ladungen abstoßen, wodurch sich das Transmembranpotential (TMP) ergibt, das als +ve bezeichnet wird, wenn die Nettobewegung der +ve Ionen zur Außenseite der Zelle erfolgt und umgekehrt.
Aktionspotential eines nicht schrittmachenden Kardiomyozyten
Es gibt fünf Phasen eines Aktionspotentials, die mit Phase 4 beginnen und enden. Zu den an diesem Prozess beteiligten Pumpen gehören der Natrium-Kalzium-Austauscher des Sarkolemmas, die Kalzium-ATPase und schließlich die Natrium-Kalium-ATPase.
- Phase 4. Die Ruhephase: Sie hat ein Ruhepotential von -90 mV als Folge der ständigen Auswärtsbewegung von Kalium über die Einwärtsgleichrichterkanäle. Während dieser Phase sind sowohl die Natrium- als auch die Kalziumkanäle geschlossen.
- Phase 0. Die Depolarisationsphase: Das Feuern einer Schrittmacherzelle oder ihre Durchleitung durch eine Nachbarzelle löst den Anstieg des TMP auf über -90 mV aus. An diesem Punkt beginnen sich die „schnellen Natriumkanäle“ nacheinander zu öffnen, so dass Natrium in die Zelle eindringen kann und der TMP ansteigt. Sobald sich genügend schnelle Natriumkanäle geöffnet haben, um -70 mV zu erreichen, wird ein selbsterhaltender Natriumstrom nach innen in Gang gesetzt, eine rasche Depolarisierung des TMP auf 0 mV für eine vorübergehende Zwischenzeit, die als „Overshoot“ bezeichnet wird; an diesem Punkt schließen sich die zeitabhängigen schnellen Natriumkanäle und die „lang öffnenden“ Kalziumkanäle öffnen sich, um den TMP auf -40 mV anzuheben und einen kleinen stetigen Kalziumeinstrom über den Konzentrationsgradienten zu ermöglichen.
- Phase 1. Die frühe Repolarisationsphase: Sie beginnt mit dem leicht positiven TMP und der kurzzeitigen Öffnung einiger Kaliumkanäle, die den Kalziumfluss nach außen bewirken und den TMP wieder auf etwa 0 mV bringen.
- Phase 2. Die Plateauphase: Hier sind die beiden Gegenströme elektrisch ausgeglichen und führen zur Aufrechterhaltung des TMP-Gleichgewichts bei knapp unter 0 mV. Die „lang öffnenden Kalziumkanäle“ sind noch offen, was zu einem konstanten Kalziumfluss in die Zelle führt. Der verzögert gleichrichtende Kaliumkanal ermöglicht den Durchgang von Kalium nach außen durch den Konzentrationsgradienten der Zelle.
- Phase 3. Die Repolarisationsphase: Während dieser Phase werden die Kalziumkanäle allmählich inaktiviert, und der anhaltende Kaliumfluss nach außen übersteigt den Kalziumfluss nach innen, so dass das Kalium in den intrazellulären Raum und das Natrium und Kalzium nach außen zurückkehren.
Aktionspotenzial einer Herzschrittmacherzelle
Die Herzschrittmacherzellen besitzen eine angeborene Automatik, die ihre Depolarisation in rhythmischen Zyklen ermöglicht. Der sinoatriale Knoten (SAN) hat den höchsten selbstinitiierten Depolarisationsrhythmus mit einer Rate von 60-90/min, gefolgt vom atrioventrikulären Knoten (AVN) mit einer Rate von 40-60/min und dann den Purkinje-Fasern und dem Ventrikelmuskel mit 20-40/min.
Die Membranpotentiale der Schrittmacherzellen sind instabil und ihre Aktionspotentiale haben keine klar abgegrenzten Phasen. Sie haben weniger Einwärtsgleichrichter-Kaliumkanäle, und ihre TMP fällt nie unter -60 mV, wodurch die Rolle der schnellen Natriumkanäle entfällt, die eine TMP von -90 mV benötigen, was zum Fehlen der schnellen Depolarisationsphase führt.
Bei TMP >-60 mV wird der „funny/pacemaker“-Strom mit einem spontanen Ionenfluss durch die langsamen Natriumkanäle in Gang gesetzt, der die TMP auf <-50 mV depolarisiert und dann auf -60 mV zurückgeht, wenn sich die Kalziumkanäle schließen.
Stromleitung
Alle Kardiomyozyten sind über die Gap Junction elektrisch gekoppelt, auch die Schrittmacherzelle. Dies erleichtert die weitreichende Depolarisation aller benachbarten Zellen und macht das Herz zu einer funktionellen Einheit, in der die Zelle mit der höchsten Eigenfrequenz zum „Schrittmacher“ wird.
Refraktärzeit
Die längere Refraktärzeit während des langen Plateaus in Phase 2 aufgrund der langsamen Kalziumkanäle liefert die Zeit, die für die vollständige Entleerung der Herzkammern vor der nächsten Kontraktion benötigt wird. Refraktärperioden können absolut (ARP), effektiv (ERP) oder relativ (RRP) sein. Bei einer ARP ist die Zelle absolut nicht erregbar.
Eine ERP dauert von der ARP bis zum kurzen Abschnitt der Phase 3. Ein Reiz zu diesem Zeitpunkt könnte die Zelle minimal depolarisieren, aber der Grad der Depolarisation ist schwächer als die Ausbreitung eines Aktionspotentials auf die Nachbarzellen.
RP wird durch einen überdurchschnittlichen Reiz ausgelöst, der zur Depolarisation der Zelle und zur Erzeugung eines Aktionspotentials führt.
Eine „supranormale Periode“ ist ein übererregbarer Zustand, in dem ein schwächerer als normaler Reiz zu einer Arrhythmie führen kann, was die Synchronisation während der Kardioversion erforderlich macht, um Kammerflimmern zu vermeiden (Abbildung 2).
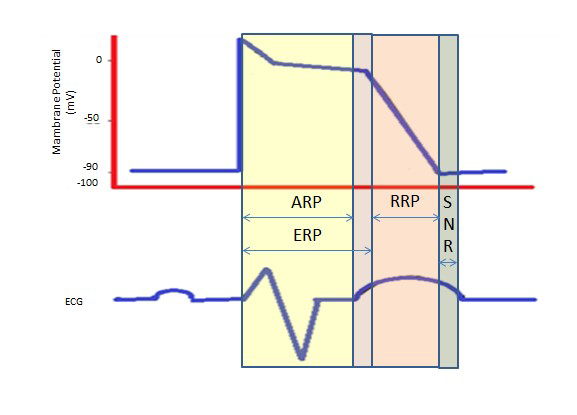
Abbildung 2. Refraktäre Perioden. ARP: Absolute Refraktärzeit; ERP: Effektive Refraktärzeit; RRP: Relative Refraktärzeit; SNR: Supranormale Refraktärzeit
Hyperkaliämie, Klassifizierung und Ursachen
Klassifizierung
Hyperkaliämie wird als leicht eingestuft, wenn die Werte im Bereich von 5,5-6,0 mmol/L liegen, als mittelschwer ab 6,1-6,9 mmol/L und als schwer bei Werten von 7.0 mmol/L oder höher und bei jedem Wert, bei dem EKG-Veränderungen auftreten.
Ursachen
Hyperkaliämie tritt auf, wenn die Kompensationsmechanismen nicht mehr in der Lage sind, mit dem Ungleichgewicht fertig zu werden, weshalb sie in der Regel multifaktoriell bedingt ist.
- Erhöhte Kaliumzufuhr über jeden Weg, z. B., orale Nahrungsaufnahme oder intravenöse Verabreichung von kaliumhaltigen Flüssigkeiten wie Penicillin G.
- Rückhaltung durch die Nieren: Da die Kaliumausscheidung von Aldosteron und der Bereitstellung einer ausreichenden distalen Natrium- und Wassermenge in den Nephronen abhängt, sind Zustände wie Nierenversagen, Nebenniereninsuffizienz (Morbus Addison), hyporeninämischer Hypoaldosteronismus Typ IV, renale tubuläre Azidose, insbesondere bei Patienten mit diabetischer Nephropathie, sowie jeder Zustand, der eine Hypoperfusion begünstigt, wie z. B. Volumenmangel und kongestive Herzinsuffizienz, beeinträchtigen das komplizierte Gleichgewicht des Kaliums im Körper und prädisponieren zu Hyperkaliämie.
- Nebenniereninsuffizienz: Diese muss bei hyperkaliämischen Patienten ausgeschlossen werden, insbesondere bei Vorliegen einer Hyponatriämie und Muskelschwäche. Zum Screening auf primäre Nebenniereninsuffizienz wird ein Standard-Cosyntropin-Stimulationstest durchgeführt, bei dem 0,25 mg synthetisches Cosyntropin als intravenöser Bolus verabreicht und 45 Minuten bis 1 Stunde später das Plasmacortisol gemessen wird. Werte von weniger als 20 mcg/dL deuten auf eine Nebenniereninsuffizienz hin.
- Medikamente, die Kalium zurückhalten: Verschreibungspflichtige Medikamente, die die Natrium-Kalium-ATPase-Aktivität reduzieren, wie z. B. beta-adrenerge Rezeptorblocker, und Medikamente, die die Aldosteronsekretion reduzieren, wie ACE- und ARB-Hemmer, nicht-steroidale entzündungshemmende Medikamente und kaliumsparende Diuretika, müssen engmaschig überwacht werden, um eine iatrogene Hyperkaliämie zu vermeiden, insbesondere in der geriatrischen Altersgruppe mit ihrer fortschreitenden Abnahme der Nierenfunktion als Teil des Alterungsprozesses.
- Störungen der transzellulären Kaliumverschiebung: Dies kann bei Azidose, Hyperglykämie, Hyperosmolalität, schwerer körperlicher Anstrengung, Gewebezerfall, hyperkaliämischer periodischer Paralyse und bei der Einnahme von Beta-Adrenergika-Blockern auftreten. Für jede Abnahme des PH-Wertes im Blut um 0,1 Einheiten steigt das Serumkalium um etwa 0,6 mmol/L (weniger, wenn die Azidose durch organische Säuren verursacht wird).
- Pseudo-Hypoaldosteronismus ist eine angeborene autosomal rezessive Krankheit, bei der die Nieren gegen die Wirkung von Aldosteron resistent sind.
- Auch die Pseudo-Hyperkaliämie darf nicht übersehen werden: Wie der Name schon sagt, handelt es sich dabei um eine Erhöhung des Serumkaliums bei normalem Plasmakalium. Sie kann bei hämolysiertem Blut, bei längerem Anlegen eines Druckverbandes während einer Blutentnahme, der die extrazelluläre Freisetzung von Kalium verursacht, bei wiederholtem Ballen der Faust während der Phlebotomie, bei traumatischer Venenpunktion, bei Leukozytose und Thrombozytose und bei einigen seltenen genetischen Syndromen wie der familiären Pseudo-Hyperkaliämie und der hereditären Sphärozytose auftreten. Es kann sich aber auch um einen einfachen Laborfehler handeln.
Auswirkungen der Hyperkaliämie
Eine leichte Hyperkaliämie ist oft asymptomatisch und wird aufgrund ihrer vagen Symptome wie Unwohlsein, Muskelschwäche und Parästhesie zufällig durch Labortests festgestellt. Eine schwere Hyperkaliämie beeinträchtigt die neuromuskuläre Funktion in Form von Skelettmuskelschwäche und Lähmungen; dies ist jedoch keine häufige Erscheinung, da die kardiale Toxizität das Bild dominiert und die erste Erscheinung ist. Die kardiale Toxizität zeigt sich im EKG in der Regel in der folgenden, stufenweise ansteigenden Weise, obwohl dies je nach Ätiologie nicht unbedingt der Fall sein muss:
- Bei Konzentrationen von mehr als 5,5 mEq/L kommt es durch die Erhöhung der Leitfähigkeit der Kaliumkanäle zu einem Anstieg des lkr-Stroms, was zu einer schnellen Repolarisierung in Form einer spitzen T-Welle im Oberflächen-EKG führt. Diese T-Wellen unterscheiden sich von denen des Myokardinfarkts und des Schlaganfalls durch ihre kurze Dauer von 150-250 ms.
- Bei Kaliumwerten von mehr als 6,5 mEq/L tritt ein Zustand anhaltender unterschwelliger Depolarisation auf, der eine Verzögerung der atrialen und ventrikulären Depolarisation verursacht. Die Verringerung der Phase 0 des Aktionspotenzials führt zu einem längeren Aktionspotenzial und damit zu einer Verzögerung der intraventrikulären und atrioventrikulären Erregungsleitung. Auf dem Oberflächen-EKG zeigt sich dies in einer Abflachung und einem Verlust der P-Wellen und einer Verbreiterung der QRS-Komplexe. Mit zunehmender Verzögerung der intraventrikulären Erregungsleitung zeigt das Oberflächen-EKG erste Anzeichen eines Links- und Rechtsschenkelblocks. Dies kann von der Schenkelblockkrankheit dadurch unterschieden werden, dass bei Hyperkaliämie die Verzögerung während des gesamten QRS-Komplexes anhält und nicht nur während des initialen bzw. terminalen Abschnitts.
- Bei 10 mEq/L tritt die sinoatriale Reizleitung nicht mehr auf, und der beschleunigte junktionale Rhythmus tritt ein. Ventrikuläre Arrhythmien entwickeln sich, indem die verbreiterten QRS-Komplexe mit den T-Wellen verschmelzen und schließlich das klassische Sinuswellenmuster bilden. Sobald dies eintritt, drohen VF und Asystolie, und es kommt zum Herzstillstand.
- Gelegentlich können die Veränderungen unberechenbar und unvorhersehbar sein, und das EKG springt aufgrund der Variabilität der ätiologischen Faktoren und ihrer Auswirkungen, z. B. der Geschwindigkeit der Kaliumveränderung, der Kalziumkonzentration, des pH-Werts und der Natriumkonzentration, von normal zu asystolisch. Daher sollte eine Hyperkaliämie sofort behandelt werden, wenn der Kaliumspiegel über 6,5 mmol/l liegt oder wenn unabhängig vom Kaliumspiegel EKG-Manifestationen einer Hyperkaliämie vorliegen. Zu den weiteren berichteten Assoziationen mit akuter Hyperkaliämie gehören: das Bild eines Pseudo-MI auf der EKG-Aufzeichnung mit massivem ST-T-Segment als Folge von Störungen der Myozytenrepolarisation, kurze PR- und QT-Intervalle, Sinustachykardie, Sinusbradykardie, idioventrikulärer Rhythmus, Herzblock 1. und 2.
Metabolische Wirkungen
Hyperkaliämie führt zu einer hyperchlorämischen metabolischen Azidose, da die Hyperkaliämie die intrazelluläre Aufnahme von Kalium im Austausch gegen Wasserstoffionen fördert. Dadurch entsteht eine intrazelluläre Alkalose, die die Ammoniakproduktion der Niere in den proximalen Tubuli unterdrückt, was zu einer Abnahme der Ammonium- und Säureausscheidung im Urin und zu einer renalen tubulären Azidose vom Typ IV führt.
Natrium-Kalium-Pumpe
Die Natrium-Kalium-ATPase wurde 1957 von Skou entdeckt, der später für seine Entdeckung einen Teil des Nobelpreises für Chemie 1997 erhielt.
Skou entdeckte als erster die Natrium-Kalium-ATPase im Sarkolemm der Zelloberfläche der Herzmuskeln. Später wurde ihr Vorhandensein in allen eukaryontischen ein- und mehrzelligen Organismen nachgewiesen.
Die Natrium-Kalium-Pumpe funktioniert, indem sie die Hydrolyse von ATP mit dem zellulären Export von drei Natrium-Ionen im Austausch gegen zwei Kalium-Ionen gegen ihren elektrochemischen Gradienten verknüpft. Sie ist das molekulare Ziel für Digitalis und Digoxin, die seit dem 18. Jahrhundert als Fingerhut-Extrakte verwendet werden.
Die Wirkung der Natrium-Kalium-Pumpe wird durch ein Phosphoprotein Phospholemman reguliert, dessen Nicht-Phosphorylierung zu einer Hemmung der Pumpe und dessen Phosphorylierung zu einer Steigerung der Pumpenaktivität führt. Es hat drei Phosphorylierungsstellen, zwei Palmitoylierungsstellen und eine Glutathionylierungsstelle, was die Vielzahl der Signale erklärt, die die Pumpe stimulieren und hemmen können.
Die Natrium-Kalium-Pumpe selbst ist ein Enzym, das aus mehreren Untereinheiten mit mehreren Isoformen besteht. Das Vorhandensein der Alpha- und Beta-Untereinheiten (hauptsächlich B1 im Herzen) ist für ihre Funktion unerlässlich. Kürzlich wurde in den Nieren eine dritte Protein-Gamma-Untereinheit identifiziert, deren Funktion jedoch bisher unbekannt ist.
Die Alpha-Untereinheit ist der katalytische Kern des Natrium-Kalium-Pumpen-Enzyms. Sie ist etwa 100 kDa groß und enthält die Bindungsstellen für Natrium, Kalium, ATP und kardiotonische Steroide wie Ouabain. Nur Alpha 1 und Alpha 2 kommen in einem normalen Herzmuskel in nennenswertem Umfang vor und sind funktionell mit dem Natrium-Kalzium-Austauscher (NCX) verbunden. Es wurde berichtet, dass Alpha 3 in experimentellen Modellen der Herzinsuffizienz an die Stelle von Alpha 2 tritt.
Daten aus neueren Experimenten sprechen dafür, dass beide Alpha-1-Alpha-2-Untereinheiten der Pumpe an der Regulierung der Erregungs-Kontraktions-Kopplung (E-K) beteiligt sind. Man nimmt an, dass die Alpha-1-Untereinheit, die gleichmäßiger über das Sarkolemm verteilt ist, eher eine „haushaltende“ Rolle spielt, indem sie sowohl die Kontraktilität als auch das intrazelluläre Natrium kontrolliert, während die Alpha-2-Untereinheit, deren Expression in den T-Tubuli zusammen mit anderen Schlüsselkomponenten der E-Kopplung konzentriert ist, sich hauptsächlich auf die Kontraktilität konzentriert.
Zu den bekannten Faktoren, die die Natrium-Kalium-Pumpe kontrollieren können, gehören: ATP, intrazelluläres Natrium, sub-sarkolemmale Barrieren und unscharfe Räume, Membranpotential, intrazelluläre Signalwege (adrenerge Signalwege, Proteinkinase A & C, Stickstoffmonoxid, Phospholemman), direkte Regulation durch kleine Moleküle (Lipide, endogene kardiotonische Steroide), andere assoziierte Proteine (Caveolae und Caveoline und Ankyrin).
Schlussfolgerung
Hyperkaliämie ist eine klinische Herausforderung und kann bei bis zu 10 % der hospitalisierten Patienten auftreten. Die Folgen sind lebensbedrohlich. Da alle Körperzellen letztlich von der Natrium-Kalium-Pumpe betroffen sind und es bekannt ist, dass ischämische Herzmuskeln ihr Kalium extrazellulär ausscheiden, was zu einer Verringerung der Arrhythmieschwelle mit der Möglichkeit ventrikulärer Arrhythmien führt, die die Hypopolarisierung verschlimmern und die Schwelle noch weiter senken, müssen sich mehr Studien auf die Manipulation des Natrium-Kalium-Enzyms konzentrieren, da seine Kontrolle die Ergebnisse von Herzstillständen günstig beeinflussen und die derzeitigen HLW-Leitlinien neu formulieren könnte.