J Cancer 2020; 11(6):1341-1350. doi:10.7150/jca.40817
Forschungsarbeit
Amy C. Moreno1, Yan Heather Lin2, Isabelle Bedrosian3, Yu Shen2, Gildy V. Babiera3, Simona F. Shaitelman1 ![]()
1. Abteilung für Strahlenonkologie, The University of Texas MD Anderson Cancer Center, Houston, TX.
2. Abteilung für Biostatistik, The University of Texas MD Anderson Cancer Center, Houston, TX.
3. Abteilung für chirurgische Onkologie, The University of Texas MD Anderson Cancer Center, Houston, TX.
Moreno AC, Lin YH, Bedrosian I, Shen Y, Babiera GV, Shaitelman SF. Outcomes after Treatment of Metaplastic Versus Other Breast Cancer Subtypes. J Cancer 2020; 11(6):1341-1350. doi:10.7150/jca.40817. Verfügbar unter https://www.jcancer.org/v11p1341.htm
Zweck: Metaplastischer Brustkrebs (BC) ist ein seltener, aber aggressiver histologischer Subtyp von BC. Wir haben versucht, Faktoren zu identifizieren, die mit seiner Diagnose assoziiert sind, und die Behandlung und Ergebnisse des metaplastischen BC mit denen anderer BCs und insbesondere des dreifach negativen invasiven duktalen Karzinoms zu vergleichen, da es häufig einen dreifach negativen Phänotyp aufweist.
Patientinnen und Methoden: Wir identifizierten Frauen, bei denen in den Jahren 2010-2014 in der National Cancer Data Base ein invasives BC diagnostiziert wurde, und verglichen anhand einer univariaten Analyse die Ausgangsdaten der Patientinnen und die Tumormerkmale nach BC-Subtyp. Das Gesamtüberleben (OS) wurde mit der Kaplan-Meier-Methode geschätzt, und multivariate Cox-Proportional-Hazards-Modelle wurden verwendet, um unabhängige Prädiktoren für das OS zu ermitteln.
Ergebnisse: Von 247.355 Fällen waren 2.084 (0,8%) metaplastisches BC, 55.998 (23%) triple-negatives BC und 77% anderes BC. Im Vergleich zu nicht metaplastischem BC waren Frauen mit metaplastischem BC bei der Diagnose häufiger älter (mittleres Alter 62 vs. 59 Jahre), hatten ≥1 Begleiterkrankung (22% vs. 18%) und bezogen Medicare (41% vs. 33%; P<0,001). Metaplastische BCs waren tendenziell basal-ähnlich (77 %), und im Vergleich zu triple-negativen oder anderen BCs waren metaplastische BCs mit einem höheren klinischen T-Status (cT3-4, 18 % vs. 11 %, 8 %), keiner klinischen Nodalbeteiligung (cN0, 86 %, 77 %, 80 %), keiner lymphatischen Invasion (72 %, 65 %, 62 %) und hochgradigen Tumoren (71 %, 77 %, 35 %) assoziiert (P<0,001). Die meisten metaplastischen BCs wurden mit Mastektomie (58 %), Sentinel-Lymphknotendissektion (65 %), Brustwand- oder Brustbestrahlung (74 %) und Chemotherapie (75 %) als adjuvante Therapie (60 %) behandelt. Bei einer medianen Nachbeobachtungszeit von 44,5 Monaten waren die OS-Raten bei metaplastischem BC in allen klinischen Stadien nach 5 Jahren (Stadium I, 85%, 87%, 91%; II, 73%, 77%, 87%; III, 43%, 53%, 75%) und nach 3 Jahren (Stadium IV, 15%, 22%, 64%; P<0,001) niedriger als bei dreifach negativem oder anderem BC. Eine multivariate Analyse ergab, dass ein höheres Alter, ein fortgeschrittenes klinisches Stadium, eine lymphatische Invasion, eine axilläre (im Gegensatz zu einer Sentinel-) Nodendissektion sowie eine fehlende Strahlen- oder Chemotherapie mit schlechteren Überlebenschancen bei metaplastischem BC verbunden waren. Der Umfang der Operation beeinflusste das Überleben bei dreifach negativem und anderem BC, nicht aber bei metaplastischem BC.
Schlussfolgerung: Die Überlebenschancen für metaplastisches BC sind trotz moderner Behandlungsmethoden weiterhin schlechter als für andere BC-Subtypen. Die Optimierung der systemischen Therapieoptionen, die ein signifikanter Prädiktor für das Überleben war, sollte bei der Behandlung des metaplastischen BC Priorität haben.
Schlüsselwörter: metaplastisches Mammakarzinom, dreifach negatives Mammakarzinom, Ergebnisse bei Brustkrebs, Strahlentherapie, Chemotherapie.
Einführung
Obwohl Brustkrebs mit jährlich mehr als 268.000 dokumentierten Fällen die häufigste Krebsdiagnose bei Frauen ist, macht das metaplastische Mammakarzinom (BC) weniger als 1 %-2 % aller Brustkrebsfälle aus. Klinisch äußert sich metaplastischer Brustkrebs als schnell wachsende Brustmasse mit komplexer Echogenität (d. h. mit festen und zystischen Komponenten) im Ultraschall und als Masse mit hoher Dichte in der Mammographie. Histologisch besteht das metaplastische BC aus einer heterogenen Population von Tumoren, die durch das Vorhandensein von nicht drüsigen oder mesenchymalen Zelltypen oder durch eine weitere Einteilung in Subtypen in Abhängigkeit vom Vorhandensein verschiedener Merkmale wie osteoklastische Riesenzellen oder Spindelzellen klassifiziert werden können.
Bei der Präsentation ist die Rate des klinischen Lymphknotenbefalls beim metaplastischen BC typischerweise gering. Allerdings wird das metaplastische BC aufgrund größerer Primärtumore im Vergleich zu anderen BCs häufiger in fortgeschrittenen klinischen Stadien diagnostiziert und ist mit höheren Raten von Chemoresistenz, Fernmetastasierung und schlechterem Gesamtüberleben verbunden. Beim metaplastischen BC ist der dreifach negative Rezeptorstatus oder das Fehlen von Östrogenrezeptor-, Progesteronrezeptor- und humanem epidermalen Wachstumsfaktorrezeptor 2 (HER2)-Amplifikation besonders häufig anzutreffen. Ohne zielgerichtete Proteine bleibt die Behandlung des metaplastischen BC eine Herausforderung. Angesichts der Seltenheit der Diagnose sind prospektive Daten für die Auswahl der besten Behandlung des metaplastischen BC begrenzt. Stattdessen wurde ein Großteil des derzeitigen Behandlungsstandards für metaplastisches BC aus den Ergebnissen kleiner Serien oder Fallberichten einzelner Einrichtungen extrapoliert. Wir haben daher die National Cancer Data Base (NCDB), in der etwa 70 % aller diagnostizierten Krebsfälle in den Vereinigten Staaten erfasst sind, genutzt, um die Merkmale, die Behandlung und die Ergebnisse von Patienten mit metaplastischem BC im Vergleich zu Patienten mit dreifach negativem BC und allen anderen BC-Subtypen zu bewerten. Wir haben außerdem eine multivariate Analyse durchgeführt, um unabhängige Prädiktoren für das Überleben von Frauen mit metaplastischem BC zu ermitteln.
Datenquelle und Kohortenauswahl
Als gemeinsames Projekt, das 1989 von der Commission on Cancer des American College of Surgeons und der American Cancer Society ins Leben gerufen wurde, hat die NCDB onkologische Daten von etwa 1.500 akkreditierten Einrichtungen in den Vereinigten Staaten gesammelt, die insgesamt über 34 Millionen Datensätze umfassen. Die verfügbaren Patientendaten sind de-identifiziert und daher von der Überwachung durch den institutionellen Prüfungsausschuss ausgenommen.
Die für diese Studie verwendeten Auswahlkriterien sind in Abbildung 1 dargestellt. Eingeschlossen wurden Frauen im Alter von 18 Jahren und älter, bei denen zwischen 2010 und 2014 invasiver Brustkrebs diagnostiziert wurde. Patientinnen mit unbekanntem Hormonrezeptorstatus (Östrogen und Progesteron) wurden ausgeschlossen. Weitere Ausschlussgründe waren fehlende Angaben zu Operation, Chemotherapie oder klinischem Staging nach der 6. oder 7. Auflage des American Joint Committee On Cancer (AJCC). Anschließend wurden die Patienten in drei Gruppen eingeteilt: 1 – metaplastischer BC (mit den Histologiecodes 8575 oder 8573), 2 – triple-negativer BC (TNBC, der nur nicht-metaplastische Histologien umfasst) und 3 – alle übrigen BC-Typen. Der Begriff „nicht-metaplastischer BC“ wurde verwendet, um sich auf dreifach-negativen BC und anderen BC zusammen zu beziehen.
CONSORT-Diagramm. BC, Brustkrebs.
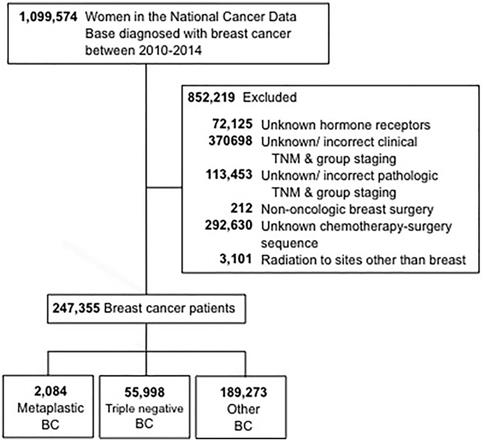 (Zum Vergrößern auf das Bild klicken.)
(Zum Vergrößern auf das Bild klicken.)
Variablen
Informationen, die aus der NCDB gewonnen und analysiert wurden, umfassten das Alter der Patientin bei der Diagnose, das Jahr der Diagnose, die Rasse, den Charlson/Deyo-Komorbiditätsindex, den Krankenversicherungsstatus, das mittlere Haushaltseinkommen und den Typ der behandelnden Einrichtung (dichotomisiert in akademisch/forschend und nicht-akademisch). Zu den klinisch-pathologischen Merkmalen gehörten die klinische T- und N-Bezeichnung nach AJCC, die gesamte klinische AJCC-Stadiengruppe, der HR-Status, der HER2-Rezeptorstatus, der Tumorgrad und die lymphovaskuläre Invasion (LVSI). Molekulare Subtypen wurden definiert als HR(+)/HER2(-), HER2(+), dreifach negativ (Östrogenrezeptor(-), Progesteronrezeptor (-), HER2(-)) oder unbekannt. Patientinnen mit metaplastischem BC mit triple-negativem Rezeptorstatus wurden als tn-metaplastischer BC bezeichnet, um sie von nicht-metaplastischem TNBC zu unterscheiden. Die primäre Behandlung umfasste chirurgische Eingriffe (entweder brusterhaltend, Mastektomie oder keine), Strahlentherapie mit oder ohne Einbeziehung der regionalen Knotenbestrahlung, Chemotherapie (neoadjuvant, adjuvant oder keine) und Hormontherapie. Die chirurgische Behandlung der Achselhöhle wurde entweder als Axilladissektion (ALND) definiert, bei der 10 oder mehr Lymphknoten entfernt wurden, oder als Sentinel-Lymphknotendissektion (SLND), wenn <10 Lymphknoten entfernt wurden.
Statistische Analyse
Die univariate Analyse wurde verwendet, um potenzielle Assoziationen zwischen demografischen, Tumor- und klinischen Merkmalen und der Diagnose eines metaplastischen BC zu bewerten, wobei Chi-Quadrat-Tests für kategorische Variablen und t-Tests/Varianzanalysen oder ihre Gegenstücke der nichtparametrischen Ansätze (Wilcoxon-Rangsumme oder Kruskal-Wallis) für kontinuierliche Variablen verwendet wurden. OS wurde definiert als vom Zeitpunkt der Diagnose bis zum Zeitpunkt des Todes. Die OS-Zeit für die überlebenden Patienten wurde zum Zeitpunkt des letzten Kontakts rechtszensiert. Die Verteilung des OS wurde anhand der Kaplan-Meier-Methode geschätzt. Der Log-Rank-Test wurde verwendet, um den Unterschied im Überleben zwischen den Gruppen zu testen. Für das OS wurden Regressionsanalysen der Überlebensdaten auf der Grundlage des proportionalen Cox-Hazard-Modells durchgeführt. Ein multivariates Cox-Proportional-Hazards-Modell wurde erstellt, indem zunächst eine Reihe von Kandidaten-Prädiktorvariablen mit einem P-Wert < 0,05 in die univariate Analyse einbezogen wurden. Dann wurde schrittweise rückwärts eliminiert, wobei 0,05 das Signifikanzniveau des Wald-Chi-Quadrats für einen Effekt war, der im Modell verbleiben sollte.
Die Überlebensanalysen wurden für jeden Krebstyp getrennt durchgeführt.
Der Standort und der Typ des metaplastischen BC wurden bei der Auswahl des Modells nicht berücksichtigt, da keiner der beiden Faktoren für diese Gruppe in der univariaten Analyse statistisch signifikant war und die Daten für Patienten unter 40 Jahren nicht vollständig verfügbar waren. Um herauszufinden, ob Details der systemischen Therapie und der Bestrahlung die Ergebnisse bei Patienten mit metaplastischem BC beeinflussten, führten wir Subgruppenanalysen für diese Kohorte durch, um den potenziellen Einfluss der Chemotherapieabfolge und des Ausmaßes der Bestrahlungsziele auf das OS zu bewerten. Alle Tests waren zweiseitige Tests, und statistische Signifikanz war definiert als ein P-Wert <0,05. SAS Version 9.4 (SAS Institute, Cary, NC) und S-Plus Version 8.2 (TIBCO Software Inc., Palo Alto, CA) wurden zur Durchführung der Berechnungen für alle Analysen verwendet.
Kohorten- und Tumormerkmale
Wir identifizierten 247.355 Frauen mit einer Diagnose von invasivem Brustkrebs in den Jahren 2010-2014, von denen 0,8% (n=2.084) metaplastischen BC, 23% (n=55.998) TNBC und 77% (n=189.273) anderen BC hatten. Die soziodemografischen, klinischen und pathologischen Tumormerkmale der Patienten sowie die Behandlungsmerkmale nach BC-Typ sind in Tabelle 1 aufgeführt. Das mittlere Alter betrug 63 Jahre (Spanne 22-90) bei Frauen mit metaplastischem BC und 59 Jahre (Spanne 18-90) bei Frauen mit TNBC und anderem BC. Frauen mit metaplastischem BC hatten häufiger einen Komorbiditäts-Score von ≥1 (22% vs. 18% TNBC vs. 16% andere BC) und waren öffentlich versichert (50% vs. 42% TNBC vs. 41% andere BC) (alle P<0,001). Die Diagnose metaplastischer BC oder TNBC war häufiger mit schwarzer Hautfarbe assoziiert als andere BC (18% vs. 21% vs. 11%, P<0,001).
Signifikante Unterschiede im klinischen Krankheitsstadium und bei den Tumormerkmalen wurden nach Krebsart festgestellt. Metaplastischer BC wurde häufig in fortgeschritteneren Stadien diagnostiziert, wobei nur 31 % der Patienten mit metaplastischem BC ein klinisches Stadium I aufwiesen gegenüber 46 % bei TNBC und 54 % bei anderem BC (P<0,001). Dieses Muster schien mit höheren Raten größerer Tumoren in der metaplastischen BC-Gruppe zu korrelieren (cT3-4, 18% vs. 11% vs. 8%), aber das Vorhandensein einer klinischen Knotenbeteiligung war bei metaplastischem BC am geringsten (cN1-3, 14% vs. 23% vs. 20%) (alle P<0,001). Im Gegensatz zum klinischen Nodalstatus war die Rate der pathologischen Nodalbeteiligung bei metaplastischem BC und TNBC etwas niedriger, bei anderem BC jedoch doppelt so hoch (pN1-3, 18% vs. 26% vs. 40%, jeweils P<0,001). Hinsichtlich des Rezeptorstatus wiesen 77 % der metaplastischen BC-Gruppe einen tn-metaplastischen BC auf, was 3,4-mal höher ist als in der Gruppe der nicht-metaplastischen BC (23 %), wobei HR(+)/HER2(-) mit 59 % der häufigste molekulare Subtyp war (P<0,001). Außerdem wiesen nur 5 % der metaplastischen BC HER2(+) auf, verglichen mit 16 % der nicht metaplastischen BC. Sowohl metaplastischer BC als auch TNBC wiesen einen fast doppelt so hohen Anteil an Tumoren des Grades 3 auf wie andere BC (71 %, 77 % bzw. 35 %, P<0,001), und metaplastischer BC hatte geringere LVSI-Raten als TNBC und andere BC (13 %, 20 % bzw. 24 %, P<0,001).
Patienten- und Behandlungsmerkmale.
| Merkmal | Metaplastisches BC, Nr. (%) | Triple-Negatives BC, Nr. (%) | Anderes BC, Nr. (%) | P-Wert |
|---|---|---|---|---|
| Medianes Alter, Jahre (Bereich) | 62 (22-90) | 59 (18-90) | 59 (18-90) | <0.001 |
| Rasse | ||||
| Weiß | 1623 (77.9) | 41791 (74.6) | 158406 (83.7) | <0.001 |
| Schwarz | 368 (17.7) | 11771 (21) | 20722 (10.9) | |
| Andere | 80 (3.8) | 2041 (3.6) | 8507 (4.5) | |
| Unbekannt | 13 (0.6) | 395 (0.7) | 1638 (0.9) | |
| Komorbiditätsscore | ||||
| 0 | 1635 (78.5) | 45882 (81.9) | 158177 (83.6) | <0.001 |
| 1 | 349 (16.7) | 8107 (14.5) | 25524 (13.5) | |
| >=2 | 100 (4.8) | 2009 (3.6) | 5572 (2.9) | |
| Medianeinkommen | ||||
| <$30.000 | 251 (12) | 7110 (12.7) | 19154 (10.) | <0.001 |
| $30,000-$34,999 | 332 (15.9) | 9081 (16.2) | 28472 (15) | |
| $35,000-$45,999 | 580 (27.8) | 15084 (26.9) | 48845 (25.8) | |
| $46,000+ | 858 (41.2) | 23050 (41.2) | 86637 (45.8) | |
| Unbekannt | 63 (3) | 1673 (3) | 6165 (3.3) | |
| Krankenversicherung | ||||
| Privat | 975 (46.8) | 30263 (54) | 105839 (55.9) | <0.001 |
| Medicaid | 154 (7.4) | 4716 (8.4) | 13267 (7) | |
| Medicare | 862 (41.4) | 18355 (32.8) | 61535 (32.5) | |
| Sonstige | 19 (0.9) | 665 (1.2) | 2212 (1.2) | |
| Unversichert | 43 (2.1) | 1422 (2.5) | 4163 (2.2) | |
| Unbekannt | 31 (1.5) | 577 (1) | 2257 (1.2) | |
| Landkreistyp | ||||
| Metropolitan | 1720 (82.5) | 46252 (82.6) | 157058 (83) | 0.152 |
| Urban | 271 (13) | 7456 (13.3) | 24367 (12.9) | |
| Ländlich | 43 (2.1) | 951 (1.7) | 3219 (1.7) | |
| Unbekannt | 50 (2.4) | 1339 (2.4) | 4629 (2.4) | |
| Einrichtungstyp | ||||
| Akademisch | 668 (32.1) | 16117 (28.8) | 52120 (27.5) | <0.001 |
| Nichtakademisch | 1318 (63.2) | 35472 (63.3) | 126101 (66.6) | |
| Unbekannt | 98 (4.7) | 4409 (7.9) | 11052 (5.8) | |
| Standort | ||||
| Mittlerer Westen | 614 (29.5) | 14132 (25.2) | 46644 (24.6) | <0.001 |
| Nordost | 410 (19.7) | 10411 (18.6) | 37787 (20) | |
| Süd | 716 (34.4) | 20595 (36.8) | 66519 (35.1) | |
| West | 246 (11.8) | 6451 (11.5) | 27271 (14.4) | |
| Unbekannt | 98 (4.7) | 4409 (7.9) | 11052 (5.8) | |
| Klinisches Krankheitsstadium | ||||
| I | 639 (30.7) | 25843 (46.1) | 102257 (54) | <0.001 |
| II | 1215 (58.3) | 23912 (42.7) | 70846 (37.4) | |
| III | 201 (9.6) | 5579 (10) | 14283 (7.5) | |
| IV | 29 (1.4) | 664 (1.2) | 1887 (1) | |
| Klinischer T-Status | ||||
| cT0 | 5 (0.2) | 131 (0.2) | 341 (0.2) | <0.001 |
| cT1 | 674 (32.3) | 28452 (50.8) | 113113 (59.8) | |
| cT2 | 1026 (49.2) | 21530 (38.4) | 61145 (32.3) | |
| cT3 | 252 (12.1) | 3702 (6.6) | 10061 (5.3) | |
| cT4 | 127 (6.1) | 2183 (3.9) | 4613 (2.4) | |
| Klinischer N-Status | ||||
| cN0 | 1787 (85.7) | 43357 (77.4) | 150890 (79.7) | <0.001 |
| cN1 | 224 (10.7) | 9659 (17.2) | 30427 (16.1) | |
| cN2 | 51 (2.4) | 1804 (3.2) | 5414 (2.9) | |
| cN3 | 22 (1.1) | 1178 (2.1) | 2542 (1.3) | |
| Pathologisches Stadium | ||||
| 0 | 45 (2.2) | 4314 (7.7) | 5361 (2.8) | <0.001 |
| 1 | 582 (27.9) | 24787 (44.3) | 81680 (43.2) | |
| 2 | 1223 (58.7) | 20790 (37.1) | 72445 (38.3) | |
| 3 | 210 (10.1) | 5675( 10.1) | 28323 (15) | |
| 4 | 24 (1.2) | 432 (0.8) | 1464 (0.8) | |
| Pathologischer T-Status | ||||
| pTis | 7 (0.3) | 432 (0.8) | 1862 (1) | <0.001 |
| pT0 | 42 (2) | 4250 (7.6) | 3972 (2.1) | |
| pT1 | 634 (30.4) | 29055 (51.9) | 106130 (56.1) | |
| pT2 | 1017 (48.8) | 18530 (33.1) | 63484 (33.5) | |
| pT3 | 290 (13.9) | 2540 (4.5) | 10588 (5.6) | |
| pT4 | 93 (4.5) | 1097 (2) | 2892 (1.5) | |
| pTX | 1 (0) | 94 (0.2) | 345 (0.2) | |
| Pathologischer N-Status | ||||
| pN0 | 1705 (81.9) | 41587 (74.3) | 113787 (60.2) | <0.001 |
| pN1 | 284 (13.6) | 9725 (17.4) | 51483 (27.2) | |
| pN2 | 66 (3.2) | 3031 (5.4) | 16111 (8.5) | |
| pN3 | 27 (1.3) | 1607 (2.9) | 7685 (4.1) | |
| Rezeptorgruppierung | ||||
| HR(+)/HER2(-) | 334 (16) | 0 (0) | 143687 (75.9) | <0.001 |
| Dreifach negativ | 1604 (77) | 55998 (100) | 0 (0) | |
| HER2(+) | 97 (4.7) | 0 (0) | 38726 (20.5) | |
| Unbekannt | 49 (2.4) | 0 (0) | 6860 (3.6) | |
| Tumorgrad | ||||
| 1 | 41 (2) | 988 (1.8) | 32015 (16.9) | <0.001 |
| 2 | 237 (11.4) | 9050 (16.2) | 80590 (42.6) | |
| 3 | 1485 (71.3) | 42930 (76.7) | 65482 (34.6) | |
| 4 | 37 (1.8) | 286 (0.5) | 438 (0.2) | |
| Unbekannt | 284 (13.6) | 3030 (5.4) | 11186 (5.9) | |
| LVSI | ||||
| Nicht vorhanden | 1505 (72.2) | 36400 (65) | 118082 (62.4) | <0.001 |
| anwesend | 263 (12.6) | 11091 (19.8) | 45681 (24.1) | |
| Unbekannt | 316 (15.2) | 8507 (15.1) | 25510 (13.4) | |
| Art der Operation | ||||
| BCS | 876 (42) | 29142 (52) | 92022 (48.6) | <0.001 |
| Mastektomie | 1200 (57.6) | 26561 (47.4) | 95910 (50.7) | |
| Keine Operation | 8 (0.4) | 295 (0.5) | 1341 (0.7) | |
| Axillar-Chirurgie | ||||
| Kein Eingriff | 47 (2.3) | 1034 (1.8) | 4433 (2.3) | <.001 |
| SLND | 1353 (64.9) | 34880 (62.3) | 109718 (58) | |
| ALND | 666 (32) | 19229 (34.3) | 73181 (38.7) | |
| Unbekannt | 18 (0.9) | 855 (1.5) | 1941 (1) | |
| Strahlentherapie | ||||
| Ja | 1087 (52.2) | 33938 (60.6) | 109268 (57.7) | <.001 |
| Nein | 989 (47.5) | 21860 (39) | 79375 (41.9) | |
| Unbekannt | 8 (0.4) | 200 (0.4) | 630 (0.3) | |
| Bestrahlungsziele | ||||
| Nur Brust/CW | 803 (73.9) | 24704 (72.8) | 72410 (66.3) | <0.001 |
| Brust/CW + regionale Knoten | 284 (26.1) | 9234 (27.2) | 36858 (33.7) | |
| Chemotherapie | ||||
| Ja | 1571 (75.4) | 44321 (79.1) | 133965 (70.8) | <0.001 |
| Nein | 499 (23.9) | 11195 (20) | 53062 (28) | |
| Unbekannt | 14 (0.7) | 482 (0.9) | 2246 (1.2) | |
| Chemotherapie-zu-Chirurgie-Sequenz | ||||
| Adjuvant | 1241 (59,5) | 31519 (56.3) | 116645 (61.6) | <0.001 |
| Neoadjuvant | 324 (15.5) | 12581 (22.5) | 16717 (8.8) | |
| Keine | 519 (24.9) | 11898 (21.2) | 55911 (29.5) | |
| Hormontherapie | ||||
| Ja | 220 (10.6) | 1178 (2.1) | 103906 (54.9) | <0.001 |
| Nein | 1798 (86.3) | 53274 (95.1) | 76820 (40.6) | |
| Unbekannt | 66 (3.2) | 1546 (2.8) | 8547 (4.5) | |
| Jahr der Diagnose | ||||
| 2010 | 309 (14.8) | 9605 (17.2) | 36712 (19.4) | <0.001 |
| 2011 | 393 (18.9) | 11163 (19.9) | 38815 (20.5) | |
| 2012 | 458 (22) | 11205 (20) | 39364 (20.8) | |
| 2013 | 463 (22.2) | 11992 (21.4) | 37764 (20) | |
| 2014 | 461 (22.1) | 12033 (21.5) | 36618 (19.3) |
Abkürzungen: BC, Brustkrebs; ALND, axilläre Lymphknotendissektion; BCS, brusterhaltende Chirurgie; CW, Brustwand; HER2, humaner epidermaler Wachstumsfaktorrezeptor; HR, Hormonrezeptor; LVSI, lymphovaskuläre Invasion; SLND, Sentinel Lymph Node Dissection.
Behandlung nach Brustkrebsart
Die meisten Patientinnen (99 %) unterzogen sich einer onkologischen Brustoperation, einschließlich der chirurgischen Beurteilung der Axilla (97 %). Die Mastektomie wurde in der Gruppe der metaplastischen BC häufiger durchgeführt (58% vs. 47% TNBC vs. 51% andere BC, P<0,001), ebenso die SLND (65% vs. 62% TNBC vs. 58% andere BC; P<0,001). Eine regionale Nodalbestrahlung wurde häufiger als Teil der Behandlung für andere BC als für metaplastische BC und TNBC eingesetzt (26%, 27% und 34%; P<0,001).
Im Hinblick auf die systemische Therapie wurde eine neoadjuvante Chemotherapie fast doppelt so häufig für metaplastische BC und TNBC als für andere BC eingesetzt (16%, 23%, 9%; P<0,001), und etwa ein Viertel aller Frauen erhielt keine Chemotherapie. Eine Hormontherapie wurde bei TNBC am seltensten eingesetzt (2 %), war aber bei 11 % der metaplastischen BC und 55 % der anderen BC-Fälle Teil des Behandlungsparadigmas.
Überlebensanalyse
Die mediane Nachbeobachtungszeit betrug 44,5 Monate. Patienten mit metaplastischem BC hatten unabhängig vom klinischen Stadium ein signifikant schlechteres unbereinigtes OS (Abb. 2). Die 5-Jahres-OS-Schätzungen für Patienten mit metaplastischem BC, TNBC und anderem BC im Stadium I betrugen 85%, 87% und 91%, für Stadium II 73%, 77% und 87% und für Stadium III 43%, 53% und 75% (P<0,001). Die 3-Jahres-OS-Raten für Patienten mit metastasierter Erkrankung waren bei TNBC und anderen BC-Gruppen mit 30% und 64% 2-4 mal höher als bei metaplastischem BC mit 15% (P<0,001). Auch das Überleben nach molekularem Subtyp wurde analysiert (Abb. 3). Bei Patienten mit metaplastischem BC waren keine Unterschiede im OS nach molekularem Subtyp (HR(+)/HER2(-), HER2(+) oder tn-metaplastischem BC) erkennbar (P=0,778). Im Gegensatz dazu war bei nicht-metaplastischem BC der dreifach-negative Subtyp mit einem schlechteren OS verbunden als die Subtypen HER+ und HR(+)/HER2(-) (P<0,001). Auch die Rasse schien bei Patientinnen mit metaplastischem BC nicht mit dem Überleben assoziiert zu sein (5-Jahres-OS-Raten 73% für Weiße vs. 74% für Schwarze, P=0,876), während die Rasse sowohl bei TNBC (P<0,001) als auch bei anderen BC-Gruppen (P<0,001; Abb. 4) mit dem OS assoziiert war.
Gesamtüberlebenskurven von Brustkrebstypen nach klinischem Stadium, wobei metaplastischer, triple-negativer und anderer Brustkrebs untersucht wurde. Abkürzungen: MBC, metaplastischer Brustkrebs.
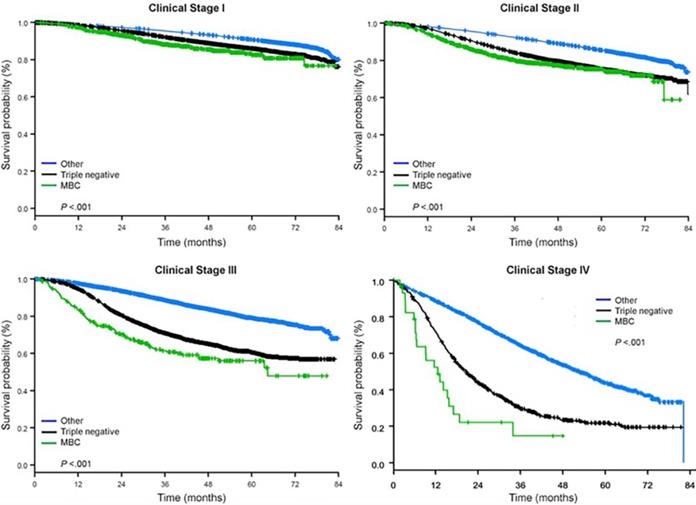 (Zum Vergrößern auf das Bild klicken.)
(Zum Vergrößern auf das Bild klicken.)
Gesamtüberlebenskurven für Patientinnen mit metaplastischem und nicht-metaplastischem Brustkrebs, geschichtet nach Rezeptorstatus. Abkürzungen: HER2, humaner epidermaler Wachstumsfaktor-Rezeptor 2; HR, Hormonrezeptor; MBC, metaplastischer Brustkrebs.
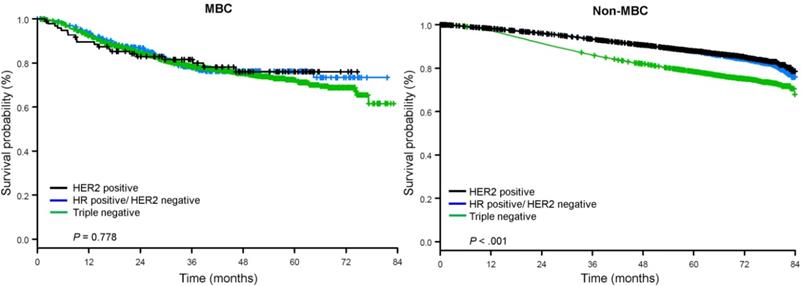 (Zum Vergrößern auf das Bild klicken.)
(Zum Vergrößern auf das Bild klicken.)
Gesamtüberlebenskurven für Patienten mit metaplastischem, dreifach negativem und anderem Brustkrebs, geschichtet nach Rasse. Abkürzungen: BC, Brustkrebs.
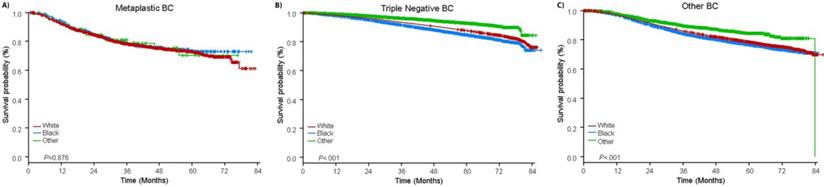 (Zum Vergrößern auf das Bild klicken.)
(Zum Vergrößern auf das Bild klicken.)
Multivariable Analyse der mit dem Gesamtüberleben assoziierten Faktoren für Patientinnen mit metaplastischem BC.
| Faktoren im Zusammenhang mit dem Gesamtüberleben bei metaplastischem BC | |||
|---|---|---|---|
| Variable (Referenz) | Gefährdungsquotient (95% Konfidenzintervall) | P-Wert | |
| Alter | Pro Jahr Zunahme | 1.024 (1,015-1,033) | <0,0001 |
| Lymphgefäßinvasion (keine) | Vorhanden | 1,307 (1,017-1,679) | 0.0364 |
| Klinischer N-Status (cN0) | cN+ | 1,758 (1,328-2,326) | <0.0001 |
| Klinischer T-Status (cT1) | cT0 | 2,226 (0,301-16.447) | <0,0001 |
| cT2 | 1,454 (1,102-1.918) | ||
| cT3 | 3,029 (2,183-4,204) | ||
| cT4 | 3.145 (2.124-4.657) | ||
| Klinischer M-Status (cM0) | cM1 | 3.330 (2.020-5.488) | <0.0001 |
| Axillar-Chirurgie (SLND) | ALND | 1.333 (1,065-1,670) | 0,0247 |
| Keine Operation | 1,538 (0.884-2.675) | ||
| Bestrahlung (Nein) | Ja | 0.709 (0.572-0.878) | 0.0016 |
| Chemotherapie (Nein) | Ja | 0.579 (0.446-0.752) | <0.0001 |
Abkürzungen: ALND, Axilläre Lymphknotendissektion; BC, Brustkrebs; SLND, Sentinel-Lymphknotendissektion.
Bei der multivariaten Analyse korrelierten zunehmendes Alter, eine höhere klinische T-Klassifikation, das Vorhandensein einer klinischen Nodalerkrankung oder LVSI und die Behandlung mit ALND mit schlechteren Ergebnissen für Patienten mit metaplastischem BC, TNBC und anderem BC (ergänzende Tabelle 1). Sowohl die zusätzliche Chemo- als auch die Strahlentherapie verbesserten unabhängig voneinander das OS, unabhängig vom Brustkrebstyp. Andere Patienten- und Tumormerkmale, die mit dem Überleben bei TNBC und anderem BC assoziiert sind, einschließlich Rasse, Komorbiditäten und Tumorgrad, waren bei der multivariaten Analyse nicht mit den Überlebensergebnissen bei metaplastischem BC assoziiert.
Angesichts der relativ schlechten Ergebnisse bei Patientinnen mit metaplastischem BC wurden Subgruppenanalysen für die Gruppe des metaplastischen BC durchgeführt, um festzustellen, ob irgendwelche Behandlungsmodalitäten mit verbesserten Ergebnissen assoziiert waren. Nach Anpassung an den Nodalstatus (cN0 vs. N+) war die Behandlung mit einer aggressiveren axillären Operation (ALND vs. SLND) mit schlechteren Ergebnissen verbunden, ein Phänomen, das auch bei TNBC und anderen BC beobachtet wurde (Tabelle 2). Bei den Patienten, die eine Strahlentherapie erhielten, hatte die Behandlung mit regionaler Nodalbestrahlung im Vergleich zur Bestrahlung nur der Brust oder der Brustwand keinen signifikanten Einfluss auf die Ergebnisse bei Patienten mit metaplastischem BC (P=0,077 und 0,200 für klinisches N0 bzw. N+). Eine neoadjuvante Chemotherapie war mit schlechteren Ergebnissen verbunden als eine adjuvante Chemotherapie bei Patienten mit klinisch knotennegativem metaplastischem BC (HR 1,9, 95% CI 1,3-2,6, P<0.001), nicht aber bei Patientinnen mit klinisch knotenpositivem metaplastischem BC (P=0,43).
Diskussion
Metaplastischer Brustkrebs ist eine seltene, aber besonders aggressive Form von Brustkrebs, vor allem im Vergleich zu anderen Brusttumor-Subtypen. Diese Krankheitsentität ist in der Literatur bisher relativ unterrepräsentiert. Eine umfangreiche Suche von Rayson et al. nach Veröffentlichungen aus den Jahren 1966 bis 1997 ergab insgesamt nur 27 Fälle. Große nationale Datenbanken wie die NCDB sind für die Untersuchung seltener Krebsarten wie dem metaplastischen BC von Vorteil. Allerdings ist die Inzidenz der Diagnose metaplastisches BC in den Vereinigten Staaten laut diesen Datenbanken mit weniger als 500 Fällen pro Jahr immer noch gering. In unserer Studie stellten wir fest, dass metaplastisches BC am häufigsten als großer Tumor mit ungünstigen Risikomerkmalen wie schlecht differenziertem Tumorgrad und dreifach-negativem Rezeptorstatus diagnostiziert wurde. Patienten mit metaplastischem BC hatten unabhängig vom Stadium bei der Diagnosestellung ein deutlich schlechteres Überleben als Patienten mit triple-negativem und anderem BC. Der Erhalt einer Chemo- und Strahlentherapie war ein unabhängiger Prädiktor für ein besseres Überleben, aber die Reihenfolge der Chemotherapie schien die Ergebnisse zu beeinflussen, insbesondere bei Patienten mit metaplastischem BC ohne klinische Nodalbeteiligung, obwohl einige dieser Patienten eine pathologische Nodalbeteiligung hatten. Unsere Ergebnisse spiegeln jedoch möglicherweise die Heterogenität der zugrundeliegenden biologischen Mechanismen wider, die das Ansprechen auf Behandlungen in dieser speziellen Gruppe von BC-Patienten bestimmen, und unterstreichen die Notwendigkeit einer besseren Risikostratifizierung und systemischer Therapieoptionen, um die Ergebnisse zu verbessern.
Obwohl die meisten metaplastischen BCs einen dreifach negativen Phänotyp aufweisen, scheint das Verhalten der metaplastischen BCs im Vergleich zu anderen TNBCs einzigartig zu sein. TNBC hat in der Regel eine schlechtere Prognose als andere BC-Typen, und die Annahme, dass metaplastischer BC aggressiver ist als TNBC, wurde durch mehrere kleinere, retrospektive Untersuchungen bestätigt. Diese Studien haben ähnliche Diagnosemuster in fortgeschrittenen Stadien für metaplastischen BC im Vergleich zu TNBC gezeigt, und zwar aufgrund höherer Raten von cT3-4-Erkrankungen und nicht von Knotenbefall. In einer Überprüfung von 46 Fällen von metaplastischem BC durch eine einzige Einrichtung hatten Patienten mit metaplastischem BC ein signifikant höheres Risiko für ein lokales Krankheitsrezidiv (30 % gegenüber 15 %; P=0,004). Diese Merkmale korrelierten schließlich mit schlechteren 5-Jahres-Überlebensraten (30% vs. 90%; P<0,001) und OS-Raten (65% vs. 87%; P=0,002) für Patienten mit metaplastischem BC im Vergleich zu TNBC. Eine Surveillance-Epidemiology-and-End-Results-Studie mit 1 1112 Patienten mit metaplastischem BC ergab ebenfalls schlechtere krebsspezifische Überlebensraten nach 3 Jahren für metaplastischen BC als für TNBC (78 % vs. 84 %). Bei der Untersuchung von tn-metaplastischem BC fanden Li et al. ein schlechteres krankheitsfreies Überleben (HR 1,48, 95% CI 1,19-1,84, P<0,01) und OS (HR 1,42 ; P<.01) für tn-metaplastischen BC im Vergleich zu TNBC. Unsere Studie, in die eine der bisher größten Gruppen von Patienten mit metaplastischem BC einbezogen wurde (n=2.084), bestätigt diese Ergebnisse und unterstreicht, dass der Rezeptorstatus beim metaplastischen BC kein unabhängiger Prädiktor für das Überleben ist (P=0.
Eine entscheidende therapeutische Komponente, die bei allen metaplastischen BC-Patienten in unserer Studie mit verbesserten Überlebenschancen verbunden war, war der Einsatz einer Chemotherapie (HR 0,58, 95% CI 0,45-0,75, P<0,001). Unser Bericht ist unseres Wissens der erste, der über die Ergebnisse bei metaplastischem BC auf der Grundlage der Reihenfolge der Chemotherapie berichtet. Auffallend ist, dass unsere Subanalyse ergab, dass insbesondere bei Patienten mit metaplastischem BC mit cN0 die neoadjuvante Chemotherapie im Vergleich zur adjuvanten Chemotherapie mit einem schlechteren OS assoziiert war (HR 1,88, 95% CI 1,34-2,64, P<0,001), während die Sequenzierung der Chemotherapie bei klinisch knotenpositivem metaplastischem BC keinen Einfluss hatte. Eine mögliche Erklärung hierfür könnte sein, dass unsere Patienten mit metaplastischem BC einen höheren klinischen T-Status aufwiesen, der in anderen Berichten mit einer geringeren Rate an pathologischem vollständigem Ansprechen und damit schlechteren Überlebensergebnissen in Verbindung gebracht wurde. Darüber hinaus können klinische Staging-Methoden (d. h. allein die körperliche Untersuchung oder die Einbeziehung der Ultraschalluntersuchung) zu einer Heterogenität in einer klinischen N0-Population führen, da die tatsächliche nodale Krankheitslast nicht erfasst wird, was an sich schon mit schlechteren Ergebnissen verbunden sein kann. Insgesamt wurde berichtet, dass das metaplastische BC nur zu 18 % auf eine neoadjuvante Chemotherapie anspricht, was deutlich unter den bekannten Ansprechraten für TNBC auf Anthrazyklin- und Taxan-basierte Chemotherapieschemata liegt.
Aufgrund des schlechteren Überlebens und der relativ schnellen Entwicklung von Fernmetastasen im Vergleich zu anderen Brustkrebs-Subtypen, die in unserer Studie und in anderen Berichten festgestellt wurden, ist der Bedarf an besseren systemischen Therapieoptionen für das metaplastische BC klar ersichtlich. Die Erstellung von Transkriptionsprofilen hat gezeigt, dass dieser Krebssubtyp eine tumorigene Signatur mit stammzellartigen Merkmalen, häufigen Aberrationen im PI3K/AKT/mTOR-Signalweg und einer Überexpression des vaskulären endothelialen Wachstumsfaktors (VEGF) aufweist. Diese Merkmale ähneln denen, die bei mesenchymalen TNBCs zu finden sind. Derzeit werden vielversprechende Anstrengungen unternommen, um alternative systemische Therapieschemata für diese Patienten zu ermitteln, darunter eine kürzlich durchgeführte Phase-I-Studie, die bei Patienten mit metaplastischem TNBC mit einer Aberration des PI3K-Signalwegs verbesserte objektive Ansprechraten auf liposomales Doxorubicin, Bevacizumab (monoklonaler Antikörper gegen VEGF-A) und Everolimus (mTOR-Inhibitor) zeigte.
Im Hinblick auf lokale Behandlungen wurde in unserer Studie bei metaplastischem BC häufiger eine Mastektomie durchgeführt, die jedoch nicht mit einer verbesserten Überlebensrate im Vergleich zur brusterhaltenden Operation verbunden war. Auch wurde kein Überlebensvorteil durch eine Behandlung mit ALND gegenüber SLND festgestellt. Die Strahlentherapie war jedoch ein signifikanter Prädiktor für das Überleben: Bei Patientinnen mit metaplastischem BC, die mit einer adjuvanten Strahlentherapie behandelt wurden, war das Sterberisiko um 30 % geringer als bei Patientinnen, die keine Strahlentherapie erhielten. Zu den relevanten Einschränkungen unserer Strahlentherapie-Analyse gehören unbekannte Details in Bezug auf die Behandlungsplanung, die gewählte Modalität, die Qualitätssicherung oder die Frage, ob Techniken wie die tiefe inspirierende Atemanhaltung verwendet wurden. Während ein lokoregionales Rezidiv in der NCDB nicht untersucht werden kann, zeigte eine institutionelle Serie von 113 Patienten mit metaplastischem BC (von denen 54 % eine Strahlentherapie erhielten), dass die Bestrahlung der einzige Faktor war, der mit einem geringeren lokoregionalen Rezidiv korrelierte (relatives Risiko ohne Bestrahlung 3.1; 95% CI 1,13-9,88, P=0,027).
Unsere Ergebnisse sind mit Vorsicht zu interpretieren, da wir nicht wissen, welche Chemotherapieschemata verwendet wurden, wie lange die Behandlungen dauerten oder wie die neoadjuvante Chemotherapie ansprach, da diese Informationen in der NCDB nicht verfügbar sind. Wir sind uns auch der Grenzen der in der NCDB erfassten klinisch-pathologischen Risikofaktoren bewusst, ohne die es möglicherweise nicht möglich ist, die klinischen Unterschiede vollständig zu charakterisieren, die für einige der von uns gefundenen Ergebnisunterschiede verantwortlich sind, wie z. B. die schlechteren Überlebenschancen bei ALND, selbst wenn man den Lymphknotenstatus kontrolliert. Obwohl unsere Stichprobengröße von Patienten mit metaplastischem BC im Vergleich zu Studien mit nicht-metaplastischem BC klein war, handelt es sich paradoxerweise wahrscheinlich um die bisher größte Studie, die sich mit dieser Frage befasst, da in institutionellen Serien nur eine begrenzte Anzahl von Patienten mit metaplastischem BC gemeldet wurde. Weitere Untersuchungen sind erforderlich, um die biologische Prädilektion für die Ausbreitung von Metastasen beim metaplastischen BC zu verstehen und unsere Ergebnisse in separaten Datensätzen von Patienten mit metaplastischem BC zu validieren.
Unser derzeitiger Behandlungsstandard ist für diese einzigartige Krebspopulation eindeutig nicht angemessen, und die künftige Gewinnung randomisierter Daten zum metaplastischen BC wird aufgrund der geringen Patientenzahlen kooperative Anstrengungen erfordern. Die NCDB bietet eine bemerkenswerte Stärke, nämlich die Möglichkeit, Behandlungsmuster und Ergebnisse im Zusammenhang mit einer seltenen Diagnose zu untersuchen. Mit 2 084 Patienten mit metaplastischem BC in dieser Kohorte handelt es sich um eine der größten Untersuchungen zum metaplastischen BC, die in der Neuzeit durchgeführt wurden. Die Überlebensrate dieser Patienten ist im Vergleich zu Patienten mit anderen BC-Typen schlecht, und obwohl diese Tatsache wahrscheinlich den Einsatz einer aggressiven Therapie nahelegt, deutet unsere Studie darauf hin, dass eine umfassendere lokal-regionale Behandlung (z. B. ALND oder regionale Knotenbestrahlung) von Fall zu Fall sorgfältig geprüft werden sollte. Insgesamt ist der Einsatz einer systemischen Therapie für die Behandlung des metaplastischen BC unabhängig von der Knotenbelastung von entscheidender Bedeutung, und die Entwicklung wirksamer zielgerichteter Therapien auf der Grundlage der Analyse des genomischen Tumorprofils ist vielversprechend für die Zukunft.
Ergänzendes Material
![]()
Ergänzende Tabelle.
Danksagung
Besonderer Dank gilt Christine Wogan für redaktionelle Unterstützung.
Finanzierung
Teilweise unterstützt durch Cancer Center Support (Biostatistics Core) Grant CA016672 vom National Cancer Institute, National Institutes of Health, an The University of Texas MD Anderson Cancer Center.
Konkurrierende Interessen
Die Autoren haben erklärt, dass keine konkurrierenden Interessen bestehen.
1. Siegel RL, Miller KD, Jemal A. Cancer statistics, 2018. CA Cancer J Clin. 2018;68(1):7-30
2. Yerushalmi R, Hayes MM, Gelmon KA. Mammakarzinom – seltene Formen: ein Überblick über die Literatur. Ann Oncol. 2009;20(11):1763-1770
3. Günhan-Bilgen I, Memiş A, Ustün EE, Zekioglu O, Ozdemir N. Metaplastic carcinoma of the breast: clinical, mammographic, and sonographic findings with histopathologic correlation. AJR Am J Roentgenol. 2002;178(6):1421-1425
4. Jung S-Y, Kim HY, Nam B-H. et al. Worse prognosis of metaplastic breast cancer patients than other patients with triple-negative breast cancer. Breast Cancer Res Treat. 2010;120(3):627-637
5. Wargotz ES, Norris HJ. Metaplastische Karzinome der Brust: V. Metaplastisches Karzinom mit osteoklastischen Riesenzellen. Hum Pathol. 1990;21(11):1142-1150
6. Wargotz ES, Norris HJ. Metaplastische Karzinome der Brust. I. Matrix-produzierendes Karzinom. Hum Pathol. 1989;20(7):628-635
7. Wargotz ES, Deos PH, Norris HJ. Metaplastische Karzinome der Brust. II. Spindelzellkarzinom. Hum Pathol. 1989;20(8):732-740
8. Lee H, Jung S-Y, Ro JY. et al. Metaplastischer Brustkrebs: klinisch-pathologische Merkmale und seine Prognose. J Clin Pathol. 2012;65(5):441-446
9. He X, Ji J, Dong R. et al. Prognosis in different subtypes of metaplastic breast cancer: a population-based analysis. Breast Cancer Res Treat. October. 2018
10. National Cancer Database.
11. Chagpar AB, Scoggins CR, Martin RCG. et al. Factors Determining Adequacy of Axillary Node Dissection in Breast Cancer Patients. Breast J. 2007;13(3):233-237
12. Bembenek A, Schlag PM. Lymphknotendissektion bei Brustkrebs. Langenbeck’s Arch Surg. 2000;385(4):236-245
13. Woolson RF. Statistical Methods for the Analysis of Biomedical Data. New York, USA: John Wiley & Sons. 1987
14. Kaplan EL, Meier P. Nonparametric Estimation from Incomplete Observations NONPARAMETRIC ESTIMATION FROM INCOMPLETE OBSERVATIONS*. Quelle J Am Stat Assoc. 1958;53(282):457-481
15. Mantel N. Evaluation of survival data and two new rank order statistics arising in its consideration. Cancer Chemother Rep. 1966;50(3):163-170
16. D.R. C. Regressionsmodelle und Lebensdauertabellen. Cox Life Tables. 1972;2:187-220
17. Rayson D, Adjei AA, Suman VJ, Wold LE, Ingle JN. Metaplastischer Brustkrebs: Prognose und Ansprechen auf eine systemische Therapie. Ann Oncol Off J Eur Soc Med Oncol. 1999;10(4):413-419
18. Bilimoria KY, Stewart AK, Winchester DP, Ko CY. Die National Cancer Data Base: eine wirkungsvolle Initiative zur Verbesserung der Krebsversorgung in den Vereinigten Staaten. Ann Surg Oncol. 2008;15(3):683-690
19. Ong CT, Campbell BM, Thomas SM. et al. Metaplastic Breast Cancer Treatment and Outcomes in 2500 Patients: A Retrospective Analysis of a National Oncology Database. Ann Surg Oncol. 2018;25(8):2249-2260
20. Dietze EC, Sistrunk C, Miranda-Carboni G, O’Regan R, Seewaldt VL. Triple-negativer Brustkrebs bei afro-amerikanischen Frauen: Disparitäten versus Biologie. Nat Rev Cancer. 2015;15(4):248-254
21. Rakha EA, El-Sayed ME, Green AR, Lee AHS, Robertson JF, Ellis IO. Prognostische Marker bei dreifach negativem Brustkrebs. Cancer. 2007;109(1):25-32
22. ROJAS K, STUCKEY A. Breast Cancer Epidemiology and Risk Factors. Clin Obstet Gynecol. 2016;59(4):651-672
23. Liao H-Y, Zhang W-W, Sun J-Y, Li F-Y, He Z-Y, Wu S-G. The Clinicopathological Features and Survival Outcomes of Different Histological Subtypes in Triple-negative Breast Cancer. J Cancer. 2018;9(2):296-303
24. El Zein D, Hughes M, Kumar S. et al. Metaplastic Carcinoma of the Breast Is More Aggressive Than Triple-negative Breast Cancer: Eine Studie aus einer einzigen Einrichtung und Überprüfung der Literatur. Clin Breast Cancer. 2017;17(5):382-391
25. Liedtke C, Mazouni C, Hess KR. et al. Response to neoadjuvant therapy and long-term survival in patients with triple-negative breast cancer. J Clin Oncol. 2008;26(8):1275-1281
26. Cortazar P, Zhang L, Untch M. et al. Pathological complete response and long-term clinical benefit in breast cancer: the CTNeoBC pooled analysis. Lancet. 2014;384(9938):164-172
27. Fisher B, Brown A, Mamounas E. et al. Effect of preoperative chemotherapy on local-regional disease in women with operable breast cancer: findings from National Surgical Adjuvant Breast and Bowel Project B-18. J Clin Oncol. 1997;15(7):2483-2493
28. Chen IC, Lin CH, Huang CS. et al. Lack of efficacy to systemic chemotherapy for treatment of metaplastic carcinoma of the breast in the modern era. Breast Cancer Res Treat. 2011;130(1):345-351
29. Hennessy BT, Gonzalez-Angulo A-M, Stemke-Hale K. et al. Characterization of a naturally occurring breast cancer subset enriched in epithelial-to-mesenchymal transition and stem cell characteristics. Cancer Res. 2009;69(10):4116-4124
30. Prat A, Parker JS, Karginova O. et al. Phenotypic and molecular characterization of the claudin-low intrinsic subtype of breast cancer. Breast Cancer Res. 2010;12(5):R68
31. Yu K-D, Zhu R, Zhan M. et al. Identification of prognosis-relevant subgroups in patients with chemoresistant triple-negative breast cancer. Clin Cancer Res. 2013;19(10):2723-2733
32. Basho RK, Yam C, Gilcrease M. et al. Comparative Effectiveness of an mTOR-Based Systemic Therapy Regimen in Advanced, Metaplastic and Nonmetaplastic Triple-Negative Breast Cancer. Oncologist. 2018;23(11):1300-1309
33. Basho RK, Gilcrease M, Murthy RK. et al. Targeting the PI3K/AKT/mTOR Pathway for the Treatment of Mesenchymal Triple-Negative Breast Cancer. JAMA Oncol. 2017;3(4):509
34. Bergom C, Currey A, Desai N, Tai A, Strauss JB. Deep Inspiration Breath Hold: Techniques and Advantages for Cardiac Sparing During Breast Cancer Irradiation. Front Oncol. 2018;8:87
35. Latty D, Stuart KE, Wang W, Ahern V. Review of deep inspiration breath-hold techniques for the treatment of breast cancer. J Med Radiat Sci. 2015;62(1):74-81
36. Leyrer CM, Berriochoa CA, Agrawal S. et al. Predictive factors on outcomes in metaplastic breast cancer. Breast Cancer Res Treat. 2017;165(3):499-504
37. Takala S, Heikkilä P, Nevanlinna H, Blomqvist C, Mattson J. Metaplastic carcinoma of the breast: Prognose und Ansprechen auf eine systemische Behandlung bei metastasierter Erkrankung. Breast J. 2019;25(3):418-424
38. Harper NW, Hodges KB, Stewart RL. et al. Adjuvant Treatment of Triple-Negative Metaplastic Breast Cancer With Weekly Paclitaxel and Platinum Chemotherapy: Retrospektive Fallbesprechung aus einer einzigen Einrichtung. Clin Breast Cancer. May. 2019