- Tabelle der Geometrien
- LERNZIELE
- KEY TAKEAWAYS
- Key Points
- Schlüsselbegriffe
- VSEPR-Modell
- Molekulare Geometrien
- How to Determine Molecular Geometry – YouTube: Dieses Video beschreibt eine Methode, um schnell die wichtigsten geometrischen Formen für einfache Moleküle zu finden.
- Molekulare Geometrien
- LERNZIELE
- SCHLÜSSELPUNKTE
- Schlüsselpunkte
- Schlüsselbegriffe
- AXE-Methode
- Hauptgeometrien (ohne einsame Elektronenpaare):
- Trigonal planar
- Tetraedrisch
- Oktaedrisch
- Interaktiv: Elektronengeometrie: Moleküle nehmen aufgrund von Mustern gemeinsamer und nicht gemeinsamer Elektronen unterschiedliche Formen an. In diesen Beispielen werden alle Elektronen, die die Form der Moleküle beeinflussen, in den kovalenten Bindungen geteilt, die die Atome zusammenhalten, um die Moleküle zu bilden.
- Einzelne Elektronenpaare
- LERNZIELE
- LERNZIELE
- Schlüsselpunkte
- Schlüsselbegriffe
- Molekulare Geometrien mit einsamen Elektronenpaaren
- Koordinationszahl und das Zentralatom
- Die abstoßende Wirkung des einsamen Elektronenpaares
- Interaktiv: Ungeteilte Elektronen und die „gebogene“ Form: Verwenden Sie das 3D-Modell, um zu sehen, wie nicht geteilte Elektronen diejenigen abstoßen, die in den Bindungen zwischen Wasserstoff und Sauerstoff geteilt werden, was dazu führt, dass das Molekül eine „gekrümmte“ Form hat.
- LIZENZEN UND BESCHREIBUNGEN
- CC-LIZENZIERTER INHALT, VORHER GETEILT
- CC LICENSED CONTENT, SPECIFIC ATTRIBUTION
Tabelle der Geometrien
Die VSEPR-Theorie bestimmt die Molekülgeometrien (linear, trigonal, trigonal bipyramidal, tetraedrisch und oktaedrisch).
LERNZIELE
Wenden Sie das VSEPR-Modell an, um die Geometrie eines Moleküls zu bestimmen, das keine einsamen Elektronenpaare am Zentralatom enthält.
KEY TAKEAWAYS
Key Points
- Grundlegend geht das VSEPR-Modell davon aus, dass sich Bereiche mit negativer elektrischer Ladung gegenseitig abstoßen, so dass sie (und die von ihnen gebildeten chemischen Bindungen) so weit wie möglich voneinander entfernt bleiben.
- Molekulare Geometrien berücksichtigen die Anzahl der Atome und die Anzahl der einsamen Elektronenpaare.
- Die wichtigsten Geometrien ohne einsame Elektronenpaare sind: linear, trigonal, tetraedrisch, trigonal bipyramidal und oktaedrisch.
Schlüsselbegriffe
- VSEPR-Theorie: Ein chemisches Modell zur Vorhersage der Form einzelner Moleküle auf der Grundlage der elektrostatischen Abstoßung von Elektronenpaaren
VSEPR-Modell
Das Valenzschalen-Elektronenpaar-Abstoßungsmodell (VSEPR) konzentriert sich auf die bindenden und nichtbindenden Elektronenpaare in der äußersten (Valenz-)Schale eines Atoms, das sich mit zwei oder mehr anderen Atomen verbindet.
Grundlegend geht das VSEPR-Modell davon aus, dass sich diese Bereiche mit negativer elektrischer Ladung gegenseitig abstoßen, so dass sie (und die von ihnen gebildeten chemischen Bindungen) so weit wie möglich voneinander entfernt bleiben. Daher erstrecken sich die beiden Elektronenwolken, die in einem einfachen triatomischen Molekül ![]() enthalten sind, in entgegengesetzte Richtungen. Bei einem Winkelabstand von 180° sind die beiden Bindungsorbitale so weit wie möglich voneinander entfernt; daher erwarten wir, dass sich die beiden chemischen Bindungen in entgegengesetzte Richtungen erstrecken, was ein lineares Molekül ergibt.
enthalten sind, in entgegengesetzte Richtungen. Bei einem Winkelabstand von 180° sind die beiden Bindungsorbitale so weit wie möglich voneinander entfernt; daher erwarten wir, dass sich die beiden chemischen Bindungen in entgegengesetzte Richtungen erstrecken, was ein lineares Molekül ergibt.

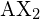 dar. Die beiden X-Atome (in Weiß) sind um 180° voneinander entfernt.
dar. Die beiden X-Atome (in Weiß) sind um 180° voneinander entfernt.Wenn das Zentralatom auch ein oder mehrere Paare nichtbindender Elektronen enthält, verhalten sich diese zusätzlichen Bereiche mit negativer Ladung ähnlich wie die mit den gebundenen Atomen verbundenen. Die Orbitale, die die verschiedenen bindenden und nichtbindenden Paare in der Valenzschale enthalten, erstrecken sich vom Zentralatom aus in Richtungen, die ihre gegenseitigen Abstoßungen minimieren. Wenn das Zentralatom über teilweise besetzte d-Orbitale verfügt, kann es fünf oder sechs Elektronenpaare aufnehmen und so ein so genanntes „erweitertes Oktett“ bilden.
Molekulare Geometrien
Molekulare Geometrien (linear, trigonal, tetraedrisch, trigonal bipyramidal und oktaedrisch) werden durch die VSEPR-Theorie bestimmt. Eine Tabelle der Geometrien, die die VSEPR-Theorie verwendet, kann das Zeichnen und Verstehen von Molekülen erleichtern. Die Tabelle mit den Molekülgeometrien ist in der ersten Abbildung zu finden. Die zweite Abbildung dient als visuelle Hilfe für die Tabelle.


How to Determine Molecular Geometry – YouTube: Dieses Video beschreibt eine Methode, um schnell die wichtigsten geometrischen Formen für einfache Moleküle zu finden.
Molekulare Geometrien
Die VSEPR-Theorie beschreibt fünf Hauptformen einfacher Moleküle: linear, trigonal planar, tetraedrisch, trigonal bipyramidal und oktaedrisch.
LERNZIELE
Wende das VSEPR-Modell an, um die Geometrie von Molekülen zu bestimmen, bei denen das Zentralatom ein oder mehrere einsame Elektronenpaare enthält.
SCHLÜSSELPUNKTE
Schlüsselpunkte
- Linear: ein einfaches triatomisches Molekül vom Typ
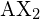 ; seine beiden Bindungsorbitale sind 180° voneinander entfernt.
; seine beiden Bindungsorbitale sind 180° voneinander entfernt. - Trigonal planar: dreieckig und in einer Ebene, mit Bindungswinkeln von 120°.
- Tetraedrisch: vier Bindungen an einem Zentralatom mit Bindungswinkeln von 109,5°.
- Trigonal bipyramidal: fünf Atome um das Zentralatom; drei in einer Ebene mit Bindungswinkeln von 120° und zwei an gegenüberliegenden Enden des Moleküls.
- Oktaedrisch: sechs Atome um das Zentralatom, alle mit Bindungswinkeln von 90°.
Schlüsselbegriffe
- VSEPR-Theorie: Das Valence Shell Electron Pair Repulsion (VSEPR)-Modell wird verwendet, um die Form einzelner Moleküle auf der Grundlage des Ausmaßes der elektrostatischen Abstoßung von Elektronenpaaren vorherzusagen
AXE-Methode
Eine weitere Möglichkeit, Molekülgeometrien zu betrachten, ist die „AXE-Methode“ der Elektronenzählung. A in der AXE-Methode steht für das Zentralatom und hat immer ein tiefgestelltes 1; X steht für die Anzahl der Sigma-Bindungen zwischen dem Zentralatom und den äußeren Atomen (kovalente Mehrfachbindungen – Doppel-, Dreifachbindungen usw. – zählen als ein X); und E steht für die Anzahl der einsamen Elektronenpaare, die das Zentralatom umgeben. Die Summe von X und E, die so genannte sterische Zahl, ist auch mit der Gesamtzahl der hybridisierten Orbitale verbunden, die von der Theorie der Valenzbindung verwendet werden. VSEPR verwendet die sterische Zahl und die Verteilung von X und E, um molekulare geometrische Formen vorherzusagen.

Beachten Sie, dass die Geometrien nur nach den Atompositionen benannt sind, nicht nach der Elektronenanordnung.

Hauptgeometrien (ohne einsame Elektronenpaare):
In einem linearen Modell sind die Atome auf einer geraden Linie verbunden, und ein Bindungswinkel ist einfach der geometrische Winkel zwischen zwei benachbarten Bindungen. Bei einem einfachen triatomischen Molekül des Typs ![]() liegen die beiden Bindungsorbitale 180° auseinander. Beispiele für triatomische Moleküle, für die die VSEPR-Theorie eine lineare Form vorhersagt, sind
liegen die beiden Bindungsorbitale 180° auseinander. Beispiele für triatomische Moleküle, für die die VSEPR-Theorie eine lineare Form vorhersagt, sind ![]() (das nicht genug Elektronen besitzt, um die Oktettregel zu erfüllen) und
(das nicht genug Elektronen besitzt, um die Oktettregel zu erfüllen) und ![]() . Beim Aufschreiben der Elektronenpunktformel für Kohlendioxid ist zu beachten, dass die C-O-Bindungen Doppelbindungen sind; für die VSEPR-Theorie macht das keinen Unterschied. Das zentrale Kohlenstoffatom ist immer noch mit zwei anderen Atomen verbunden. Die Elektronenwolken, die die beiden Sauerstoffatome verbinden, sind 180° voneinander entfernt.
. Beim Aufschreiben der Elektronenpunktformel für Kohlendioxid ist zu beachten, dass die C-O-Bindungen Doppelbindungen sind; für die VSEPR-Theorie macht das keinen Unterschied. Das zentrale Kohlenstoffatom ist immer noch mit zwei anderen Atomen verbunden. Die Elektronenwolken, die die beiden Sauerstoffatome verbinden, sind 180° voneinander entfernt.

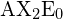 dargestellt.
dargestellt.Trigonal planar
Moleküle mit der trigonal planaren Form sind dreieckig und liegen in einer Ebene, oder ebenen Fläche. Ein ![]() -Molekül wie
-Molekül wie ![]() hat drei Bereiche mit hoher Elektronendichte, die sich vom Zentralatom aus erstrecken. Die Abstoßung zwischen diesen Bereichen ist am geringsten, wenn der Winkel zwischen ihnen 120° beträgt.
hat drei Bereiche mit hoher Elektronendichte, die sich vom Zentralatom aus erstrecken. Die Abstoßung zwischen diesen Bereichen ist am geringsten, wenn der Winkel zwischen ihnen 120° beträgt.
Tetraedrisch
Tetra- bedeutet vier, und -edrisch bezieht sich auf eine Fläche eines Festkörpers; „tetraedrisch“ bedeutet wörtlich „mit vier Flächen“. „Diese Form liegt vor, wenn es vier Bindungen an einem Zentralatom gibt, ohne einsame Elektronenpaare. Gemäß der VSEPR-Theorie beträgt der Bindungswinkel zwischen den Elektronenbindungen 109,5o. Ein Beispiel für ein tetraedrisches Molekül ist Methan ![]() . Die vier äquivalenten Bindungen zeigen in vier geometrisch äquivalente Richtungen in drei Dimensionen, was den vier Ecken eines Tetraeders mit dem Kohlenstoffatom als Zentrum entspricht.
. Die vier äquivalenten Bindungen zeigen in vier geometrisch äquivalente Richtungen in drei Dimensionen, was den vier Ecken eines Tetraeders mit dem Kohlenstoffatom als Zentrum entspricht.

Eine trigonale bipyramidale Form bildet sich, wenn ein Zentralatom von fünf Atomen in einem Molekül umgeben ist. In dieser Geometrie liegen drei Atome in derselben Ebene mit Bindungswinkeln von 120°; die beiden anderen Atome befinden sich an entgegengesetzten Enden des Moleküls. Einige Elemente der Gruppe 15 des Periodensystems bilden Verbindungen des Typs ![]() ; Beispiele sind
; Beispiele sind ![]() und
und ![]() .
.

Oktaedrisch
Okta- bedeutet acht, und -edrisch bezieht sich auf eine Fläche eines Festkörpers, so dass „oktaedrisch“ wörtlich „mit acht Flächen“ bedeutet. Die Bindungswinkel betragen alle 90°, und so wie vier Elektronenpaare minimale Abstoßung erfahren, wenn sie auf die Ecken eines Tetraeders gerichtet sind, versuchen sechs Elektronenpaare, auf die Ecken eines Oktaeders zu zeigen. Ein Beispiel für ein oktaedrisches Molekül (![]() ) ist Schwefelhexafluorid (
) ist Schwefelhexafluorid (![]() ).
).
https://lab.concord.org/embeddable.html#interactives/jsmol/electron-geometry.json
Interaktiv: Elektronengeometrie: Moleküle nehmen aufgrund von Mustern gemeinsamer und nicht gemeinsamer Elektronen unterschiedliche Formen an. In diesen Beispielen werden alle Elektronen, die die Form der Moleküle beeinflussen, in den kovalenten Bindungen geteilt, die die Atome zusammenhalten, um die Moleküle zu bilden.
Einzelne Elektronenpaare
Nicht bindende Elektronen befinden sich in Orbitalen, die Raum einnehmen, die anderen Orbitale abstoßen und die Form eines Moleküls verändern.
LERNZIELE
Erkenne die Wirkung von Einzelelektronenpaaren auf die Geometrie von Molekülen.
LERNZIELE
Schlüsselpunkte
- Orbitale, die die verschiedenen bindenden und nichtbindenden Paare in der Valenzschale enthalten, erstrecken sich vom Zentralatom aus in Richtungen, die ihre Abstoßung minimieren.
- Ein nichtbindendes Orbital hat keinen Atomkern an seinem entfernten Ende, der die Elektronenwolke zu sich zieht; die Ladung in einem solchen Orbital wird daher näher am Zentralatom konzentriert.
- Nichtbindende Orbitale üben mehr Abstoßung auf andere Orbitale aus als bindende Orbitale.
Schlüsselbegriffe
- Koordinationszahl: in der Chemie und Kristallographie die Anzahl der Nachbarn eines Zentralatoms in einem Molekül oder Kristall
- Einzelpaar: Ein Satz von zwei Valenzelektronen, der ohne Bindung oder gemeinsame Nutzung mit anderen Atomen existiert
Molekulare Geometrien mit einsamen Elektronenpaaren
Bislang haben wir nur Geometrien ohne einsame Elektronenpaare diskutiert. Wie Sie wahrscheinlich in der Tabelle der Geometrien und der AXE-Methode bemerkt haben, verändert das Hinzufügen von einsamen Elektronenpaaren die Form eines Moleküls. Wir haben bereits erwähnt, dass, wenn das Zentralatom auch ein oder mehrere Paare von Nichtbindungselektronen enthält, sich diese zusätzlichen Bereiche mit negativer Ladung ähnlich wie die mit den gebundenen Atomen verbundenen verhalten werden. Die Orbitale, die die verschiedenen bindenden und nichtbindenden Paare in der Valenzschale enthalten, erstrecken sich vom Zentralatom aus in Richtungen, die ihre gegenseitigen Abstoßungen minimieren.

Koordinationszahl und das Zentralatom
Die Koordinationszahl bezieht sich auf die Anzahl der Elektronenpaare, die ein bestimmtes Atom umgeben, das oft als Zentralatom bezeichnet wird. Die Geometrien von Molekülen mit einsamen Paaren unterscheiden sich von denen ohne einsame Paare, weil das einsame Paar wie leerer Raum in einem Molekül aussieht. Beide Geometrieklassen sind nach den Formen der imaginären geometrischen Figuren (meist regelmäßige, feste Polygone) benannt, die um das Zentralatom zentriert wären und an jedem Scheitelpunkt ein Elektronenpaar hätten.
Im Wassermolekül (![]() ) ist das Zentralatom
) ist das Zentralatom ![]() , und die Lewis-Elektronenpunktformel sagt voraus, dass es zwei Paare nichtbindender Elektronen geben wird. Das Sauerstoffatom ist also tetraedrisch koordiniert, d. h. es befindet sich im Zentrum des Tetraeders. Zwei der Koordinationspositionen werden von den gemeinsamen Elektronenpaaren besetzt, die die O-H-Bindungen bilden, und die anderen beiden von den nicht bindenden Paaren. Obwohl das Sauerstoffatom tetraedrisch koordiniert ist, wird die Bindungsgeometrie (Form) des
, und die Lewis-Elektronenpunktformel sagt voraus, dass es zwei Paare nichtbindender Elektronen geben wird. Das Sauerstoffatom ist also tetraedrisch koordiniert, d. h. es befindet sich im Zentrum des Tetraeders. Zwei der Koordinationspositionen werden von den gemeinsamen Elektronenpaaren besetzt, die die O-H-Bindungen bilden, und die anderen beiden von den nicht bindenden Paaren. Obwohl das Sauerstoffatom tetraedrisch koordiniert ist, wird die Bindungsgeometrie (Form) des ![]() -Moleküls daher als gebogen beschrieben.
-Moleküls daher als gebogen beschrieben.

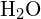 -Moleküls als gekrümmt beschrieben.
-Moleküls als gekrümmt beschrieben.Die abstoßende Wirkung des einsamen Elektronenpaares
Es gibt einen wichtigen Unterschied zwischen bindenden und nichtbindenden Elektronenorbitalen. Da ein nichtbindendes Orbital keinen Atomkern an seinem entfernten Ende hat, der die Elektronenwolke zu sich zieht, wird die Ladung in einem solchen Orbital näher am Zentralatom konzentriert; folglich üben nichtbindende Orbitale mehr Abstoßung auf andere Orbitale aus als bindende Orbitale. In ![]() schieben die beiden nichtbindenden Orbitale die bindenden Orbitale näher zusammen, so dass der H-O-H-Winkel 104,5° statt des Tetraederwinkels von 109,5° beträgt.
schieben die beiden nichtbindenden Orbitale die bindenden Orbitale näher zusammen, so dass der H-O-H-Winkel 104,5° statt des Tetraederwinkels von 109,5° beträgt.
Die Elektronen-Punkt-Struktur von ![]() platziert ein Paar nichtbindender Elektronen in der Valenzschale des Stickstoffatoms. Das bedeutet, dass es drei gebundene Atome und ein einsames Elektronenpaar für eine Koordinationszahl von vier um das Stickstoffatom herum gibt, genau wie in
platziert ein Paar nichtbindender Elektronen in der Valenzschale des Stickstoffatoms. Das bedeutet, dass es drei gebundene Atome und ein einsames Elektronenpaar für eine Koordinationszahl von vier um das Stickstoffatom herum gibt, genau wie in ![]() .
.

 ..: Das an den zentralen Stickstoff gebundene einsame Paar erzeugt Bindungswinkel, die von den tetraedrischen 109,5 ° abweichen.
..: Das an den zentralen Stickstoff gebundene einsame Paar erzeugt Bindungswinkel, die von den tetraedrischen 109,5 ° abweichen.Wir können daher vorhersagen, dass die drei Wasserstoffatome an den Ecken eines auf das Stickstoffatom zentrierten Tetraeders liegen werden. Das Orbital des einsamen Paares zeigt auf die vierte Ecke des Tetraeders, aber da diese Position unbesetzt ist, kann das ![]() -Molekül selbst nicht tetraedrisch sein; stattdessen nimmt es eine pyramidale Form an, genauer gesagt die einer trigonalen Pyramide (eine Pyramide mit dreieckiger Basis). Die Wasserstoffatome liegen alle in der gleichen Ebene, der Stickstoff liegt außerhalb der Ebene. Die Nichtbindungselektronen schieben die Bindungsorbitale leicht zusammen, so dass die H-N-H-Bindungswinkel etwa 107° betragen.
-Molekül selbst nicht tetraedrisch sein; stattdessen nimmt es eine pyramidale Form an, genauer gesagt die einer trigonalen Pyramide (eine Pyramide mit dreieckiger Basis). Die Wasserstoffatome liegen alle in der gleichen Ebene, der Stickstoff liegt außerhalb der Ebene. Die Nichtbindungselektronen schieben die Bindungsorbitale leicht zusammen, so dass die H-N-H-Bindungswinkel etwa 107° betragen.
In 5-koordinierten Molekülen, die einsame Paare enthalten, befinden sich diese Nichtbindungsorbitale (die näher am Zentralatom liegen und daher eher von anderen Orbitalen abgestoßen werden) vorzugsweise in der Äquatorialebene. Dadurch befinden sie sich in einem 90°-Winkel zu höchstens zwei axial ausgerichteten Bindungsorbitalen. Wir können daher vorhersagen, dass ein ![]() -Molekül (ein Molekül, bei dem das Zentralatom A mit vier anderen Atomen X und einem nichtbindenden Elektronenpaar koordiniert ist) wie
-Molekül (ein Molekül, bei dem das Zentralatom A mit vier anderen Atomen X und einem nichtbindenden Elektronenpaar koordiniert ist) wie ![]() die Form einer „Wippe“ haben wird.
die Form einer „Wippe“ haben wird.

Ersetzt man die gebundenen Atome durch nichtbindende Paare, reduziert sich die dreieckige Bipyramidenkoordination auf noch einfachere Molekülformen.
https://lab.concord.org/embeddable.html#interactives/jsmol/unshared-electrons.json
Interaktiv: Ungeteilte Elektronen und die „gebogene“ Form: Verwenden Sie das 3D-Modell, um zu sehen, wie nicht geteilte Elektronen diejenigen abstoßen, die in den Bindungen zwischen Wasserstoff und Sauerstoff geteilt werden, was dazu führt, dass das Molekül eine „gekrümmte“ Form hat.
LIZENZEN UND BESCHREIBUNGEN
CC-LIZENZIERTER INHALT, VORHER GETEILT
- Kuration und Revision. Bereitgestellt von: Boundless.com. Lizenz: CC BY-SA: Attribution-ShareAlike
CC LICENSED CONTENT, SPECIFIC ATTRIBUTION
- VSEPR Theory. Bereitgestellt von: Wikipedia. Located at: http://en.wikipedia.org/wiki/VSEPR_Theory. Lizenz: CC BY-SA: Attribution-ShareAlike
- Molekulare Geometrie. Bereitgestellt von: Wikipedia. Located at: http://en.wikipedia.org/wiki/Molecular_geometry. Lizenz: CC BY-SA: Attribution-ShareAlike
- VSEPR Theory. Bereitgestellt von: Wikipedia. Located at: http://en.wikipedia.org/wiki/VSEPR%20Theory. Lizenz: CC BY-SA: Attribution-ShareAlike
- Molekulare Geometrie. Bereitgestellt von: Wikipedia. Located at: http://en.wikipedia.org/wiki/Molecular_geometry. Lizenz: Public Domain: Kein bekanntes Copyright
- VSEPR-Geometrien. Bereitgestellt von: Wikimedia. Located at: http://commons.wikimedia.org/wiki/File:VSEPR_geometries.PNG. Lizenz: CC BY-SA: Attribution-ShareAlike
- How to Determine Molecular Geometry – YouTube. Located at: http://www.youtube.com/watch?v=pA9ML0HVOYE. Lizenz: Public Domain: No Known Copyright. Lizenzbedingungen: Standard YouTube-Lizenz
- Lineare-3D-Kugeln. Bereitgestellt von: Wikipedia. Located at: http://en.wikipedia.org/wiki/File:Linear-3D-balls.png. Lizenz: CC BY: Attribution
- Molekulare Geometrie. Bereitgestellt von: Wikipedia. Located at: http://en.wikipedia.org/wiki/Molecular_geometry. Lizenz: CC BY-SA: Attribution-ShareAlike
- VSEPR Theory. Bereitgestellt von: Wikipedia. Located at: http://en.wikipedia.org/wiki/VSEPR_Theory. Lizenz: CC BY-SA: Attribution-ShareAlike
- VSEPR Theory. Bereitgestellt von: Wikipedia. Located at: http://en.wikipedia.org/wiki/VSEPR%20Theory. Lizenz: CC BY-SA: Attribution-ShareAlike
- Molekulare Geometrie. Bereitgestellt von: Wikipedia. Located at: http://en.wikipedia.org/wiki/Molecular_geometry. Lizenz: Public Domain: Kein bekanntes Copyright
- VSEPR-Geometrien. Bereitgestellt von: Wikimedia. Located at: http://commons.wikimedia.org/wiki/File:VSEPR_geometries.PNG. Lizenz: CC BY-SA: Attribution-ShareAlike
- How to Determine Molecular Geometry – YouTube. Located at: http://www.youtube.com/watch?v=pA9ML0HVOYE. Lizenz: Public Domain: No Known Copyright. Lizenzbedingungen: Standard YouTube-Lizenz
- Lineare-3D-Kugeln. Bereitgestellt von: Wikipedia. Located at: http://en.wikipedia.org/wiki/File:Linear-3D-balls.png. Lizenz: CC BY: Attribution
- VSEPR Theory. Bereitgestellt von: Wikipedia. Located at: http://en.wikipedia.org/wiki/VSEPR_Theory%23AXE_method. Lizenz: Public Domain: Kein bekanntes Copyright
- VSEPR-Theorie. Bereitgestellt von: Wikipedia. Located at: http://en.wikipedia.org/wiki/VSEPR_Theory%23AXE_method. Lizenz: Public Domain: No Known Copyright
- Koordinationsnummer. Bereitgestellt von: Wiktionary. Located at: http://en.wiktionary.org/wiki/coordination_number. Lizenz: CC BY-SA: Attribution-ShareAlike
- John Hutchinson, Concept Development Studies in Chemistry. September 18, 2013. Bereitgestellt von: OpenStax CNX. Located at: http://cnx.org/content/m12594/latest/?collection=col10264/latest. Lizenz: CC BY: Attribution
- Boundless. Bereitgestellt von: Boundless Learning. Located at: http://www.boundless.com//chemistry/definition/lone-pair. Lizenz: CC BY-SA: Attribution-ShareAlike
- Molekulare Geometrie. Bereitgestellt von: Wikipedia. Located at: http://en.wikipedia.org/wiki/Molecular_geometry. Lizenz: Public Domain: Kein bekanntes Copyright
- VSEPR-Geometrien. Bereitgestellt von: Wikimedia. Located at: http://commons.wikimedia.org/wiki/File:VSEPR_geometries.PNG. Lizenz: CC BY-SA: Attribution-ShareAlike
- How to Determine Molecular Geometry – YouTube. Located at: http://www.youtube.com/watch?v=pA9ML0HVOYE. Lizenz: Public Domain: No Known Copyright. Lizenzbedingungen: Standard YouTube-Lizenz
- Lineare-3D-Kugeln. Bereitgestellt von: Wikipedia. Located at: http://en.wikipedia.org/wiki/File:Linear-3D-balls.png. Lizenz: CC BY: Attribution
- VSEPR Theory. Bereitgestellt von: Wikipedia. Located at: http://en.wikipedia.org/wiki/VSEPR_Theory%23AXE_method. Lizenz: Public Domain: Kein bekanntes Copyright
- VSEPR-Theorie. Bereitgestellt von: Wikipedia. Located at: http://en.wikipedia.org/wiki/VSEPR_Theory%23AXE_method. Lizenz: Public Domain: Kein bekanntes Copyright
- VSEPR-Theorie. Bereitgestellt von: Wikipedia. Located at: http://en.wikipedia.org/wiki/VSEPR_Theory. Lizenz: Public Domain: No Known Copyright
- Tetrahedral_Structure_of_Water.png. Bereitgestellt von: Wikimedia. Located at: https://commons.wikimedia.org/wiki/File:Tetrahedral_Structure_of_Water.png. Lizenz: Public Domain: No Known Copyright
Ein chemisches Modell, das zur Vorhersage der Form einzelner Moleküle auf der Grundlage der elektrostatischen Abstoßung von Elektronenpaaren verwendet wird.Paar elektrostatischer Abstoßung
die Gesamtzahl der Atome, die einem Zentralatom in einem Molekül oder Ion direkt benachbart sind
zwei (ein Paar von) Valenzelektronen, die nicht zur Bildung einer kovalenten Bindung verwendet werden