Wassereigenschaften
Eines der Dinge, die unseren Planeten so besonders machen, ist das Vorhandensein von flüssigem Wasser. Wasser ist grundlegend für alles Leben; ohne es würde jedes Lebewesen sterben.
Wasser bedeckt etwa 70% der Erdoberfläche und macht 65-75% unseres Körpers aus (82% unseres Blutes besteht aus Wasser). Auch wenn Wasser langweilig erscheinen mag – keine Farbe, kein Geschmack, kein Geruch – hat es erstaunliche Eigenschaften, die es für das Leben notwendig machen.
(Unser Bedarf an Wasser und die Meerestiere, die im Wasser leben, sind der Grund, warum Ölverschmutzungen so schädlich sind.)
Die chemische Zusammensetzung von Wasser ist H2O – zwei Wasserstoffatome und ein Sauerstoffatom. Die besonderen Eigenschaften des Wassers ergeben sich aus der Art und Weise, wie sich die Atome zu einem Wassermolekül verbinden und wie die Moleküle miteinander interagieren.
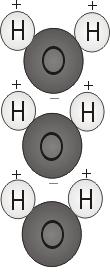
Wasserpolarität
Wenn sich die beiden Wasserstoffatome mit dem Sauerstoff verbinden, hängen sie an der Spitze des Moleküls wie Mickey-Maus-Ohren. Diese Molekülstruktur verleiht dem Wassermolekül Polarität oder eine schiefe elektrische Ladung, die andere Atome anzieht.
Das Ende des Moleküls mit den beiden Wasserstoffatomen ist positiv geladen. Das andere Ende, mit dem Sauerstoff, ist negativ geladen. Wie bei einem Magneten, wo sich Nord- und Südpole anziehen („Gegensätze ziehen sich an“), verbindet sich das positive Ende des Wassermoleküls mit dem negativen Ende anderer Moleküle.
Was bedeutet das für uns? Durch seine Polarität kann Wasser andere polare Stoffe sehr leicht auflösen. Wenn eine polare Substanz in Wasser gegeben wird, werden die positiven Enden ihrer Moleküle von den negativen Enden der Wassermoleküle angezogen und umgekehrt. Diese Anziehungskräfte bewirken, dass sich die Moleküle der neuen Substanz gleichmäßig mit den Wassermolekülen vermischen.
Wasser löst mehr Substanzen auf als jede andere Flüssigkeit – sogar die stärkste Säure! Aus diesem Grund wird es oft als „universelles Lösungsmittel“ bezeichnet. Die Lösekraft des Wassers ist für das Leben auf der Erde sehr wichtig. Überall, wo Wasser hinfließt, transportiert es gelöste Chemikalien, Mineralien und Nährstoffe, die für das Leben gebraucht werden.
Aufgrund ihrer Polarität ziehen sich Wassermoleküle stark gegenseitig an, was dem Wasser eine hohe Oberflächenspannung verleiht. Die Moleküle an der Wasseroberfläche „kleben“ zusammen und bilden eine Art „Haut“ auf dem Wasser, die stark genug ist, um sehr leichte Gegenstände zu tragen. Insekten, die auf dem Wasser laufen, machen sich diese Oberflächenspannung zunutze.
Die Oberflächenspannung bewirkt, dass Wasser in Tropfen verklumpt, anstatt sich in einer dünnen Schicht auszubreiten.
Sie ermöglicht es dem Wasser auch, sich durch Pflanzenwurzeln und -stängel, Thermometer und die kleinsten Blutgefäße in Ihrem Körper zu bewegen. Wenn sich ein Molekül nach oben bewegt, „zieht“ es die anderen mit sich.
Drei Aggregatzustände
Wasser ist eines von vier Elementen und der einzige natürliche Stoff, der in allen drei Aggregatzuständen – fest, flüssig und gasförmig – bei den auf der Erde üblichen Temperaturen existieren kann.
Viele andere Stoffe müssen überhitzt oder abgekühlt werden, um ihren Zustand zu ändern.
Der gasförmige Zustand des Wassers ist in unserer Atmosphäre ständig als Wasserdampf vorhanden. Der flüssige Zustand ist überall in Flüssen, Seen und Ozeanen zu finden.
Der feste Zustand von Wasser, Eis, ist einzigartig. Die meisten Flüssigkeiten ziehen sich zusammen, wenn sie abgekühlt werden, weil sich die Moleküle langsamer bewegen und weniger Energie haben, um der gegenseitigen Anziehung zu widerstehen. Wenn sie zu Festkörpern gefrieren, bilden sie dicht gepackte Kristalle, die viel dichter sind, als die Flüssigkeit ursprünglich war.
Wasser verhält sich nicht auf diese Weise. Wenn es gefriert, dehnt es sich aus: Die Moleküle reihen sich auf und bilden eine sehr „offene“ kristalline Struktur, die weniger dicht ist als flüssiges Wasser.
Deshalb schwimmt Eis. Und es ist gut, dass es das tut! Wenn sich Wasser wie die meisten anderen Flüssigkeiten verhalten würde, würden Seen und Flüsse fest gefrieren und alles Leben darin würde sterben.
Drei weitere Eigenschaften von Wasser
Wasser hat eine hohe spezifische Wärme. Das heißt, im Gegensatz zu Luft kann Wasser viel Wärme aufnehmen, ohne seine Temperatur zu verändern. Deshalb fühlt sich Schwimmen an einem heißen Tag so erfrischend an.
Wasser verliert auch langsamer Wärme als Luft. Das führt dazu, dass das Wasser von Seen und Ozeanen im Sommer in der Regel am Anfang der Saison am kältesten und am Ende der Saison am wärmsten ist (nachdem es viele Tage lang die Energie der Sonne aufgenommen hat).
Der Siedepunkt von Wasser (212° F oder 100°C auf Meereshöhe) wird durch die Höhe beeinflusst. Im Allgemeinen gilt: Je höher die Höhe, desto niedriger der Siedepunkt des Wassers. In Denver, CO (5,280 ft.), siedet Wasser zum Beispiel bei 202.4° F. Auf dem Mount Everest in Nepal (29,012 ft.) siedet Wasser bei 156° F.
Wasserwissenschaftliche Projekte:
- Der Wasserkreislauf
- Wasserrad
- Supergekühltes Wasser
- Wasserreservoir