Byl proveden výzkumný program s cílem zlepšit technologii zpracování pro získávání oxidu hlinitého z nebauxitických hornin. Úspěch tohoto programu zajistil technologii nezbytnou pro výrobu dostatečných zásob vysoce kvalitního oxidu hlinitého z domácích zdrojů, čímž byly uspokojeny národní hospodářské a strategické potřeby ve vztahu k výrobě hliníku. Jedním z procesů zkoumaných v rámci výzkumného programu je proces získávání oxidu hlinitého z nekvalitních rud pomocí kyseliny chlorovodíkové.
Jedna fáze tohoto procesu využívá vlivu koncentrace chloridových iontů na rozpustnost hlinitého iontu v roztoku. Při teplotě 25 °C je rozpustnost AlCl3 v čisté vodě přibližně 31 % hmotnostních a klesá se zvyšující se koncentrací kyseliny chlorovodíkové (HCl), přičemž při zvýšení koncentrace HCl na 37 % hmotnostních dosahuje 0,1 % hmotnostních. Toto chování bylo předmětem mnoha výzkumů, postupů a patentů. Je tedy možné vyluhovat nebuxitickou rudu HCl, dekantovat a filtrovat louh a přidáním plynné HCl vysrážet AlCl3-6H2O. Zbylý roztok kyseliny lze pak použít k loužení další rudy a vysrážený AlCl3-6H2O lze kalcinovat za účelem získání Al2O3 . Rozsáhlou diskusi a hodnocení tohoto procesu uvádějí Peters, Johnson a Kirby. Termodynamických údajů, jako jsou iontové aktivity a rozpustnosti, potřebných pro úplnou analýzu, interpretaci a zlepšení tohoto procesu je málo a stávající údaje o rozpustnosti jsou omezeny na úzký rozsah teplot. Cílem tohoto šetření proto bylo (1) stanovit rozpustnost AlCl3 v teplotním rozmezí od 25° do 85° C s koncentrací HCl od 0,0 do 37°.2 pct; (2) vypočítat aktivity AlCl3 a H2O v roztocích obsahujících různé elektrolyty , a rovnovážnou konstantu pro rozpouštění AlCl3-6H2O; a (3) navrhnout oblasti výzkumu pro získání užitečných údajů.
- Aparatura
- Experimentální postup
- Analýza
- Výsledky
- Srovnání s jinými údaji
- Termodynamické zpracování
- Rozpustnost produktu a aktivity v soustavě AlCl3-6H2O-H2O
- Odhad aktivit v soustavě AlCl3-6H2O-H2O
- Součin rozpustnosti a aktivity v soustavě AlCl3-6H2O-HCl-H2O
- Odhad aktivit v soustavě AlCl3-6H2O-HCl-H2O
- Soustava AlCl3-FeCl3-KCl-NaCl-HCl-H2O
- Oblasti doporučené pro výzkum
- Chlorid hlinitý ve vodných roztocích kyseliny chlorovodíkové
Aparatura
Aparatura použitá pro měření rozpustnosti je znázorněna na obrázku 1. Na obrázku 1 je znázorněno rozpouštění AlCl3 a H2O v roztocích obsahujících různé elektrolyty. Baňka A o objemu 100 ml obsahuje roztok elektrolytů a určitý přebytek soli. Fritovaný skleněný filtr, B, natavený na pyrexové trubici o průměru 6 mm, je spojen s vnější trubicí připojenou ke dvěma teflonovým kohoutům, D a E. Horní sestava je připojena k A v místě C pomocí nylonového kompresního šroubení se závitem a neoprenovým 0-kroužkem. Polyethylenová trubice o průměru 6 mm, F-L, přivádí vzorek roztoku filtrovaného na B do druhé baňky, K, když je A pod tlakem přes kohout D a E je otevřen. Armatura na J je podobná armatuře na C. Baňky jsou upnuty na tyči G, která je připevněna k houpacímu mechanismu s osou kývání H pro střídavé třepání baňkami A a K nahoru a dolů. Krytý termostat, 0, je řízen s přesností ±0,2 °C. Bližší řízení teploty není nutné, protože rozpustnost je velmi slabou funkcí teploty.
Experimentální postup
Měření rozpustnosti při 25°, 45°, 65° a 85° C bylo provedeno za podmínek fázové rovnováhy s analytickými materiály reagenční kvality. Do baňky A bylo vloženo odpovídající množství AlCl3-6H2O, 37% roztoku HCl a destilované vody tak, aby vzniklo přibližně 90 ml roztoku s malým množstvím přebytečných krystalů soli (dále jen „sůl“ znamená hexahydrát chloridu hlinitého). Množství materiálů bylo odhadnuto z existujících údajů o rozpustnosti ternárního systému AlCl3-6H2O-HCl-H2O. Po vytvoření roztoku v baňce A a sestavení aparatury byla tato ponořena do vody na úroveň N a termostat byl nastaven na požadovanou teplotu. Během každého cyklu trvajícího 2 až 3 dny bylo použito nepřetržité mechanické míchání baněk. Periodicky se také používalo intenzivní ruční míchání, aby se zajistila
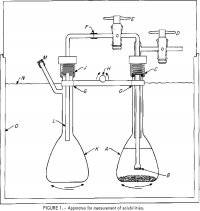
rovnováha, zejména pokud by sůl mohla tvořit s HCl komplexní pevnou sůl. Na konci rovnovážného období se baňky nechaly 1 hodinu stát ve svislé poloze, aby se zajistilo usazování pevných částic. Poté se otevřely kohouty D a E, aby se přibližně polovina roztoku převedla do odběrové baňky K. Hladina B pod kapalinou v A obvykle určovala množství roztoku převedeného do K. Hmotnost roztoku v K se stanovila vážením baňky před sestavením a po přijetí roztoku a rozebrání. Do baňky se přes L vstříklo známé množství destilované vody, aby se vzorek zředil a rozpustily se případné páry v plynné fázi. Parciální tlak HCl v čisté vodě přesahuje 1 torr při 25 °C při molalitách vyšších než 8 m (m za číslem ve větě označuje molalitu); proto je při koncentracích nižších než 8 m pochybné, že by během odběru vzorku mohlo dojít k jakýmkoli ztrátám HCl. Z tohoto důvodu byly některé z běhů při 25° C, které obsahovaly méně než 4 m HCl, provedeny s jednou zátkovanou baňkou a po vyrovnání byla část roztoku pečlivě dekantována a přefiltrována pro odběr vzorků.
Analýza
Roztoky byly po příslušných zředěních analyzovány na celkové koncentrace chloridových iontů a hliníkových iontů. Celková koncentrace chloridových iontů byla stanovena potenciometrickou titrací s Ag+. Koncentrace Al+++ byla stanovena nejprve komplexací s přebytkem kyseliny ethylendiamintetraoctové (EDTA) a poté zpětnou titrací přebytku EDTA s Cu++ při pH 3,8.
Obsah AlCl3 byl vypočten z analýzy Al+++. Odečtení chloridového iontu ve vypočteném množství AlCl3 od celkové koncentrace chloridových iontů umožnilo vypočítat koncentraci HCl v nasycených roztocích.
Tato metoda výpočtu byla použita pro všechny analýzy kromě těch, u nichž byla známa nulová koncentrace HCl, tj. když byl AlCl3 jediným elektrolytem v čisté vodě. U těchto analýz byla koncentrace AlCl3 jednoduše vypočtena z analýzy chloridových iontů, která byla z obou analýz přesnější, ačkoli u těchto vzorků byly ještě dokončeny analýzy Al+++ i Cl-.
Rozdíl v analýze Cl- vypočtený z celkové analýzy Cl- a Cl- z analýzy Al+++ pro experimenty bez přídavku HCl byl ±0,2 hm. bodu Cl-. To naznačuje, že v průměru analýza Al++ podléhala chybě +0,05 wt-pct, protože je známo, že analýza Cl je podstatně přesnější než analýza Al+++. V roztocích obsahujících HCl se chyba ±0,05 % v obsahu Al+++ projevila jako ±0,20 pct v obsahu HCl; to proto, že zatímco celkový obsah Cl byl velmi přesný, Cl přispívající přidaným HCl, a tedy molalita HCl, se počítala rozdílem, jak bylo uvedeno dříve.
Výsledky
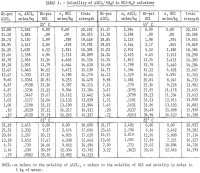
Výsledky jsou shrnuty v tabulce 1 a zobrazeny na obrázku 2. Maximální koncentrace HCl pro údaje uvedené v tabulce 1 pro teplotu 85 °C je přibližně 30 hm. Měření byla při této koncentraci zastavena z důvodu nadměrných rovnovážných tlaků v systému při vyšších koncentracích. Je třeba také poznamenat, že při teplotách 65° a 85° C bylo provedeno méně stanovení než při teplotách 25° a 45° C. Při obou nižších teplotách byly provedeny repliky, aby se zjistila uspokojivá opakovatelnost výsledků. Z obrázku 2 je patrné, že rozpustnost hlinité soli drasticky klesá s rostoucí koncentrací HCl. Loužení nebauxitových rud roztokem HCl a vysrážení čisté soli pro extrakci hliníku přidáním HCl je proto proveditelný postup; takový postup byl předmětem několika patentů. Výsledky ukazují, že rozpustnost se s teplotou příliš nemění a při zvýšení teploty o 60 °C (25 °C až 85 °C) se rozpustnost samotné čisté soli ve vodě zvýší pouze o 2,2 pct vzhledem k rozpustnosti při 25 °C.
Srovnání s jinými údaji
Zjistilo se, že rozpustnost čisté soli ve vodě při 25 °C přesně souhlasí s údaji Palitzcha a s údaji Ehreta a Frereho. Výsledky uvedené Malquorim jsou asi o 10 pct vyšší. Rozpustnost získaná Tanakou je asi o 3,3 pct vyšší než v tomto šetření při 45° a při 65° C.
Vliv HCl ve vodě na rozpustnost soli zkoumali Seidel a Fisher při 0° C a Malquori při 25° C. Výsledky prvně jmenovaných badatelů při teplotě 0° C se velmi přesně shodují s údaji v tabulce 1, extrapolovanými na 0° C, zatímco výsledky posledně jmenovaného badatele při teplotě 25° C se poněkud rozcházejí a při nízkých koncentracích HCl se neshodují zhruba o 3 pct; shoda v rozmezí 5 až 30 hmotnostních procent HCl je však v rozmezí 1 pct.
Termodynamické zpracování
Rozpustnost produktu a aktivity v soustavě AlCl3-6H2O-H2O
Koeficient iontové aktivity Y12 AlCl3 ve vodě byl změřen až do 1,8 m Masonem a přepočtené hodnoty uvádějí Robinson a Stokes. Protože se očekává, že koeficient aktivity od 1,8 m do hodnoty nasycení 3,3835 m vzroste více než pětinásobně, používá se pro výpočet hodnota nasycení metodou podrobně popsanou v předchozí zprávě (1 m = 1 mol v 1 kg rozpouštědla). Tato metoda s příslušným novým použitím je stručně shrnuta v této zprávě. Střední iontová aktivita AlCl3, označená jako a12, se vyjadřuje následující mocninnou řadou ve vztahu k molalitě m:

Příslušná rovnice pro aktivitu vody aw, se získá použitím Gibbsova-Duhemova vztahu; výsledek je
![]()
Všimněte si, že exponenty m se stejnými koeficienty C, D atd, jsou v rovnici 2 o 1 vyšší než v rovnici 1 a koeficient m v rovnici 2 pochází z Debye-Huckelovy teorie, jak o ní pojednává Gokcen.
Reakce pro rozpouštění soli je
AlCl3-6H2O (S) = Al+++ + 3Cl- + 6H2O (l),………………………….(3)
kde (s) znamená pevnou látku a (l) kapalinu.
Odpovídající rovnovážná konstanta je
![]()
kde jmenovatel, aktivita pevné látky, se bere za jednotku, protože její složení se při přidání jiných elektrolytů v roztoku nemění. Nahradíme a12 v 1n Kp přímo z rovnice 1 a aw z rovnice 2 po vynásobení rovnice 2 koeficientem 0,108093, aby byl koeficient 1n aw roven 6. Protože Kp je nezávislý na složení, je zřejmé, že
![]()
Po požadovaných substitucích z rovnic 1 a 2 a následné substituci průměrné hodnoty m = 3 .3835 z prvních dvou průběhů v tabulce 1 získáme jednu rovnici pro řešení šesti neznámých koeficientů v rovnici 1 a zbývajících pět rovnic získáme dosazením každé z pěti experimentálních hodnot průměrného koeficientu iontové aktivity AlCl3 , y12 v tabulce 2, do
![]()
a poté dosazením každého výsledku do rovnice 1. Šest takto získaných simultánních rovnic se pak řeší pomocí počítače. Výsledky jsou následující:
C = -57,5723,
D = +142,0288,
E = -202,5581,
F = +161,1919,
G = -67,7831,
a H = +11,6880.
Sestavením těchto hodnot do rovnic 1, 2 a 4 získáme hodnoty Y12, aw a Kp. Výsledky jsou uvedeny v tabulce 3 pod nadpisem „Bureau results:“. Je třeba poznamenat, že aktivitu vody lze nyní vypočítat z rovnice 2 a tlak par vody nad roztokem, P, z
aw = P/P°,……………………………….(7)
kde P° je tlak par čisté vody při stejné teplotě. Všimněte si, že tlak páry vody nad nasyceným roztokem je o něco málo větší než polovina tlaku páry nad čistou vodou, protože aw = 0,509. Výše uvedené výsledky představují první soubor údajů o aktivitách založených na rozpustnosti soli.
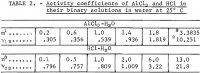
Poznámka.- V této tabulce se m vztahuje k molalitě AlCl3, n se vztahuje k molalitě HCl a molalita je mol v 1 kg vody.
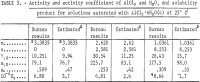
Poznámka.V této tabulce se m vztahuje k molalitě AlCl3, n se vztahuje k molalitě HCl a molalita je mol v 1 kg vody.
Odhad aktivit v soustavě AlCl3-6H2O-H2O
K získání aktivit v soustavě AlCl3-6H2O-H2O se nad rámec existujících přímých experimentálních údajů při m = 1,8 používají dvě stávající spolehlivé metody odhadu. První metoda, jak ji popsali Kusik a Meissner, dává odhadovanou hodnotu γ12 = 9,94 při 3,3835 m. Tato odhadovaná hodnota je v těsném souladu s hodnotou 10,251, která byla získána při tomto šetření. Odpovídající odhadovaná hodnota aktivity vody, aw, je 0,47, což je opět v těsném souladu s hodnotou 0,509 zjištěnou při tomto šetření. Rovnovážná konstanta Kp vypočtená z těchto hodnot není daleko od 6,8 x 10 5, vzhledem k tomu, že pro získání Kp se násobí čtvrtá mocnina a12 a šestá mocnina aw.
Druhá metoda odhadu podle Bromleyho dává pro γ12 hodnotu 10,42, což je hodnota bližší hodnotě získané předchozí metodou. Koeficient aktivity vody byl získán současnými autory integrací Gibbsovy-Duhemovy rovnice, v níž byly použity hodnoty a12 odhadnuté Bromleyho metodou. Výsledek je aw = 0,540. Průměr obou metod je 0,505, což je ve velmi dobré shodě s hodnotou 0,509, kterou stanovil Bureau. Bromleyho metoda však neobsahuje vhodnou metodu pro stanovení aw obsaženou v Kusik-Meissnerově metodě.
Shoda odhadnutých hodnot s hodnotami z údajů o rozpustnosti není vždy tak dobrá, jak je zde uvedeno pro každý elektrolyt při každém složení. Například i pro AlCl3 při 1 m se oba odhady γ12 od sebe liší pouze o 13 %.
Součin rozpustnosti a aktivity v soustavě AlCl3-6H2O-HCl-H2O
Vliv rostoucí koncentrace HCl na rozpustnost soli je z velké části způsoben rostoucí koncentrací chloridových iontů. Rovnovážná konstanta v tomto případě s aktivitami a1 a a2 jednotlivých iontů je
![]()
kde γ12 = γ1γ2 podle definice γ12 z jednotlivých iontových aktivit γ1 (pro Al+++) a γ2 (pro Cl-) a n je molalita HCl. Hodnota Kp je stejná jako v rovnici 4, ale pravá strana v rovnici 8 je jiná než v rovnici 4. Lze poznamenat, že s rostoucím n musí klesat m, tedy koncentrace Al+++, za předpokladu, že γ12 a aw výrazně neklesají; proto se sůl vysráží, což je známé jako efekt vysolování.
Výpočet aktivit v ternárním roztoku vyžaduje rovnici podobnou rovnici 1 pro HCl. Protože údaje pro HCl jsou přesně známy v širokém rozsahu koncentrací, je možné vzít rovnici s libovolným počtem proměnných. Následující rovnice poskytuje přesné vyjádření údajů pro koeficient aktivity HCl, γ32, kde index 3 je pro H+ a 2 pro Cl-:
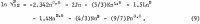
Údaje vybrané pro tento účel od Haaseho, Naaseho a Thutnma jsou uvedeny na třetím a čtvrtém řádku tabulky 2. Hodnoty koeficientů vypočtené z těchto údajů jsou následující:
J = -1,88416,
K = +2,24342,
L = -1,98545,
M = +1,00091,
N = -0,25934,
a P = +0,02634.
Rovnice pro aktivity AlCl3 a H2O obsahují tyto koeficienty a také koeficienty křížových součinů (m h/2)(n k/2), kde h a k jsou celá čísla, a tyto rovnice jsou následující:
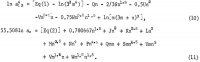
Pět dalších koeficientů v těchto rovnicích se určí sečtením rovnice 10 a 6 1n aw z rovnice 11, čímž se získá 1n Kp, a použitím následujících vybraných údajů o rozpustnosti z tabulky 1:
m: 2.620, 2,016, 1,333, 0,953 a 0,535.
n: 2,581, 4,460, 6,780, 8,397 a 10,063.
Výsledné výpočty dávají následující hodnoty koeficientů v rovnicích 10 a 11:
Q = +23,27027,
S = -22.47064,
U = +4,29102,
V = -9,76081,
a W = +4,60246.
Výsledky pro γ12, a12, aw a Kp vypočtené z předchozích rovnic jsou uvedeny v tabulce 3. Hodnoty γ12 z rovnice 9 jsou ve shodě s hodnotami podle Harneda a Garyho při velmi nízkých koncentracích HCl a AlCl3.
Parciální tlak HCl(g), P32, nad roztokem lze vypočítat z následující rovnice (4):
Kp (HCl) = 4.94 x 10 -7 = P32/a²32………………………….(12)
kde Kp(HCl) je rovnovážná konstanta při 25 °C pro H+ + Cl- = HCl(g) a a32 je střední iontová aktivita HCl v roztoku. Pro tento účel je nutné napsat rovnici pro a32, podobnou rovnici 10, pomocí parametrů v rovnici 11, jak je podrobně uvedeno na jiném místě.
Vliv teploty na rozpustnost soli je malý, jak je uvedeno v tabulce 1. Vliv teploty na rozpustnost soli je malý. Očekává se tedy, že vliv na iontovou aktivitu bude malý, protože všechny parametry v rovnici 11 by bylo možné získat z údajů o rozpustnosti, pokud by experimentální chyba byla menší než ±0,01 hm. procenta pro analýzu hliníku. Obecně platí, že pro rozsah teplot do přibližně 80 °C je každý parametr lineární funkcí teploty a tuto závislost lze určit, pokud by byla rovnice 11 známa při jiné teplotě, která je alespoň o 50 °C vyšší než 25 °C.
Odhad aktivit v soustavě AlCl3-6H2O-HCl-H2O
Hodnoty aktivit, koeficientu aktivity a součinu rozpustnosti odhadnuté v této zprávě podle metody navržené Kusikem a Meissnerem, jsou uvedeny v tabulce 3. Koeficient aktivity γ12 pro AlCl3 je zhruba dvakrát vyšší než odhadnutá hodnota pro vybrané roztoky obsahující HCl. Aktivita vody, aw, však dobře souhlasí s odhadnutými hodnotami s výjimkou m = 2,620. Je zřejmé, že výpočty by byly podstatně spolehlivější, kdyby byl změřen tlak par vody, aw, protože aw vstupuje do Kp jako aw, takže malé chyby v aw způsobují velké chyby v γ12 a Kp . Za tímto účelem se doporučuje provést omezený počet měření tlaku par, aby se ověřila přesnost současných výpočtů a metod odhadu.
Závislost termodynamických vlastností uvedených v tabulce 3 na teplotě lze odhadnout způsobem, který popsali Kusik a Meissner. Odhad však pravděpodobně poskytne vyšší stupeň teplotní závislosti, než jaký naznačuje slabá teplotní závislost rozpustnosti. Nebylo možné se pokusit o výpočet vlivu teploty pomocí Bureauovy metody, protože (1) a12 při nízkých koncentracích AlCl3 není při různých teplotách známa, (2) rozpustnost AlCl3 nebylo možné určit s přesností blížící se 0,01 pct v Al+++ a (3) rozsah koncentrací HCl při 65° a 85° C je příliš malý na to, aby bylo možné vybrat dostatečný počet značně rozdílných údajů o rozpustnosti AlCl3 pro přesné určení parametrů v rovnicích 10 a 11. Vliv teploty na rozpustnost AlCl3 je však v rozmezí 0,01 pct.
Soustava AlCl3-FeCl3-KCl-NaCl-HCl-H2O
Předběžné údaje o rozpustnosti AlCl3, FeCl3 , KCl a NaCl ve vodných roztocích obsahujících 24 až 31 hm. pct HCl při 25° C byly získány za účelem posouzení kontaminace AlCl3-6H2O extrahovatelného z nebauxitových rud. Za tímto účelem byly připraveny 2 litry roztoku obsahujícího známé množství solí, 90 ml tohoto roztoku bylo umístěno do baňky pro každou zkoušku a poté bylo připuštěno známé množství plynné HCl, aby bylo dosaženo 24 až 31 hmotnostních procent rozpuštěné HCl. V tomto rozsahu HCl v roztoku se vysrážely bezbarvé anizotropní krystaly AlCl3-6H2O, světlé anizotropní krystaly FeCl3-2KCl-H2O a kubické izotropní průhledné krystaly KCl a NaCl, které byly identifikovány mikroskopickým vyšetřením. Postup a analýzy pro koncentrace hliníkových iontů a chloridových iontů byly stejné jako u systému AlCl3-6H2O-HCl-H2O uvedeného dříve v této zprávě. Kromě toho byla koncentrace železitých iontů stanovena standardní titrací K2Cr2O7, koncentrace sodných iontů byla stanovena technikou atomové absorpce a koncentrace draselných iontů byla stanovena odečtením koncentrace sodných iontů ze stanovení kombinované koncentrace draselných a sodných iontů po oddělení iontovou výměnou. Výsledky jsou uvedeny v tabulce 4 a vyneseny na obrázku 3. Podobné výsledky podle Milese jsou rovněž vyneseny do grafu na obrázku 3, aby se ukázalo, že shoda je vynikající. Publikované údaje pro příbuzné jednodušší systémy obsahující méně složek shromáždil Linke.
Při krystalizačních procesech s odpařováním nebo plynným rozprašováním HCl pro výrobu čistého hexahydrátu chloridu hlinitého se kontaminace jinými kovovými chloridy stává problémem, protože ve vyluhovacích roztocích narůstají hladiny nečistot. Obrázek 3 ukazuje koncentrační úrovně, při kterých nečistoty jako NaCl, KCl a FeCl2-2KCl-H2O krystalizují z roztoku také jako samostatné oddělené fáze, a způsobují tak kontaminaci krystalů AlCl3-6H2O. Například při méně než 2,4 % hmotn. FeCl3 v přítomnosti 1,6 % hmotn. KCl při 25 °C musí být koncentrace HCl nižší než 28 % hmotn., aby nedošlo ke kontaminaci AlCl3-6H2O dvojitou solí FeCl3-2KCl-H2O. Obrázek 3 je rovněž užitečný při redisoluci frakční rekrystalizace sraženiny za účelem přečištění hlinité soli. Kromě toho lze některé soli přechodných prvků, jako je FeCl3, minimalizovat částečnou elektrolýzou, aby se před okyselením HCl vyplatilo dostatečné množství železa.
Termodynamické zpracování systému s obvyklou chybou ±0,05 hm.% v koncentraci chloridových iontů není proveditelné, zejména při absenci údajů o tlaku par pro H2O(g) a HCl(g). Hrubé odhady aktivit však lze provést pomocí Kusik-Meissnerovy metody. Předpokládá se, že tyto odhady by mohly poskytnout pouze hrubé hodnoty aktivit pro hydratované a komplexní soli a pro vodu.

Oblasti doporučené pro výzkum
Měření aktivit je užitečné při interpretaci termodynamiky a kinetiky loužení, srážení a čištění požadovaných složek různých rud. Existují dva důvody, proč lze aktivity přesně určit z měření tlaku vodní páry: (1) Tlak par lze měřit s vysokou přesností pomocí diferenčních tlakových snímačů, aby bylo možné získat aw podle rovnice 7 a následně vypočítat hodnoty parametrů v rovnici 11, takže lze vypočítat všechny související vlastnosti, jak bylo podrobně popsáno dříve (2) Součin rozpustnosti i aktivity lze přesně stanovit pro vícevalentní soli, které obsahují velké množství molekul vody ve svých hydratovaných krystalech. Druhý důvod vyplývá ze skutečnosti, že exponent aktivity vody v rovnici 4 je roven počtu molů vody v hydratovaném krystalu.
Chlorid hlinitý ve vodných roztocích kyseliny chlorovodíkové
Dalším zajímavým typem experimentu pro zde diskutovaný ternární systém je měření parciálního tlaku HCl(g) nad různými roztoky obsahujícími dostatečně velké množství rozpuštěné HCl. Experimentální postup pro tento účel je popsán na jiném místě. Soli skupiny IIA, IIIA a soli přechodných kovů jsou vynikajícími kandidáty pro tento typ zkoumání, protože elektrolyty s vyšší valencí než 1:1 obvykle tvoří hydratované soli.
Rozpustnost a aktivita hexahydrátu chloridu hlinitého, AlCl3-6H2O, ve vodných roztocích byly stanoveny v rámci výzkumu Bureau of Mines, U.S. Department of the Interior, zaměřeného na zlepšení technologie zpracování nerostů pro získávání oxidu hlinitého z nekvalitních domácích zdrojů. Bylo zjištěno, že rozpustnost AlCl3 v čisté vodě je 31,09 a 31,77 % hmot. při teplotě 25 °C a 85 °C a prudce klesá na 10 a 0,1 % hmot. po přidání příslušného množství 20,3 a 37 % hmot. kyseliny chlorovodíkové (HCl) do roztoku. Byla vypočtena rovnovážná konstanta pro rozpustnost hexahydrátu, aktivity a koeficienty aktivity AlCl3 a H2O a porovnány s výsledky z dostupných metod odhadu. Ukázalo se, že výsledky jsou využitelné při loužení nebauxitových rud pro extrakci oxidu hlinitého změnou rozpustnosti složkových solí po přídavku HCl.
Byly rovněž stanoveny současné rozpustnosti AlCl3 , FeCl3, KCl a NaCl v roztocích HCl-H2O a stručně je diskutován jejich vliv na čistotu AlCl3-6H2O krystalovaného ze směsných roztoků solí.
.