Stránka mikrobiálního bioreálu o rodu Rhodospirillum rubrum
Klasifikace
Taxony vyšších řádů
Rod: Bacteria
Phylum: Proteobacteria
Třída: Proteobacteria
Class: Alphaproteobacteria
Druh: Proteobakterie
Třída: Alphaproteobacteria Rodospirillales
Člen: Rod: Rhodospirillaceae
Rod: Rhodospirillaceae Rhodospirillum
Druh
Rhodospirillum rubrum
Popis a význam
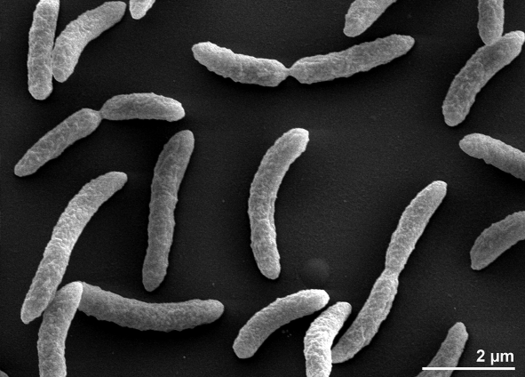
Rhodospirillum rubrum je gramnegativní mezofilníproteobakterie. Jeho optimální růstová teplota je 25-30 stupňů Celsia. Má vícevrstvé vnější obaly, které obsahují převážně nenasycené, ale i některé nasycené tuky v buněčné stěně. R. rubrum je spirilla, což znamená, že má spirálovitý tvar. Je polárně bičíkatá, a tudíž pohyblivá. Jeho délka je 3-10 um, šířka 0,8-1,0 um.
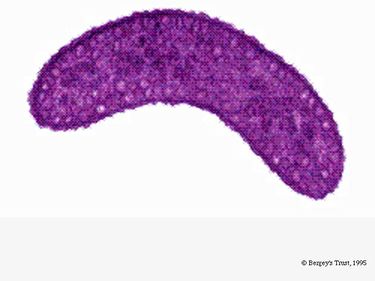
R. rubrum je fakultativní anaerob. V závislosti na přítomnosti kyslíku může podléhat alkoholovému kvašení nebo aerobní respiraci. Je také schopen fotosyntézy a ve svých chromatoforových částicích obsahuje karotenoid a bateriochlorofyl. Tyto molekuly pomáhají absorbovat světlo a přeměňovat ho na energii a také mu v anaerobních podmínkách dodávají výraznou fialovočervenou barvu. Za aerobních podmínek je R. rubrum bezbarvý.
Ačkoli je fotosyntéza za aerobních podmínek aktivní, v přítomnosti O2 je obecně potlačena. Hlavním vedlejším produktem fotosyntézy je síra, nikoli O2. R. rubrum může při fotosyntéze růst heterotrofně nebo autotrofně. Na rozdíl od mnoha rostlin neobsahuje R. rubrum chlorofyl a (absorpční spektrum 430-662 nm). Obsahuje však chlorofyl b (absorpční spektra 660-680 nm) a bakteriochlorofyly (800-925 nm). To mu umožňuje využívat více energie z elektromagnetických spekter. R. rubrum také oxiduje oxid uhelnatý (CO) s plynným vodíkem jako konečným produktem této cesty a při redukci oxidu uhličitého může v nízkých koncentracích využívat sulfid jako donor elektronů. Kromě toho je to bakterie fixující dusík; využívá nitrogenázu k přeměně atmosférického plynného dusíku na amoniak (Munk et al, 2011).
Existuje několik aplikací R. rubrum v oblasti biotechnologií. Je modelovým systémem pro přeměnu světla na chemickou energii a pro své dráhy fixace dusíku. Je také předmětem studií odolnosti vůči záření. Lze ji využít několika způsoby i pro konzumaci. Proteobakterie může být zdrojem potravy pro zvířata a zemědělským hnojivem. Další důležitá role ve výzkumu zahrnuje produkci vitaminů. Je také zkoumána pro svou výrobu biologických plastů z prekurzorů poly-hydroxy-kyseliny máselné. R. rubrum se také může podílet na výrobě biologických vodíkových paliv, především díky vývoji enzymu nitrogenázy.
Struktura genomu
Sekvenování genomu je dokončeno. Tvoří jej kruhový chromozom s 4 352 825 páry bází, z nichž 65 % tvoří páry guanin-cystosin. Dále je zde plazmid s 53 732 páry bází s 60 % guanin-cytozinových párů. Celkem existuje 3 850 genů kódujících bílkoviny a 83 genů RNA. Z těchto genů 6,9 % souvisí s transkripcí; 4,6 % s translací, strukturou ribozomů a biosyntézou; 4,0 % s replikací, rekombinací a opravami; 7,9 % s mechanismy přenosu signálu; 5,9 % s biogenezí buněčné stěny a membrán; 6,6 % s produkcí a přeměnou energie; 5,0 % s transportem a metabolismem sacharidů; 9,0 % s transportem a metabolismem sacharidů.9 % transport a metabolismus aminokyselin; 4,7 % transport a metabolismus koenzymů; 3,7 % transport a metabolismus lipidů a 6,5 % transport a metabolismus anorganických iontů(Munk et al, 2011).
Ekologie
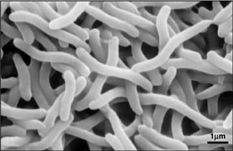
Vzhledem k tomu, že Rhodospirillum rubrum může růst aerobně i anaerobně, je schopno osídlit nejrůznější podmínky. R. rubrum se vyskytuje v mnoha přírodních vodních prostředích, jako jsou rybníky, jezera, potoky a stojaté vody (Reslewic et. al, 2005). R. rubrum se také často vyskytuje v bahně a odpadních vodách (Brock et al, 2000). Studie ukázaly, že R. rubrum může provádět velké změny svého chemického složení, aby se přizpůsobil různým prostředím (Cohen-Bazire a Kunisawa, 1963). R. rubrum preferuje růst na stanovištích s pH 6,8-7,2 (Bergey a Holt, 1994). Studie také ukázaly, že R. rubrum má optimální růstovou teplotu 22-35 °C (Weaver, 1971).
Struktura a metabolismus buněk
R. rubrum je všestranný organismus, který může získávat energii různými mechanismy. Respirační a fotosyntetické mechanismy existují společně a jejich aktivita závisí na přítomnosti světla a energie. R. rubrum může růst v tmavém chemotropickém prostředí s přítomností kyslíku nebo může růst ve fototropickém prostředí bez kyslíku.
Fotosyntéza u R. rubrum začíná donací vodíku z organického substrátu na oxidační substrát. Bakteriochlorofyl a kartenoidy, fotoreaktivní pigmenty, které se nacházejí v buněčné membráně, jsou vázány na chromatofory (Schachman, Pardee a Stanier, 1952). Chromatofory jsou zploštělé disky, které obsahují cholinfosfolipidy, kardiolipin a galaktosyl diglyceridy (Benson, Wintermans a Wiser, 1959; Benson 1961). Kromě toho chromatofory obsahují kompletní elektronový transportní řetězec, který zahrnuje různé cytochromy, flavin a pyridinové nukleotidy (Newton a Newton, 1957; Hulcher a Conti, 1960; Kamen, 1961). Buněčná membrána také obsahuje mechanismus pro syntézu ATP, včetně ATP syntetázy.
V přítomnosti kyslíku je R. rubrum schopen aerobně dýchat pomocí tradičního elektronového transportního řetězce s NAD+/NADH jako primárním nosičem elektronů (Keister a Minton, 1969). Mezi proteiny elektronového transportu patří cytochrom C428 (Chance a Smith, 1955). Aerobní dýchání je však inhibováno fotosyntézou (Oelze a Weaver, 1971).
R. rubrum je také schopen anaerobního dýchání. Mezi jeho nekyslíkové terminální akceptory elektronů mohou patřit dimethylsulfoxid a trimethylaminoxid. Přítomnost těchto akceptorů elektronů umožňuje, aby substráty jako sukcinát, malát a acetát podporovaly růst R. rubrum. Tyto akceptory jsou však z hlediska zachování energie pouze přibližně 33-41 % stejně účinné jako kyslík (Schultz a Weaver, 1982).
R. rubrum má navíc jedinečnou schopnost oxidovat oxid uhelnatý pomocí dehydrogenázy oxidu uhelnatého. Tato oxidační cesta končí redukcí a vodíkem a produkcí plynného vodíku.
Bez terminálního akceptoru elektronů dokončuje R. rubrum smíšenou kyselou fermentaci. Hlavními produkty pyruvátové fermentace jsou acetát, mravenčan, oxid uhličitý a vodík. V přítomnosti hydrogenuhličitanového iontu je možné fermentovat fruktózu. Konečné produkty této dráhy jsou stejné jako u pyruvátu, ale s přídavkem sukcinátu a propionátu (Schultz a Weaver 1982).
Kromě schopnosti fixovat oxid uhličitý (Schon a Biedermann, 1972) je identifikační anabolickou vlastností R. rubrum jeho schopnost fixovat dusík. Za tmavých podmínek s přítomností fruktózy využívá R. rubrum nitrogenázu k fixaci plynného dusíku na amonium. Obsahuje jak Fe-Mo, tak pouze Fe nitrogenázy.
Patologie
Nebylo zjištěno, že by R. rubrum infikovalo lidi nebo zvířata.
Současný výzkum
Odolnost vůči záření
Rhodospirillum rubrum nedávno poskytlo poznatky o odolnosti vůči záření. Felice Mastroleo a kol. v článku Insight into the radiotolerance of the life support bacterium Rhodospirillum rubrum S1H by means of phenotypic and transcriptomic methods (2010) charakterizovali radiační toleranci R. rubrum.
Při vystavení bakterie subletálním dávkám gama záření Cobalt-60, což je druh ionizujícího záření, byly v organismu R. rubrum charakterizovány markerové geny specifické pro ionizující záření. Exprese těchto genů se zvyšovala s „dobou zotavení“, která uplynula po dané dávce gama záření. Analýza exprese genů u R. rubrum po ozáření gama zářením vytváří potenciál pro další mikrobiologický výzkum, který může v budoucnu vést k pokroku v aplikované odolnosti vůči záření.
Biodegradabilní plasty
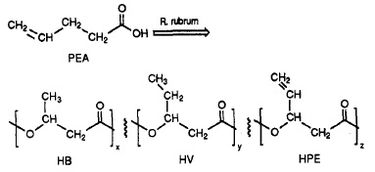
Zjistilo se, že R. rubrum produkuje třídu biodegradabilních plastů, polybeta-hydroxyalkanoáty (PHA). Aplikace tohoto výzkumu může vyřešit mnoho problémů způsobených syntetickými, nerozložitelnými plasty, které mají nepříznivý vliv na životní prostředí. Výzkumný experiment, který provedl Herbert. W. Ulmer a kol. zaznamenal produkci PHA obsahující 3HV jednotky pomocí Rhodospriillum rubrum (1993). Ulmer použil jako růstové médium pro R. rubrum kyselinu 4-pentenovou (PEA). Když byla bakterie umístěna do „podmínek produkce PHA“, byly syntetizovány PHA obsahující 3 opakující se podjednotky (poznámka: R = substituční skupina): HB (R = methyl), HV (R = ethyl), HPE (R = vinyl) (viz obrázek 1).
Syntéza funkčních, biologicky odbouratelných plastů pomocí bakterií má potenciál snížit globální znečištění a výdaje na pohonné hmoty z továren na plasty. R. rubrum lze použít jako mikrobiologický nástroj k výrobě ekologických biopolymerů.
Obnovitelná energie
Zvyšující se obavy ze znečištění životního prostředí spalováním fosilních paliv vedly k nárůstu výzkumu Rhodospirillum rubrum. Využití R. rubrum jako zdroje vodíku pro výrobu obnovitelných vodíkových paliv řeší několik problémů způsobených spotřebou fosilních paliv. Vodík se oxiduje na vodu jako produkt spalování, na rozdíl od fosilních paliv, která vytvářejí znečišťující látky, jako jsou CO, CO2, SOx a NOx. R. rubrum může produkovat vodík pomocí následující „reakce posunu vody a plynu“ (Najafpour et al, 2004):
CO + H2O → H2 + CO2
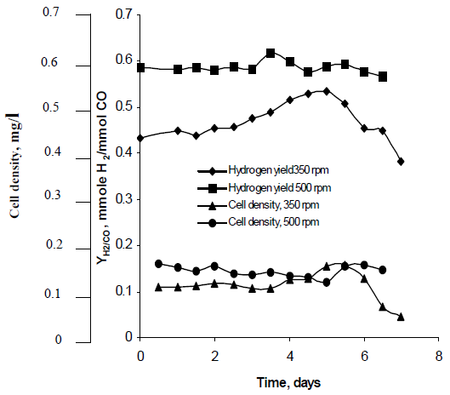
Najafpour ve své výzkumné metodě sledoval, jak míchání vytvořené sadami turbínových oběžných kol nastavených na rychlost 350 otáček za minutu i 500 otáček za minutu ovlivňuje rychlost produkce vodíku u R. rubrum. Jeho výzkum zjistil, že vodíkové palivo má potenciál omezit globální oteplování a poskytnout ekologické technologické řešení výroby a spotřeby paliv. Jeho studie odhalila, že „vyšší rychlost míchání poskytla vyšší vodík i hustotu buněk“ R. rubrum (viz obrázek 2).
V jiné mikrobiologické studii, kterou provedl Matthew Ross Melnicki, bylo zjištěno, že R. rubrum poskytuje potenciál pro obnovitelnou energii, například vodíkové palivo, prostřednictvím syntézy vodíku. Jeho biologické dráhy mohou produkovat vysoké množství vodíku při společném pěstování s Chlamydomonas reinhardtii, druhem řasy, se kterou může R. rubrum harmonicky růst. Melnicki navrhl netradiční přístup společné kultivace k syntéze vodíku, který produkuje zvýšenou úroveň syntézy vodíku, které nemusí být dosaženo, pokud je společná kultivace oddělena. C. reinhardtii byla zvýhodněna při vyšších intenzitách světla, zatímco R. ruburm byl produktivnější při nižších intenzitách světla, což zdůraznilo výhody jejich společné kultivace.
Při použití techniky krmení dávkou pro kultivaci R. rubrum bylo zjištěno, že inokulované kultury produkovaly vodík během své exponenciální růstové fáze a syntéza vodíku pokračovala nepřetržitě po dobu 70 hodin. Když se růst zastavil, přidal Melnicki sukcinát, který v metabolické dráze působí jako donor elektronů, a vývin vodíku se obnovil, i když bakterie nyní již rostly. Je však důležité poznamenat, že při neustálém přidávání sukcinátu byla zjištěna snížená rychlost vývinu vodíku. Po přidání dalšího růstového média se rychlost produkce vodíku opět zvýšila.
Melnicki rovněž uvedl, že „ačkoli pro produkci vodíku není nutný růst, tato práce stanovuje nutnost růstu buněk pro udržení maximální rychlosti, což naznačuje průmyslovou vhodnost strategie semikontinuální kultivace“ (Melnicki, 2009).
Cool Factor
Sekvence genomu Rhodospirillum rubrum je po R. centenum teprve druhou publikovanou sekvencí rodu Rhodospirillum (Munk et al, 2011).

Zajímavým aspektem Rhodospirillum rubrum je jeho schopnost měnit barvu za různých podmínek. Je to anoxygenní fototrof, ale neprodukuje extracelulární kyslík. Místo toho při sběru světla produkuje elementární síru. To je způsobeno tím, že R. rubrum postrádá komplex 2 pro sklizeň světla (Munk et al, 2011). Bakterie využívá bakteriochlorofyl, což jí umožňuje absorbovat vlnové délky světla, které rostliny nevyužívají. Bakteriochlorofyl absorbuje vlnové délky 800-925 nm.
V aerobních podmínkách je fotosyntetická aktivita R. rubrum geneticky potlačena a bakterie se stává bezbarvou. Za anaerobních podmínek se však fotosyntéza aktivuje a bakterie získává výrazně purpurově červenou barvu (viz obrázek 5). Je to způsobeno aktivitou v chromatoforech, které se nacházejí v membráně (Munk et al, 2011). Chromatofory obsahují bakteriální chlorofylové pigmenty a během aktivace fotosyntézy podléhají absorpčním změnám.
Benson, A. „Chloroplast lipid metabolism“. In Symposium no. VI. V. mezinárodním biochemickém kongresu. 1961. Oxford: Pergamon Press. (V tisku.)
Benson, A., Wintermans, J. a Wiser, R. „Chloroplastové lipidy jako zásobárny sacharidů“. Plant Physiology. 1959. Volume 34. p. 815.
Bergey, D. and Holt, J. Bergey’s manual of determinative bacteriology. Deváté vydání. Baltimore. Lippincott Williams and Wilkins. 1994. s. 359.
Brock, T.D., M.T. Madigan, J.M. Martinko a J. Parker. Biologie mikroorganismů. Vydání deváté. Upper Saddle River: Prentice Hall, 2000. s. 459.
Chance, B. a Smith, L. „Respirační pigmenty Rhodospirillum rubrum.“ Nature. Volume 174. p. 803-806.
Cohen-Bazire, G. and Kunisawa, R. „The Fine Structure of Rhodospirillum Rubrum .“ (Jemná struktura Rhodospirillum rubrum). Journal of Cell Biology. 1963. Volume 16. p. 401-419.
Hulcher, M. and Conti, S. „Cytochronies in chlorophyll-containing particles of Chromatium and Chlorobium thiosuphatophilum“. Biochemistry and Biophysics Research Communications. 1960. Volume 3. p. 497.
Kamen, M. „The Haem Proteins of Photosynthetic Tissues“. In Symposium no. VI. V. mezinárodním kongresu o biochemii. 1961. Oxford: Pergamon Press. (V tisku.)
Keister, D. a Minton, N. „Energy-linked reactions in photosynthetic bacteria. 3. Further studies on energy-linked nicotinamide-adenine dinucleotide reduction by Rhodospirillum rubrum chromatophores“. Biochemie. 1969. Volume 8. p. 167-173.
Mastroleo, F., Monsieurs, P., and Leys, N. „Insight into the radiotolerance of the life support bacterium Rhodospirillum rubrum S1H by means of phenotypic and transcriptomic methods“. Vědecké shromáždění COSPAR. 2010. s. 4.
Melnicki, M. R. „Modes of hydrogen production in the photosynthetic bacterium, Rhodosphirillum rubrum“. University of California, Berkeley. 2009.
Munk, C., Copeland, A., Lucas, C., Lapidus, A., et al. „Complete genome sequence of Rhodospirillum rubrum type strain (S1T)“. Standardy v genomických vědách. 2011. Volume 4. pp. 293-302.
Najafpour, G., Ismail, K., Younesi, H., Mohamed, A. R., and Kamaruddin, A. H. „Hydrogen as clean fuel via continuous fermentation by anaerobic photosynthetic bacteria, Rhodospirillum rubrum“. African Journal of Biotechnology. 2004. Volume 3. pp. 503-507.
Newton, J. and Newton, G. „Composition of the photoactive subcellular particles from Chromatium“. The Archives of Biochemistry and Biophysics. 1957. Volume 71. p. 250.
Oelze, J. and Weaver, P. „The adjustment of photosynthetically grown cells of Rhodospirillum rubrum to aerobic light conditions“. The Archives of Microbiology. 1982. Volume 79. p. 108-121.
Reslewic, S., Shigou, Z., Place, M., Zhang, Y., Briska A., Goldstein, S., Churas, C., Runnheim, R., Forrest, D., Lim, A., Lapidus, A., Han, C., Roberts, G., and Schwartz, D. „Whole-Genome Shotgun Optical Mapping of Rhodospirillum rubrum .“ Applied and Environmental Microbiology. 2005. Volume 71. p. 5511-5522.
Schachman, H., Pardee, A., and Stanier, R. „Studies on the macromolecular organization of microbial cells“ (Studie makromolekulární organizace mikrobiálních buněk). The Archives of Biochemistry and Biophysics. 1952. Volume 38. p. 245-260.
Schön, G. and Biedermann, M. „Synthesis of volatile acids by fermentation of pyruvate and fructose in anaerobic dark cultures of Rhodospirillum rubrum“. Archiv fur Mikrobiologie. 1972. Volume 85. p. 77-90.
Schultz, J. and Weaver, P. „Fermentation and anaerobic respiration by Rhodospirillum rubrum and Rhodopseudomonas capsulate“. The Journal of Bacteriology. 1982. Volume 149. p. 181-190.
Ulmer, H., Gross, R., Posada, M., Weisbach, P., Fuller, R. C., and Lenz, R. „Bacterial production of poly(.beta.-hydroxyalkanoates) containing unsaturated repeating units by Rhodospirillum rubrum“. Macromolecules. 1994. Volume 27. p. 1675-1679.
Weaver, P. „Temperature-Sensitive Mutations of the Photosynthetic Apparatus of Rhodospirillum rubrum“. Proceedings of the National Academy of Sciences of the United States of America. 1971. Volume 68. p. 136-138.
Edited by students of Dr. Iris Keren: Allison Almeida, Matthew Cozzolino, Trung Nguyen a Jessica Wong.
NEUF2011
.