- Odůvodnění
- Normální fyziologie a patofyziologie draslíku
- Akční potenciál kardiomyocytu, který není kardiostimulátorem
- Akční potenciál kardiostimulační buňky
- Provádění proudu
- Refrakterní perioda
- Hyperkalémie, klasifikace a příčiny
- Klasifikace
- Příčiny
- Příznaky hyperkalemie
- Metabolické účinky
- Natrium-draselná pumpa
- Závěr
Odůvodnění
Draslík je měkký, stříbřitě bílý vysoce reaktivní kationt patřící do skupiny alkalických kovů v periodické tabulce. Je nejrozšířenějším kationtem v lidském těle jako celku a nejrozšířenějším iontem v jeho nitrobuněčných kompartmentech.
Západní strava obsahuje v průměru 80-100 mEq draslíku denně a za normálních fyziologických podmínek se 90 % z něj vstřebává pasivně, takže pro vylučování stolicí zbývá pouze 9,0 mmol. 3500-4000 mmol uchovávaných v těle je v nepoměru k denním hladinám draslíku v plazmě, které jsou za normálních okolností udržovány v rozmezí 3,5-5,3 mmol/l díky přísným mechanismům homeostázy, přičemž nejnižší hladiny jsou v noci a v časných ranních hodinách a nejvyšší hladiny v odpoledních hodinách.
Po vstřebání do krevního oběhu se stává úkolem ledvin vyrovnat příjem draslíku s jeho výdejem; to vyžaduje několik hodin, během nichž „vnitřní rovnováha draslíku“ pod vlivem inzulínu a katecholaminů udržuje dočasnou homeostázu přesunem draslíku mezi intracelulárním a extracelulárním prostorem. Stimulace alfa receptorů brání vstupu draslíku do buněk a stimulace beta receptorů jej podporuje aktivací sodno-draselné ATPázové pumpy.
Sodno-draselná ATPázová pumpa je enzym „gate-keeper“ umístěný v sarkolemě. Pomáhá chránit 98 % draslíku (přibližně 144,0 mmol) zadržovaného uvnitř buňky. Tím zajišťuje zachování životně důležitého rozdílu potenciálů přes buněčné membrány potřebného pro správnou funkci buněk, zejména vzrušivých buněk, jako jsou nervové buňky a buňky srdečního svalu.
Normální fyziologie a patofyziologie draslíku
Po svém rychlém vstřebání pomáhá draslík organizovat vlastní hladiny v těle prostřednictvím uvolňování inzulínu a aldosteronu. Mezi další neodmyslitelné tělesné podněty, které rovněž řídí tělesné hladiny draslíku, patří beta-2 adrenergní receptory, zásadité PH krve a buněčný anabolismus.
Uvolňování inzulínu a aldosteronu: Požitý draslík se rychle dostává do oběhu. Po dosažení portálního oběhu stimuluje slinivku břišní k uvolňování inzulinu. Současně cirkulující draslík, který se dostane do juxtaglomerulárních buněk, vede k uvolnění reninu. Renin se po dosažení jater přemění na angiotenzin I. Angiotenzin I putuje do plic, kde se přemění na angiotenzin II. Angiotenzin II pak dokončí svou cestu cirkulující krví zpět do ledvin, kde stimuluje zona glomerulosa k sekreci aldosteronu.
Vnitřní rovnováha draslíku: Inzulín uvolněný postprandiálně působí především na kosterní svaly a aktivuje dvě dráhy, dráhu závislou na AKT, která je zodpovědná za vložení glukózového transportéru GLUT4, a dráhu APK aktivující buněčnou sodíko-draslíkovou ATPázu k přesunu draslíku do nitrobuněčného prostoru. Na rozdíl od dráhy závislé na AKT není dráha APK narušena ani metabolickým syndromem, ani chronickým onemocněním ledvin (obrázek 1).
Vylučování: Draslík filtrovaný ledvinnými glomeruly se pasivně reabsorbuje v proximálním tubulu a Henleově kličce úměrně množství dodaného sodíku a vody. Za normálních okolností se do distálního nefronu dostává jen asi 10 % filtrované zátěže.
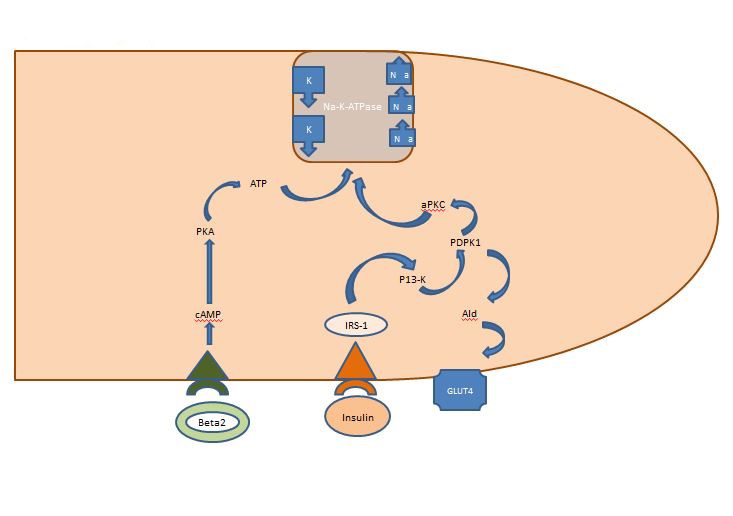
Obrázek 1: Jaké je množství kalia? Působení inzulinu na buňku kosterního svalu. Inzulin uvolněný postprandiálně aktivuje v kosterních svalech dvě dráhy, dráhu závislou na AKT, která je zodpovědná za vložení glukózového transportéru GLUT4, a dráhu APK, která aktivuje buněčnou sodíko-draslíkovou ATPázu k přesunu draslíku do intracelulárního prostoru.
Na začátku distálního stočeného tubulu začíná sekrece přebytečného draslíku, která se postupně zvyšuje, jak postupuje dále směrem k distálnímu nefronu a do sběrného kanálku. To je zprostředkováno zvýšením regulace vodíkové draslíkové ATPázy na alfa-interkalárních buňkách .
Přítomnost vyšších hladin draslíku v peritubulárních buňkách ledvin aktivuje systém RAAS k uvolnění aldosteronu, který aktivuje sodno-draslíkovou ATPázu na bazolaterální membráně, což vede k poklesu intracelulárního sodíku, který vede ke zvýšenému elektrogennímu transportu vychytávání draslíku hyperpolarizací membránového napětí a umožňuje jeho vylučování do moči .
Při hyperkalémii se může kvóta draslíku vyloučeného tlustým střevem zvýšit až o 30 %, např, v případech selhání ledvin, kdy je pak draslík aktivně vychytáván aktivovanou sodno-draselnou ATPázovou pumpou v bazolaterální membráně enterocytů tlustého střeva, aby byl vyloučen na druhé straně, do lumen tlustého střeva přes apikální velké draslíkové kanály závislé na vápníku v buňkách.
Z výše uvedeného je tedy patrné, že mechanismus homeostázy plazmatické hladiny draslíku je zasvěcen především souhře tří souběžných transakcí – příjmu draslíku, intra/extracelulárních přesunů draslíku a vylučování draslíku močí, z nichž všechny v konečném důsledku závisí na sodno-draselné pumpě.
K pochopení mechanismu bezprostředního nebezpečí plynoucího z hyperkalémie a jejího zvládání je třeba porozumět fyziologii akčního potenciálu a vnitřnostem enzymu sodno-draselné ATPázy.
Elektrofyziologie akčního potenciálu, tj, pohyb iontů přes buněčné membrány, je určován rozdílem dvou potenciálů, „chemického potenciálu“, při němž se ionty pohybují po svém koncentračním gradientu, a „elektrického potenciálu“, při němž se ionty a molekuly odpuzují stejnými náboji, čímž vzniká transmembránový potenciál (TMP), o němž se říká, že je +ve, když čistý pohyb +ve iontů směřuje ven z buňky a naopak.
Akční potenciál kardiomyocytu, který není kardiostimulátorem
Existuje pět fází akčního potenciálu, které začínají a končí ve 4. fázi. Mezi pumpy, které se na tomto procesu podílejí, patří sarkolemový sodíkový výměník, vápníková ATPáza a nakonec sodíko-draslíková ATPáza.
- Fáze 4. Klidová fáze: má klidový potenciál -90 mV v důsledku neustálého pohybu draslíku směrem ven přes inward rectifier kanály. Během této fáze jsou sodíkové i vápníkové kanály uzavřeny.
- Fáze 0. Fáze depolarizace: vypálení pacemakerové buňky nebo její vedení přes sousední buňku vyvolá vzestup TMP nad -90 mV. V tomto okamžiku se ,,rychlé sodíkové kanály“ začnou jeden po druhém otevírat, čímž umožní vstup sodíku do buňky, zvýšení TMP, a jakmile se otevře dostatečný počet rychlých sodíkových kanálů, aby se dosáhlo -70 mV, uvede se do pohybu samoudržující vnitřní sodíkový proud, rychlá depolarizace TMP na 0 mV po přechodnou dobu známou jako „overshoot“, kdy se časově závislé rychlé sodíkové kanály uzavřou a „dlouho se otevírající“ vápníkové kanály se otevřou, aby zvýšily TMP na -40 mV a umožnily malý stálý přítok vápníku po jeho koncentračním gradientu.
- Fáze 1. Časná fáze repolarizace: začíná mírně +ve TMP a krátkým otevřením některých draslíkových kanálů, což má za následek jeho tok směrem ven z buňky, čímž se TMP vrátí přibližně na 0 mV.
- Fáze 2. Fáze plateau: zde jsou oba protiproudy elektricky vyrovnané a vedou k udržení rovnováhy TMP těsně pod 0 mV. „Dlouho otevírané vápníkové kanály“ jsou stále otevřené, což vede ke konstantnímu toku vápníku do buňky. Draslíkový kanál se zpožděným usměrněním umožňuje průchod draslíku směrem ven z buňky po jejím koncentračním gradientu.
- Fáze 3: Draslíkový kanál se zpožděným usměrněním. Fáze repolarizace: během této fáze jsou vápníkové kanály postupně inaktivovány a trvalý tok draslíku směrem ven z buňky tak převyšuje tok vápníku směrem dovnitř, čímž se draslík vrací do intracelulárního prostoru a sodík a vápník směrem ven z buňky.
Akční potenciál kardiostimulační buňky
Kardiostimulační buňky mají vrozenou automatiku, která umožňuje jejich depolarizaci v rytmických cyklech. Nejvyšší samočinný depolarizační rytmus má sinoatriální uzel (SAN) s rychlostí 60-90/min, následuje atrioventrikulární uzel (AVN) s rychlostí 40-60/min a poté Purkyňova vlákna a komorový sval s rychlostí 20-40/min.
Membránové potenciály kardiostimulačních buněk jsou nestabilní a jejich akční potenciály nemají jasně vymezené fáze. Mají méně draslíkových kanálů s vnitřním usměrňovačem a jejich TMP nikdy neklesá pod -60 mV, což eliminuje roli rychlých sodíkových kanálů, které vyžadují TMP -90 mV, což vede k absenci fáze rychlé depolarizace.
Při TMP >-60 mV se uvede do činnosti „zábavný/pacemakerový“ proud se spontánním tokem iontů přes pomalé sodíkové kanály, který depolarizuje TMP na <-50 mV a poté zpět na -60 mV, když se vápníkové kanály uzavřou.
Provádění proudu
Všechny kardiomyocyty jsou elektricky propojeny přes gap junction, včetně pacemakerové buňky. To usnadňuje rozsáhlou depolarizaci všech sousedních buněk, čímž se srdce mění v jednu funkční jednotku, v níž se buňka s nejvyšší vlastní frekvencí stává „pacemakerem“.
Refrakterní perioda
Dlouhá refrakterní perioda během dlouhého plató ve fázi 2 díky pomalým vápníkovým kanálům poskytuje čas potřebný pro úplné vyprázdnění komor před další kontrakcí. Refrakterní periody mohou být absolutní (ARP), efektivní (ERP) nebo relativní (RRP). Při ARP je buňka absolutně nevzrušivá.
ERP trvá od ARP do krátkého úseku 3. fáze. Podnět v tomto okamžiku může buňku minimálně depolarizovat, ale úroveň depolarizace je slabší než šíření akčního potenciálu do sousedních buněk.
RRP je vyvolán nadstandardním podnětem, který vede k depolarizaci buňky a vzniku akčního potenciálu.
„Nadnormální perioda“ je hyperexcitabilní stav, během kterého by slabší než normální podnět mohl vést k arytmii, což vyžaduje synchronizaci během kardioverze, aby se zabránilo fibrilaci komor (obr. 2).
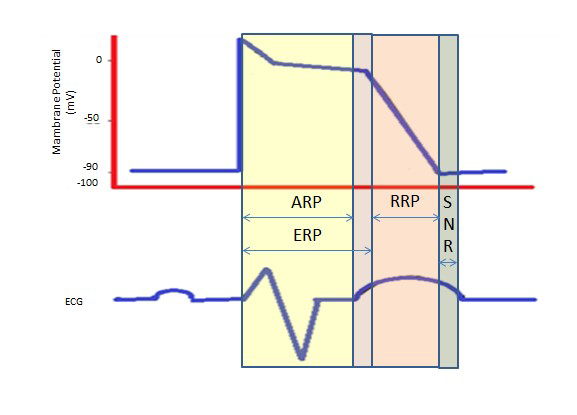
Obrázek 2. Refrakterní periody. ARP: Absolutní refrakterní perioda; ERP: Efektivní refrakterní perioda; RRP: Relative Refractory Period; SNR: Supranormal Refractory Period
Hyperkalémie, klasifikace a příčiny
Klasifikace
Hyperkalémie je klasifikována jako mírná při hladinách v rozmezí 5,5-6,0 mmol/l, středně závažná od 6,1-6,9 mmol/l a závažná při hladinách 7.0 mmol/L nebo vyšší, a to při jakékoliv hladině, při které se objeví změny na EKG .
Příčiny
Hyperkalémie vzniká, když kompenzační mechanismy již nejsou schopny vyrovnat se s nerovnováhou, a proto je obvykle multifaktoriální.
- Zvýšení příjmu draslíku jakoukoliv cestou, např. při zvýšeném přívodu draslíku do organismu, perorálním příjmem stravy nebo intravenózním podáním tekutin obsahujících draslík, např. penicilinu G.
- Zadržování draslíku ledvinami: Vzhledem k tomu, že vylučování draslíku závisí na aldosteronu a dodávce dostatečného distálního množství sodíku a vody v nefronech, stavy jako selhání ledvin, nedostatečnost nadledvin (Addisonova choroba) , hyporeninemický hypoaldosteronismus typu IV, renální tubulární acidóza, zejména u pacientů s diabetickou nefropatií, a také jakýkoli stav, který podporuje hypoperfuzi, jako je objemová deplece a městnavé srdeční selhání, ovlivňují složitou rovnováhu draslíku v těle a predisponují k hyperkalémii.
- Adrenální insuficience: tu je třeba u pacientů s hyperkalémií vyloučit, zejména v přítomnosti hyponatrémie a svalové slabosti. Ke screeningu primární adrenální insuficience se provádí standardní kosyntropinový stimulační test, při kterém se podá 0,25 mg syntetického kosyntropinu jako intravenózní bolus a po 45 minutách až 1 hodině následuje měření plazmatického kortizolu. Hodnoty nižší než 20 mcg/dl svědčí pro adrenální insuficienci.
- Léky, které zadržují draslík: léky na předpis, které snižují aktivitu sodno-draselné ATPázy, jako jsou blokátory beta-adrenergních receptorů, a léky, které snižují sekreci aldosteronu, jako jsou inhibitory ACE a ARB, nesteroidní protizánětlivé léky a draslík šetřící diuretika, je třeba pečlivě sledovat, aby se zabránilo iatrogenní hyperkalémii, zejména u geriatrické věkové skupiny s jejím postupným poklesem renálních funkcí v rámci procesu stárnutí.
- Narušení transcelulárního posunu draslíku: může k němu dojít při stavech acidózy, hyperglykémie, hyperosmolality, těžkém cvičení, rozpadu tkání, hyperkalemické periodické paralýze a při beta-adrenergních blokátorech. Na každý pokles PH v krvi o 0,1 jednotky se sérový draslík zvýší přibližně o 0,6 mmol/l (méně, pokud je acidóza způsobena organickými kyselinami) .
- Pseudohypoaldosteronismus je vrozené autozomálně recesivní onemocnění, při kterém jsou ledviny rezistentní vůči působení aldosteronu.
- Nepřehlédnutelná je také pseudohyperkalémie: jak název napovídá, dochází k ní při zvýšeném sérovém draslíku za přítomnosti normálního draslíku v plazmě. Může se vyskytovat při hemolýze krve, dlouhodobém těsném zaškrcení při odběru krve, které způsobuje extracelulární uvolnění draslíku, při opakovaném zatínání pěsti při flebotomii, traumatické venepunkci, při leukocytóze a trombocytóze a u některých neobvyklých genetických syndromů, jako je familiární pseudohyperkalémie a hereditární sférocytóza. Může však jít jednoduše jen o důsledek prosté laboratorní chyby.
Příznaky hyperkalemie
Mírná hyperkalemie je často asymptomatická, náhodně zjištěná laboratorními testy, a to díky svým neurčitým příznakům, jako je malátnost, svalová slabost a parestezie. Těžká hyperkalémie ovlivní nervosvalovou funkci v podobě slabosti kosterního svalstva a paralýzy; to však není častý projev, protože v obraze dominuje kardiální toxicita, která je předběžným projevem. Srdeční toxicita se na EKG obvykle projeví následujícím stupňovitě se stupňujícím způsobem, i když tomu tak nemusí být nutně, v závislosti na etiologii:
- Při hladinách vyšších než 5,5 mEq/l zvyšuje zvýšení vodivosti draslíkových kanálů proud lkr, což vede k rychlé repolarizaci v podobě vrcholové vlny T na povrchovém EKG. Tyto vlny T lze odlišit od vln při infarktu myokardu a CVA díky jejich krátkému trvání v rozmezí 150-250 msec.
- Při hladinách draslíku vyšších než 6,5 mEq/l dochází ke stavu trvalé podprahové depolarizace, která způsobuje zpoždění depolarizace síní a komor. Pokles fáze 0 akčního potenciálu vede k prodloužení akčního potenciálu, což způsobuje zpoždění intraventrikulárního a atrioventrikulárního vedení. Na povrchovém EKG se to projeví zploštěním a ztrátou vln P a rozšířením komplexů QRS. S rostoucím zpožděním intraventrikulárního vedení se na povrchovém EKG začnou objevovat známky blokády levého a pravého raménka. Od onemocnění ramének se dá odlišit tím, že při hyperkalémii zpoždění přetrvává v celém komplexu QRS, nejen v jeho počáteční, respektive konečné části.
- Při 10 mEq/L již nedochází k sinoatriálnímu vedení a nastupuje zrychlený junkční rytmus. Komorové arytmie se rozvíjejí splynutím rozšířených komplexů QRS s vlnami T, které nakonec vytvoří klasický sinusový vzorec. Jakmile k tomu dojde, hrozí VF a asystolie a následně dojde k srdeční zástavě.
- Někdy mohou být změny nepravidelné a nepředvídatelné a EKG bude přeskakovat z normálního stavu do asystolie v důsledku variability etiologických faktorů a jejich vlivu, např. rychlosti změny draslíku, koncentrace vápníku, pH a koncentrace sodíku. Hyperkalemie by tedy měla být urgentně léčena vždy, když hladina draslíku přesáhne 6,5 mmol/l, nebo v případě přítomnosti EKG projevů hyperkalemie bez ohledu na hladinu draslíku. Další hlášené asociace s akutní hyperkalémií zahrnují: obraz pseudoinfarktu na EKG záznamu s masivním ST-T segmentem v důsledku derangementu v repolarizaci myocytů, krátké PR a QT intervaly, sinusovou tachykardii, sinusovou bradykardii, idioventrikulární rytmus, srdeční blokádu 1. a 2. stupně .
Metabolické účinky
Hyperkalémie vede k hyperchloremické metabolické acidóze, protože hyperkalémie podporuje intracelulární vychytávání draslíku výměnou za vodíkové ionty. Tím vzniká intracelulární alkalóza, která potlačuje produkci amoniaku v ledvinách v proximálních tubulech, což vede ke snížení vylučování amoniaku a kyselin močí a k renální tubulární acidóze typu IV .
Natrium-draselná pumpa
Natrium-draselnou ATPázu objevil v roce 1957 Skou, kterému byla později za tento objev udělena část Nobelovy ceny za chemii za rok 1997.
Skou jako první objevil natrium-draselnou ATPázu v sarkolemě buněčného povrchu srdečního svalu. Její přítomnost byla později zjištěna ve všech eukaryotických jednobuněčných i mnohobuněčných organismech.
Natrium-draslíková pumpa funguje tak, že spojuje hydrolýzu ATP s buněčným exportem tří sodíkových iontů výměnou za dva draselné ionty proti jejich elektrochemickému gradientu. Je molekulárním cílem digitalisu a digoxinu, které se používají od 18. století jako výtažky z náprstníku.
Působení sodno-draselné pumpy je regulováno fosfoproteinem fosfolemanem, jehož nefosforylace vede k inhibici pumpy a jehož fosforylace vede ke zvýšení aktivity pumpy. Má tři fosforylační místa, dvě místa palmitoylace a jedno místo glutathionylace, což vysvětluje množství signálů schopných stimulovat a inhibovat pumpu.
Sama sodíko-draslíková pumpa je enzym složený z více podjednotek s více izoformami. Pro její funkci je nezbytná přítomnost podjednotek alfa a beta (především B1 v srdci). Nedávno byla v ledvinách identifikována třetí proteinová podjednotka gama, jejíž funkce však doposud zůstává neznámá.
Podjednotka alfa je katalytickým jádrem enzymu sodno-draselné pumpy. Má přibližně 100 kDa a obsahuje vazebná místa pro sodík, draslík, ATP a kardiotonické steroidy, jako je ouabain. Pouze alfa 1 a alfa 2 vykazují významnou přítomnost v normálním srdečním myocytu a jsou funkčně spojeny se sodíkovým výměníkem vápníku (NCX). Uvádí se, že alfa 3 nahrazuje alfa 2 v experimentálních modelech srdečního selhání .
Údaje z nedávných experimentů svědčí pro zapojení obou podjednotek alfa 1 alfa 2 pumpy do regulace vazby vzruch-kontrakce (E-C). Předpokládá se, že alfa 1, která je rovnoměrněji rozložena po celém sarkolemu, hraje spíše roli „hospodáře“ a kontroluje jak kontraktilitu, tak objem intracelulárního sodíku, zatímco alfa 2, jejíž exprese je soustředěna v T-tubulech spolu s dalšími klíčovými složkami E-C spojení, se zaměřuje hlavně na kontraktilitu .
Známé faktory, které mohou kontrolovat sodíko-draslíkovou pumpu, jsou např: ATP, intracelulární sodík, subsarkolemální bariéry a mlžné prostory, membránový potenciál, intracelulární signální dráhy (adrenergní signální dráhy, proteinkináza A & C, oxid dusnatý, fosfoleman), přímá regulace malými molekulami (lipidy, endogenní kardiotonické steroidy), další přidružené proteiny (kaveoly a kaveoliny a ankyrin).
Závěr
Hyperkalémie představuje klinický problém a může se vyskytovat až u 10 % hospitalizovaných pacientů . Její konečný výsledek je život ohrožující. Vzhledem k tomu, že všechny buňky v těle jsou v konečném důsledku ovlivněny sodíko-draslíkovou pumpou a je známo, že ischemické srdeční svaly extracelulárně vylučují draslík, což vede ke snížení prahu arytmie s možností vzniku komorových arytmií, které hypopolarizaci zhoršují a práh ještě více snižují, je třeba zaměřit více studií na manipulaci s enzymem sodík-draslík, protože jeho kontrola by mohla příznivě změnit výsledky srdečních zástav a přepsat současná doporučení pro KPR.