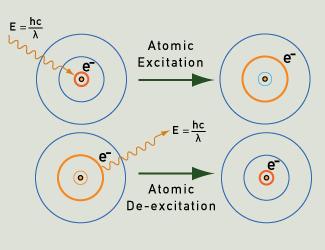
Fotony světla jsou emitovány, když elektron po excitaci klesne zpět do základního stavu.
Plamenné zkoušky
Plamenné zkoušky jsou užitečné, protože excitace plynu vytváří pro prvek charakteristické čárové emisní spektrum. Oproti tomu žhavení vytváří souvislý světelný pás s vrcholem závislým na teplotě horkého objektu.
Při excitaci atomů plynu nebo páry, například zahříváním nebo působením elektrického pole, mohou jejich elektrony přecházet ze základního stavu na vyšší energetické hladiny. Když se vracejí do základního stavu po jasně definovaných drahách podle kvantových pravděpodobností, vyzařují fotony o velmi specifické energii. Tato energie odpovídá určitým vlnovým délkám světla, a vytváří tak určité barvy světla. Každý prvek má „otisk prstu“ ve smyslu svého čárového emisního spektra, jak ilustrují následující příklady.

Čárové spektrum pro vodík.

Čárové spektrum pro helium.

Čárová spektra pro neon.
Protože každý prvek má přesně definované čárové emisní spektrum, jsou vědci schopni je identifikovat podle barvy plamene, který produkují. Například měď vytváří modrý plamen, lithium a stroncium červený plamen, vápník oranžový plamen, sodík žlutý plamen a baryum zelený plamen.

Tento obrázek ilustruje charakteristické barvy, které vznikají při hoření jednotlivých prvků.

Plámen z kyslíkoacetylenového hořáku hoří při teplotě přes 3000?C, což je dostatečná teplota pro použití ke svařování pod vodou.
Plámen
Barva vypovídá o teplotě plamene svíčky. Vnitřní jádro plamene svíčky je světle modré a jeho teplota se pohybuje kolem 1670 K (1400 °C). To je nejžhavější část plamene. Barva uvnitř plamene se mění na žlutou, oranžovou a nakonec červenou. Čím dále se dostanete od středu plamene, tím nižší bude teplota. Červená část má teplotu kolem 1070 K (800 °C).
Oranžová, žlutá a červená barva v plameni nesouvisí pouze s teplotou barvy. Významnou roli v barvě plamene hrají také excitace plynů. Jednou z hlavních složek hořícího plamene jsou saze, které mají složité a různorodé složení sloučenin uhlíku. Rozmanitost těchto sloučenin vytváří prakticky souvislou škálu možných kvantových stavů, do kterých mohou být excitovány elektrony. Barva vyzařovaného světla závisí na energii vyzařované každým elektronem, který se vrací do svého původního stavu.