Dávkovací forma: kapsle
Medicínsky přezkoumáno Drugs.com. Naposledy aktualizováno 1. října 2020.
- Přehled
- Nežádoucí účinky
- Dávkování
- Odborné
- Tipy
- Interakce
- Další
K omezení vývoje léko-.rezistentních bakterií a zachování účinnosti nitrofurantoinu (makrokrystalů) a dalších antibakteriálních léčiv, by se nitrofurantoin (makrokrystaly) měl používat pouze k léčbě nebo prevenci infekcí, u nichž je prokázáno nebo existuje silné podezření, že jsou způsobeny bakteriemi.
- POPIS:
- KLINICKÁ FARMAKOLOGIE:
- MIKROBIOLOGIE
- Mechanismus účinku
- Interakce s jinými antibiotiky
- Vývoj rezistence
- INDIKACE A POUŽITÍ:
- KONTRAINDIKACE:
- VAROVÁNÍ:
- Plicní reakce:
- Hepatotoxicita:
- Neuropatie:
- Hemolytická anémie:
- Průjmy spojené s Clostridium difficile:
- POKYNY:
- Informace pro pacienty:
- Obecně:
- Lékové interakce:
- Interakce mezi léčivem a laboratorními testy:
- Karcinogeneze, mutageneze, poškození plodnosti:
- Těhotenství:
- Těhotenství kategorie B.
- Porod a porod:
- Kojící matky:
- Pediatrické použití:
- Geriatrické použití:
- NĚŽNÉ REAKCE:
- Respirační:
- Jaterní:
- Neurologické:
- Dermatologické:
- Alergické:
- Gastrointestinální:
- Hematologické:
- Různé:
- Laboratorní nežádoucí účinky:
- Předávkování
- DÁVKOVÁNÍ A ZPŮSOB PODÁVÁNÍ:
- Dospělí:
- Pediatričtí pacienti:
- Jak se dodává:
- ZÁKLADNÍ LÉČIVÝ PŘÍPRAVEK – 50 mg
- ZÁKLADNÍ LÉČIVÝ PŘÍPRAVEK – 50 mg 100 mg
- Často kladené otázky
- Další informace o nitrofurantoinu
- Zdroje pro spotřebitele
- Zdroje pro odborníky
- Související léčebné příručky
POPIS:
Nitrofurantoin, USP (makrokrystaly) je syntetická chemická látka s kontrolovanou velikostí krystalů. Je to stabilní, žlutá, krystalická sloučenina. Nitrofurantoin, USP (makrokrystaly) je antibakteriální látka pro specifické infekce močových cest. Je dostupný v 25 mg, 50 mg a 100 mg tobolkách k perorálnímu podání.
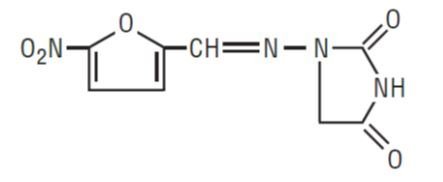
1-AMINO]-2, 4-IMIDAZOLIDINEDIONE
Neúčinné látky: Každá tobolka obsahuje D&C žlutou č. 10, FD&C modrou č. 1, FD&C modrou č. 2, FD&C červenou č. 40, želatinu, černý oxid železitý, bezvodou laktózu, magnesium-stearát, předželatinovaný kukuřičný škrob, natrium-lauryl-sulfát, mastek a oxid titaničitý. Tobolky 50 mg a 100 mg obsahují také FD&C žlutou č. 6.
KLINICKÁ FARMAKOLOGIE:
Nitrofurantoin (makrokrystaly) je větší krystalická forma nitrofurantoinu. Absorpce nitrofurantoinu (makrokrystalů) je pomalejší a jeho vylučování poněkud menší ve srovnání s nitrofurantoinem. Koncentrace v krvi při terapeutickém dávkování jsou obvykle nízké. Je dobře rozpustný v moči, které může dodávat hnědou barvu.
Při dávkovacím režimu 100 mg čtyřikrát denně po dobu 7 dnů byla průměrná výtěžnost léčiva v moči (0 až 24 hodin) 1. a 7. den 37 mg.9 % a 35,0 %.
Na rozdíl od mnoha jiných léčiv může přítomnost potravy nebo látek zpomalujících vyprazdňování žaludku zvýšit biologickou dostupnost nitrofurantoinu (makrokrystalů), pravděpodobně tím, že umožňuje lepší rozpouštění v žaludečních šťávách.
MIKROBIOLOGIE
Nitrofurantoin je nitrofuranová antimikrobiální látka s aktivitou proti některým grampozitivním a gramnegativním bakteriím.
Mechanismus účinku
Mechanismus antimikrobiálního účinku nitrofurantoinu je mezi antibakteriálními látkami neobvyklý. Nitrofurantoin je redukován bakteriálními flavoproteiny na reaktivní meziprodukty, které inaktivují nebo mění bakteriální ribozomální proteiny a další akromolekuly. V důsledku těchto inaktivací jsou inhibovány životně důležité biochemické procesy syntézy proteinů, aerobního energetického metabolismu, syntézy DNA, syntézy RNA a syntézy buněčné stěny. Nitrofurantoin je v terapeutických dávkách baktericidní v moči. Široce založený charakter tohoto způsobu účinku může vysvětlovat absenci získané bakteriální rezistence na nitrofurantoin, protože nezbytné vícenásobné a současné mutace cílových makromolekul by byly pro bakterie pravděpodobně smrtelné.
Interakce s jinými antibiotiky
In vitro byl prokázán antagonismus mezi nitrofurantoinem a chinolonovými antimikrobiky. Klinický význam tohoto zjištění není znám.
Vývoj rezistence
Vývoj rezistence k nitrofurantoinu nebyl od jeho zavedení v roce 1953 významným problémem. Zkřížená rezistence s antibiotiky a sulfonamidy nebyla pozorována a přenosná rezistence je nanejvýš velmi vzácným jevem.
Bylo prokázáno, že nitrofurantoin je účinný proti většině kmenů následujících bakterií jak in vitro, tak při klinických infekcích (viz Indikace a použití):
Aerobní a fakultativní grampozitivní mikroorganismy:
Staphylococcus aureus
Enterokoky (např. Enterococcus faecalis)
Aerobní a fakultativní gramnegativní mikroorganismy:
Escherichia coli
POZNÁMKA: Zatímco nitrofurantoin má vynikající účinnost proti Enterococcus faecalis, většina izolátů Enterococcus faecium není citlivá na nitrofurantoin.
A nejméně 90 % následujících mikroorganismů vykazuje in vitro minimální inhibiční koncentraci (MIC) nižší nebo rovnou citlivému bodu zlomu pro nitrofurantoin. Účinnost nitrofurantoinu v léčbě klinických infekcí způsobených těmito mikroorganismy však nebyla stanovena v odpovídajících a dobře kontrolovaných studiích.
Aerobní a fakultativní grampozitivní mikroorganismy:
Koaguláza-negativní stafylokoky (včetně Staphylococcus
epidermidis a Staphylococcus saprophyticus)
Streptococcus agalactiae
Streptokoky skupiny D
Streptokoky skupiny Viridans
Aerobní a fakultativní gram-negativní mikroorganismy:
Citrobacter amalonaticus
Citrobacter diversus
Citrobacter freundii
Klebsiella oxytoca
Klebsiella ozaenae
POZNÁMKA: Některé kmeny Enterobacter species a Klebsiella species jsou rezistentní k nitrofurantoinu.
Testování citlivosti:
Specifické informace týkající se interpretačních kritérií testů citlivosti a souvisejících testovacích metod a standardů kontroly kvality uznaných FDA pro tento léčivý přípravek viz: https://www.fda.gov/STIC.
INDIKACE A POUŽITÍ:
Tobolky nitrofurantoinu (makrokrystaly) jsou specificky indikovány k léčbě infekcí močových cest, pokud jsou způsobeny citlivými kmeny Escherichia coli, enterokoky, Staphylococcus aureus a některými citlivými kmeny druhů Klebsiella a Enterobacter.
Nitrofurantoin není indikován k léčbě pyelonefritidy nebo perinefrických abscesů.
Aby se omezil rozvoj bakterií rezistentních vůči lékům a zachovala se účinnost nitrofurantoinu tobolky (makrokrystaly) a jiných antibakteriálních léčiv, měly by se nitrofurantoin tobolky (makrokrystaly) používat pouze k léčbě nebo prevenci infekcí, u nichž je prokázáno nebo existuje silné podezření, že jsou způsobeny citlivými bakteriemi. Pokud jsou k dispozici informace o kultivaci a citlivosti, měly by být zváženy při výběru nebo úpravě antibakteriální léčby. Pokud takové údaje nejsou k dispozici, může k empirickému výběru terapie přispět místní epidemiologie a vzorce citlivosti.
Nitrofurantoinům chybí širší tkáňová distribuce jiných terapeutických látek schválených pro infekce močových cest. V důsledku toho je mnoho pacientů, kteří jsou léčeni nitrofurantoinovými tobolkami (makrokrystaly), náchylných k přetrvávání nebo opětovnému výskytu bakteriurie. Před ukončením léčby a po jejím ukončení by měly být odebrány vzorky moči na kultivaci a vyšetření citlivosti. Pokud po léčbě nitrofurantoinovými tobolkami (makrokrystaly) dojde k perzistenci nebo opětovnému výskytu bakteriurie, měly by být zvoleny jiné léčebné přípravky s širší tkáňovou distribucí. Při zvažování použití nitrofurantoinových tobolek (makrokrystalů) by měla být nižší míra eradikace vyvážena zvýšeným potenciálem systémové toxicity a vzniku antimikrobiální rezistence při použití látek s širší tkáňovou distribucí.
KONTRAINDIKACE:
Kontraindikací je anurie, oligurie nebo významná porucha funkce ledvin (clearance kreatininu pod 60 ml za minutu nebo klinicky významně zvýšený sérový kreatinin). Léčba tohoto typu pacientů s sebou nese zvýšené riziko toxicity z důvodu zhoršeného vylučování léčiva. Vzhledem k možnosti vzniku hemolytické anémie v důsledku nezralých enzymových systémů erytrocytů (nestabilita glutathionu) je přípravek kontraindikován u těhotných pacientek v termínu porodu (38. až 42. týden těhotenství), během porodu nebo při hrozícím nástupu porodu. Ze stejného důvodu je přípravek kontraindikován u novorozenců mladších jednoho měsíce.
Tobolky nitrofurantoinu (makrokrystaly) jsou kontraindikovány u pacientů s předchozí anamnézou cholestatické žloutenky/jaterní dysfunkce spojené s nitrofurantoinem.
Nitrofurantoin tobolky (makrokrystaly) jsou rovněž kontraindikovány u pacientů se známou přecitlivělostí na nitrofurantoin.
VAROVÁNÍ:
Plicní reakce:
U PACIENTŮ LÉČENÝCH NITROFURANTOINEM BYLY ZJIŠTĚNY AKUTNÍ, SUBAKUTNÍ NEBO CHRONICKÉ PULMONÁRNÍ REAKCE. POKUD SE TYTO REAKCE VYSKYTNOU, JE TŘEBA NITROFURANTOIN (MAKROKRYSTALY) VYSADIT A PŘIJMOUT VHODNÁ OPATŘENÍ. VE ZPRÁVÁCH SE JAKO PŘÍČINA ÚMRTÍ UVÁDĚJÍ PLICNÍ REAKCE.
CHRONICKÉ PLICNÍ REAKCE (DIFÚZNÍ INTERSTICIÁLNÍ PNEUMONITIDA NEBO PLICNÍ FIBRÓZA, PŘÍPADNĚ OBOJÍ) SE MOHOU VYVINOUT ZÁKEŘNĚ. TYTO REAKCE SE VYSKYTUJÍ VZÁCNĚ A OBVYKLE U PACIENTŮ, KTEŘÍ JSOU LÉČENI ŠEST MĚSÍCŮ NEBO DÉLE. PEČLIVÉ SLEDOVÁNÍ STAVU PLIC U PACIENTŮ, KTEŘÍ DOSTÁVAJÍ DLOUHODOBOU LÉČBU, JE OPODSTATNĚNÉ A VYŽADUJE, ABY BYL ZVÁŽEN PŘÍNOS LÉČBY OPROTI MOŽNÝM RIZIKŮM (VIZ RESPIRAČNÍ REAKCE).
Hepatotoxicita:
Jaterní reakce, včetně hepatitidy, cholestatické žloutenky, chronické aktivní hepatitidy a jaterní nekrózy, se vyskytují vzácně. Byly hlášeny případy úmrtí. Nástup chronické aktivní hepatitidy může být zákeřný a pacienti by měli být pravidelně sledováni kvůli změnám biochemických testů, které by ukazovaly na poškození jater. Pokud se hepatitida objeví, měl by být lék okamžitě vysazen a měla by být přijata vhodná opatření.
Neuropatie:
Vyskytla se periferní neuropatie, která se může stát závažnou nebo ireverzibilní. Byly hlášeny případy úmrtí. Stavy, jako je porucha funkce ledvin (clearance kreatininu pod 60 ml za minutu nebo klinicky významné zvýšení sérového kreatininu), anémie, diabetes mellitus, nerovnováha elektrolytů, nedostatek vitaminu B a vysilující onemocnění, mohou zvýšit výskyt periferní neuropatie. Pacienti, kteří jsou dlouhodobě léčeni, by měli být pravidelně sledováni z hlediska změn renálních funkcí.
Optická neuritida byla v postmarketingových zkušenostech s přípravky obsahujícími nitrofurantoin hlášena vzácně.
Hemolytická anémie:
Nitrofurantoinem byly vyvolány případy hemolytické anémie primocitlivého typu. Hemolýza zřejmě souvisí s nedostatkem glukózo-6-fosfátdehydrogenázy v červených krvinkách postižených pacientů. Tento deficit se vyskytuje u 10 % černochů a u malého procenta etnických skupin středomořského a blízkovýchodního původu. Hemolýza je indikací k přerušení podávání nitrofurantoinu (makrokrystalů); po vysazení léku hemolýza ustává.
Průjmy spojené s Clostridium difficile:
Průjmy spojené s Clostridium difficile (CDAD) byly hlášeny při užívání téměř všech antibakteriálních látek, včetně nitrofurantoinu, a mohou mít různou závažnost od mírného průjmu až po fatální kolitidu. Léčba antibakteriálními přípravky mění normální flóru tlustého střeva, což vede k přemnožení C. difficile.
C. difficile produkuje toxiny A a B, které přispívají k rozvoji CDAD. Kmeny C. difficile produkující hypertoxiny způsobují zvýšenou morbiditu a mortalitu, protože tyto infekce mohou být refrakterní na antimikrobiální léčbu a mohou vyžadovat kolektomii. Na CDAD je třeba myslet u všech pacientů, u kterých se po užívání antibiotik objeví průjem. Je třeba pečlivě odebrat anamnézu, protože bylo hlášeno, že CDAD se objevuje více než dva měsíce po podání antibakteriálních látek. Pokud je podezření na CDAD nebo je potvrzeno, může být nutné přerušit pokračující užívání antibiotik, která nejsou zaměřena proti C. difficile. Podle klinické indikace by měla být zavedena vhodná regulace tekutin a elektrolytů, doplnění bílkovin, antibiotická léčba C. difficile a chirurgické vyšetření.
POKYNY:
Informace pro pacienty:
Pacientům je třeba doporučit, aby nitrofurantoin (makrokrystaly) užívali s jídlem, aby se dále zvýšila tolerance a zlepšila absorpce léčiva. Pacienti by měli být poučeni, aby dokončili celou léčbu; měli by však být upozorněni, aby kontaktovali svého lékaře, pokud se během léčby objeví jakékoli neobvyklé příznaky.
Mnoho pacientů, kteří netolerují mikrokrystalický nitrofurantoin, je schopno užívat nitrofurantoin (makrokrystaly) bez nevolnosti.
Pacienti by měli být poučeni, aby během užívání nitrofurantoinu (makrokrystalů) nepoužívali antacidní přípravky obsahující trikřemičitan hořečnatý.
Pacienti by měli být poučeni, že antibakteriální léčiva včetně nitrofurantoinu (makrokrystalů) by se měla používat pouze k léčbě bakteriálních infekcí. Neléčí virové infekce (např. nachlazení). Pokud je nitrofurantoin (makrokrystaly) předepsán k léčbě bakteriální infekce, pacienti by měli být informováni, že ačkoli je běžné, že se na počátku léčby cítí lépe, léky by měli užívat přesně podle pokynů. Vynechání dávek nebo nedokončení celého cyklu léčby může (1) snížit účinnost okamžité léčby a (2) zvýšit pravděpodobnost, že si bakterie vytvoří rezistenci a v budoucnu nebudou léčitelné nitrofurantoinem (makrokrystaly) nebo jinými antibakteriálními léky.
Průjem je běžný problém způsobený antibiotiky, který obvykle končí po vysazení antibiotika. Někdy se po zahájení léčby antibiotiky může u pacientů objevit vodnatá a krvavá stolice (s žaludečními křečemi a horečkou nebo bez nich) dokonce až dva nebo více měsíců po užití poslední dávky antibiotika. Pokud k tomu dojde, měli by pacienti co nejdříve kontaktovat svého lékaře.
Obecně:
Předepisování nitrofurantoinu (makrokrystalů) při absenci prokázané nebo silně suspektní bakteriální infekce nebo profylaktické indikace pravděpodobně nepřináší pacientovi prospěch a zvyšuje riziko vzniku bakterií rezistentních na lék.
Lékové interakce:
Antacida obsahující trisilikát hořečnatý při současném podávání s nitrofurantoinem snižují rychlost i rozsah absorpce. Mechanismem této interakce je pravděpodobně adsorpce nitrofurantoinu na povrch trisilikátu hořečnatého.
Urikosurické léky, jako je probenecid a sulfinpyrazon, mohou inhibovat renální tubulární sekreci nitrofurantoinu. Výsledné zvýšení sérových hladin nitrofurantoinu může zvýšit jeho toxicitu a snížené hladiny v moči by mohly snížit jeho účinnost jako antibakteriálního přípravku močových cest.
Interakce mezi léčivem a laboratorními testy:
V důsledku přítomnosti nitrofurantoinu může dojít k falešně pozitivní reakci na glukózu v moči. To bylo pozorováno u Benedictova a Fehlingova roztoku, ale ne u enzymatického testu na glukózu.
Karcinogeneze, mutageneze, poškození plodnosti:
Nitrofurantoin nebyl karcinogenní při podávání samicím potkanů Holtzmanových po dobu 44,5 týdne nebo samicím potkanů Sprague-Dawley po dobu 75 týdnů. Dvě chronické biologické zkoušky na hlodavcích s využitím samců a samic potkanů Sprague-Dawley a dvě chronické biologické zkoušky na švýcarských myších a myších BDF1 neodhalily žádné důkazy karcinogenity.
Nitrofurantoin vykazoval důkazy karcinogenní aktivity u samic myší B6C3F1, což se projevilo zvýšeným výskytem tubulárních adenomů, benigních smíšených nádorů a nádorů z granulózových buněk vaječníků. U samců potkanů F344/N byl zaznamenán zvýšený výskyt neobvyklých novotvarů z tubulárních buněk ledvin, osteosarkomů kostí a novotvarů podkožní tkáně. V jedné studii zahrnující subkutánní podání 75 mg/kg nitrofurantoinu březím myším samicím byly v generaci F1 pozorovány plicní papilární adenomy neznámého významu.
Bylo prokázáno, že nitrofurantoin indukuje bodové mutace u některých kmenů Salmonella typhimurium a dopředné mutace u buněk myšího lymfomu L5178Y. Nitrofurantoin vyvolal zvýšený počet sesterských chromatidových výměn a chromozomálních aberací v buňkách vaječníků čínského křečka, ale ne v lidských buňkách v kultuře. Výsledky testu recesivní letality vázané na pohlaví u drozofily byly po podání nitrofurantoinu krmením nebo injekčně negativní. Nitrofurantoin nevyvolal dědičné mutace ve zkoumaných modelech hlodavců.
Význam zjištění karcinogenity a mutagenity ve vztahu k terapeutickému použití nitrofurantoinu u lidí není znám.
Podávání vysokých dávek nitrofurantoinu potkanům způsobuje dočasnou zástavu spermatogeneze; ta je reverzibilní při přerušení podávání léku. Dávky 10 mg/kg/den a vyšší u zdravých lidských mužů mohou v některých nepředvídatelných případech vyvolat mírnou až středně závažnou zástavu spermií s poklesem počtu spermií.
Těhotenství:
Teratogenní účinky:
Těhotenství kategorie B.
Několik reprodukčních studií bylo provedeno na králících a potkanech v dávkách až šestinásobně vyšších, než je dávka pro člověka, a neodhalily žádné důkazy o poškození fertility nebo poškození plodu v důsledku nitrofurantoinu. V jediné publikované studii provedené na myších při 68násobku lidské dávky (na základě mg/kg podaných matce) byla pozorována růstová retardace a nízký výskyt drobných a běžných malformací. Při 25násobku lidské dávky však malformace plodu pozorovány nebyly; význam těchto zjištění pro člověka není jistý. Neexistují však žádné adekvátní a dobře kontrolované studie u těhotných žen. Vzhledem k tomu, že reprodukční studie na zvířatech nejsou vždy prediktivní pro reakci u lidí, měl by být tento léčivý přípravek používán během těhotenství pouze v případě jasné potřeby.
Neteratogenní účinky:
V jedné publikované studii transplacentární karcinogenity bylo prokázáno, že nitrofurantoin vyvolává u myší F1 generace papilární adenomy plic v dávkách 19krát vyšších, než je lidská dávka v mg/kg. Vztah tohoto nálezu k potenciální lidské karcinogenezi není v současné době znám. Vzhledem k nejistotě ohledně důsledků těchto údajů získaných na zvířatech pro člověka by měl být tento léčivý přípravek používán během těhotenství pouze v případě jasné potřeby.
Porod a porod:
Viz KONTRAINDIKACE.
Kojící matky:
Nitrofurantoin byl ve stopovém množství zjištěn v lidském mateřském mléce. Vzhledem k možnosti závažných nežádoucích účinků nitrofurantoinu u kojených dětí do jednoho měsíce věku je třeba rozhodnout, zda přerušit kojení nebo vysadit lék, s ohledem na význam léku pro matku (viz KONTRAINDIKACE).
Pediatrické použití:
Nitrofurantoin (makrokrystaly) je kontraindikován u kojenců mladších jednoho měsíce (viz KONTRAINDIKACE).
Geriatrické použití:
Klinické studie nitrofurantoinu (makrokrystalů) nezahrnovaly dostatečný počet subjektů starších 65 let, aby bylo možné určit, zda reagují odlišně od mladších subjektů. Další uváděné klinické zkušenosti nezjistily rozdíly v reakcích mezi staršími a mladšími pacienty. Spontánní hlášení naznačují vyšší podíl plicních reakcí, včetně úmrtí, u starších pacientů; tyto rozdíly zřejmě souvisejí s vyšším podílem starších pacientů dlouhodobě léčených nitrofurantoinem. Stejně jako u mladších pacientů jsou chronické plicní reakce obecně pozorovány u pacientů, kteří jsou léčeni šest měsíců nebo déle (viz VAROVÁNÍ). Spontánní hlášení rovněž naznačují zvýšený podíl závažných jaterních reakcí, včetně úmrtí, u starších pacientů (viz UPOZORNĚNÍ).
Všeobecně je třeba při předepisování nitrofurantoinu (makrokrystalů) vzít v úvahu vyšší četnost snížené funkce jater, ledvin nebo srdce a souběžné onemocnění nebo léčbu jinými léky. Je známo, že tento léčivý přípravek je ve značné míře vylučován ledvinami a riziko toxických reakcí na tento léčivý přípravek může být vyšší u pacientů se zhoršenou funkcí ledvin. Anurie, oligurie nebo významná porucha funkce ledvin (clearance kreatininu pod 60 ml za minutu nebo klinicky významné zvýšení sérového kreatininu) jsou kontraindikací (viz KONTRAINDIKACE). Vzhledem k tomu, že u starších pacientů je vyšší pravděpodobnost snížené funkce ledvin, je třeba věnovat pozornost výběru dávky a může být užitečné monitorovat funkci ledvin.
NĚŽNÉ REAKCE:
Respirační:
MŮŽE DOJÍT K CHRONICKÝM, SUBAKUTNÍM NEBO AKUTNÍM PULMONÁRNÍM HYPERSENZIVNÍM REAKCÍM.
CHRONICKÉ PULMONÁRNÍ REAKCE SE OBECNĚ OBJEVUJÍ U PACIENTŮ, KTEŘÍ PŘIJALI KONTINUÁLNÍ LÉČBU PO ŠEST MĚSÍCŮ NEBO DÉLE. MALÁTNOST, DUŠNOST PŘI NÁMAZE, KAŠEL A ZMĚNA PLICNÍCH FUNKCÍ JSOU BĚŽNÉ PROJEVY, KTERÉ SE MOHOU OBJEVIT ZÁKEŘNĚ. RADIOLOGICKÉ A HISTOLOGICKÉ NÁLEZY DIFUZNÍ INTERSTICIÁLNÍ PNEUMONITIDY NEBO FIBRÓZY, PŘÍPADNĚ OBOJÍHO, JSOU ROVNĚŽ ČASTÝMI PROJEVY CHRONICKÉ PLICNÍ REAKCE. HOREČKA JE ZŘÍDKA VÝRAZNÁ.
ZÁVAŽNOST CHRONICKÉ PLICNÍ REAKCE A STUPEŇ JEJÍHO ODEZNĚNÍ ZŘEJMĚ SOUVISÍ S DÉLKOU LÉČBY PO OBJEVENÍ PRVNÍCH KLINICKÝCH PŘÍZNAKŮ. PLICNÍ FUNKCE MOHOU BÝT TRVALE NARUŠENY, A TO I PO UKONČENÍ LÉČBY. RIZIKO JE VĚTŠÍ, KDYŽ CHRONICKÉ PULMONÁRNÍ REAKCE NEJSOU VČAS ROZPOZNÁNY.
U subakutních plicních reakcí se horečka a eozinofilie vyskytují méně často než u akutní formy. Po ukončení léčby může zotavení vyžadovat několik měsíců. Pokud není rozpoznáno, že příznaky souvisejí s lékem, a léčba nitrofurantoinem není ukončena, mohou se příznaky zhoršit.
Akutní plicní reakce se běžně projevují horečkou, zimnicí, kašlem, bolestí na hrudi, dušností, plicní infiltrací s konsolidací nebo pleurálním výpotkem na rentgenu a eozinofilií. Akutní reakce se obvykle objevují během prvního týdne léčby a jsou reverzibilní po ukončení léčby. Ústup je často dramatický (viz UPOZORNĚNÍ).
Změny EKG (např, nespecifické změny ST/T vlny, blokáda ramének) byly hlášeny v souvislosti s plicními reakcemi.
Kyanóza byla hlášena vzácně.
Jaterní:
Jaterní reakce, včetně hepatitidy, cholestatické žloutenky, chronické aktivní hepatitidy a jaterní nekrózy, se vyskytly vzácně (viz UPOZORNĚNÍ).
Neurologické:
Periferní neuropatie, která se může stát závažnou nebo nevratnou, se vyskytla. Byly hlášeny případy úmrtí. Stavy, jako je porucha funkce ledvin (clearance kreatininu pod 60 ml za minutu nebo klinicky významné zvýšení sérového kreatininu), anémie, diabetes mellitus, nerovnováha elektrolytů, nedostatek vitaminu B a vysilující onemocnění, mohou zvýšit možnost vzniku periferní neuropatie (viz UPOZORNĚNÍ).
Při užívání nitrofurantoinu byly rovněž hlášeny astenie, vertigo, nystagmus, závratě, bolesti hlavy a ospalost.
Vzácně byla hlášena nezhoubná nitrolební hypertenze (pseudotumor cerebri), zmatenost, deprese, optická neuritida a psychotické reakce. Vzácně byly hlášeny vyboulené fontanely jako projev benigní intrakraniální hypertenze u kojenců.
Dermatologické:
Vzácně byly hlášeny exfoliativní dermatitida a multiformní erytém (včetně Stevens-Johnsonova syndromu). Byla také hlášena přechodná alopecie.
Alergické:
Byl hlášen syndrom podobný lupusu spojený s plicními reakcemi na nitrofurantoin. Rovněž byl hlášen angioedém, makulopapulózní, erytematózní nebo ekzematózní erupce, pruritus, kopřivka, anafylaxe, artralgie, myalgie, léková horečka, zimnice a vaskulitida (někdy spojená s plicními reakcemi). Reakce přecitlivělosti představují nejčastější spontánně hlášené nežádoucí účinky v celosvětových postmarketingových zkušenostech s přípravky obsahujícími nitrofurantoin.
Gastrointestinální:
Naopak nejčastěji se vyskytují nevolnost, emeze a anorexie. Bolesti břicha a průjem jsou méně časté gastrointestinální reakce. Tyto reakce související s dávkou lze minimalizovat snížením dávky. Byla hlášena sialadenitida a pankreatitida. Ojediněle byly hlášeny případy pseudomembranózní kolitidy při užívání nitrofurantoinu. K nástupu příznaků pseudomembranózní kolitidy může dojít během antimikrobiální léčby nebo po ní (viz UPOZORNĚNÍ).
Hematologické:
Vzácně byla hlášena kyanóza sekundárně způsobená methemoglobinémií.
Různé:
Stejně jako u jiných antimikrobiálních látek, superinfekce způsobené rezistentními organismy, např, Pseudomonas species nebo Candida species, se mohou vyskytnout.
Laboratorní nežádoucí účinky:
Při použití nitrofurantoinu byly hlášeny následující laboratorní nežádoucí účinky: zvýšení AST (SGOT), zvýšení ALT (SGPT), snížení hemoglobinu, zvýšení sérového fosforu, eozinofilie, anémie z nedostatku glukózo-6-fosfátdehydrogenázy (viz VAROVÁNÍ), agranulocytóza, leukopenie, granulocytopenie, hemolytická anémie, trombocytopenie, megaloblastická anémie. Ve většině případů tyto hematologické abnormality po ukončení léčby ustoupily. Vzácně byla hlášena aplastická anémie.
Předávkování
Ojedinělé případy akutního předávkování nitrofurantoinem (makrokrystaly) neměly za následek žádné specifické příznaky kromě zvracení. Doporučuje se indukce emeze. Neexistuje žádné specifické antidotum, ale je třeba udržovat vysoký příjem tekutin, aby se podpořilo vylučování léčiva močí. Je dialyzovatelný.
DÁVKOVÁNÍ A ZPŮSOB PODÁVÁNÍ:
Tobolky nitrofurantoinu (makrokrystaly) by měly být podávány s jídlem, aby se zlepšila absorpce léčiva a u některých pacientů i jeho snášenlivost.
Dospělí:
50 mg až 100 mg čtyřikrát denně – nižší dávka se doporučuje u nekomplikovaných infekcí močových cest.
Pediatričtí pacienti:
5 až 7 mg/kg tělesné hmotnosti za 24 hodin podávaných ve čtyřech rozdělených dávkách (kontraindikováno do jednoho měsíce věku).
Léčba by měla pokračovat po dobu jednoho týdne nebo nejméně 3 dny po dosažení sterility moči. Pokračující infekce indikuje potřebu přehodnocení.
Pro dlouhodobou supresivní léčbu u dospělých může být adekvátní snížení dávky na 50-100 mg před spaním. Pro dlouhodobou supresivní léčbu u pediatrických pacientů mohou být adekvátní dávky až 1 mg/kg za 24 hodin, podané v jedné dávce nebo ve dvou rozdělených dávkách. Viz oddíl UPOZORNĚNÍ týkající se rizik spojených s dlouhodobou léčbou.
Jak se dodává:
Nitrofurantoin tobolky USP (makrokrystaly) jsou dostupné v následujícím složení:
50 mg neprůhledné, bílé tělo a neprůhledný, žlutý uzávěr s potiskem černým inkoustem „WATSON“ na víčku a „5780“ na těle.
NDC 0115-2023-10 lahviček po 100
100 mg neprůhledné, žluté tobolky s potiskem černým inkoustem „WATSON“ na víčku a „5781“ na těle.
NDC 0115-2024-10 lahviček po 100
Uchovávejte při teplotě 20° až 25°C .
Vyrábí:
Watson Pharma Private Limited
Verna, Salcette Goa 403722 INDIE
Distribuce::
Amneal Pharmaceuticals LLC
Bridgewater, NJ 08807
Chcete-li hlásit PODEZŘENÍ NA NEŽÁDOUCÍ ÚČINKY, kontaktujte společnost Amneal Pharmaceuticals na telefonním čísle 1-877-835-5472 nebo FDA na čísle 1-800-FDA-1088 nebo na www.fda.gov/medwatch.
Rev. 11-2019-00
ZÁKLADNÍ LÉČIVÝ PŘÍPRAVEK – 50 mg

ZÁKLADNÍ LÉČIVÝ PŘÍPRAVEK – 50 mg 100 mg

| NITROFURANTOIN nitrofurantoin tobolka |
|||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||
| NITROFURANTOIN nitrofurantoin tobolky |
|||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||
Označovatel – Amneal Pharmaceuticals of New York LLC (123797875)
Často kladené otázky
- Jaká antibiotika se používají k léčbě infekce močových cest?
- Co je nitrofurantoin s „dvojím uvolňováním“?
Další informace o nitrofurantoinu
- Nežádoucí účinky
- Během těhotenství nebo kojení
- Informace o dávkování
- Tipy pro pacienty
- Lék. Obrázky
- Lékové interakce
- Srovnání alternativ
- Podpůrná skupina
- Cena &Kupóny
- En Español
- 1538 recenzí
- Třída léků: Léčiva: proti močovým cestáminfekční
Zdroje pro spotřebitele
- Informace pro pacienty
- Nitrofurantoin (rozšířené čtení)
Zdroje pro odborníky
- Předepisování léčivých přípravků Informace
- Nitrofurantoin (Odborné rady pro pacienty)
- Nitrofurantoin kapsle (FDA)
- Nitrofurantoin perorální suspenze (FDA)
Další značky Macrobid, Macrodantin, Furadantin
Související léčebné příručky
- Infekce močových cest
- Prevence infekce močového měchýře
- Infekce močového měchýře
Vyjádření lékařské odpovědnosti